Receptor (biochemie) - Receptor (biochemistry)
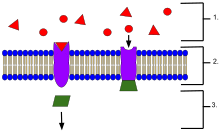
- Ligandy, umístěné mimo buňku
- Ligandy se připojují ke specifickým receptorovým proteinům na základě tvaru aktivního místa proteinu.
- Jakmile se ligand připojí k receptoru, receptor uvolní posla.
v biochemie a farmakologie, receptory jsou chemické struktury složené z protein, které přijímají a transduce signály, které mohou být integrovány do biologických systémů.[1] Tyto signály jsou obvykle[poznámka 1] chemické posly, které se vážou na receptor a způsobují nějakou formu buněčné / tkáňové reakce, např. změna elektrické aktivity buňky. Existují tři hlavní způsoby, jak lze klasifikovat působení receptoru: relé signálu, zesílení nebo integrace.[2] Při přenosu se signál posílá dále, zesílení zvyšuje účinek singlu ligand a integrace umožňuje začlenění signálu do jiné biochemické dráhy.[2]
Receptor bílkoviny lze klasifikovat podle jejich umístění. Mezi transmembránové receptory patří receptory spojené s iontovými kanály (ionotropní), Receptory hormonů vázaných na G protein (metabotropní) a vázané na enzymy hormonální receptory.[1] Intracelulární receptory jsou ty, které se nacházejí uvnitř buňky, a zahrnují cytoplazmatické receptory a jaderné receptory.[1] Molekula, která se váže na receptor, se nazývá a ligand, a může být protein nebo peptid (krátký protein) nebo jiný malá molekula jako a neurotransmiter, hormon, farmaceutický lék, toxin, iont vápníku nebo části vnější části viru nebo mikrobu. Endogenně vyrobená látka, která se váže na konkrétní receptor, se označuje jako jeho endogenní ligand. Např. endogenní ligand pro nikotinový acetylcholinový receptor je acetylcholin, ale receptor může být také aktivován nikotin[3][4] a blokováno uživatelem kurare.[5] Receptory konkrétního typu jsou spojeny se specifickými buněčnými biochemickými cestami, které odpovídají signálu. I když se ve většině buněk nachází mnoho receptorů, každý receptor se váže pouze s ligandy určité struktury. To bylo analogicky srovnáváno s jak zámky přijímají pouze speciálně tvarované klíče. Když se ligand váže na odpovídající receptor, aktivuje nebo inhibuje biochemickou cestu spojenou s receptorem.
Struktura

Struktury receptorů jsou velmi rozmanité a zahrnují mimo jiné následující hlavní kategorie:
- Typ 1: Ligandem řízené iontové kanály (ionotropní receptory) - Tyto receptory jsou obvykle cílem rychlých neurotransmiterů, jako je acetylcholin (nikotinový) a GABA; aktivace těchto receptorů vede ke změnám v pohybu iontů přes membránu. Mají heteromerní strukturu v tom, že každá podjednotka se skládá z extracelulární domény vázající ligand a transmembránové domény, která zahrnuje čtyři transmembránové alfa helixy. Dutiny vázající ligand jsou umístěny na rozhraní mezi podjednotkami.
- Typ 2: Receptory spojené s G proteinem (metabotropní receptory) - Toto je největší rodina receptorů a zahrnuje receptory pro několik hormonů a pomalé vysílače, např. dopamin, metabotropní glutamát. Skládají se ze sedmi transmembránových alfa šroubovic. Smyčky spojující alfa helixy tvoří extracelulární a intracelulární domény. Vazebné místo pro větší peptidové ligandy je obvykle lokalizováno v extracelulární doméně, zatímco vazebné místo pro menší nepeptidové ligandy je často umístěno mezi sedmi alfa helixy a jednou extracelulární smyčkou.[6] Výše uvedené receptory jsou spojeny s různými intracelulárními efektorovými systémy prostřednictvím G proteiny.[7]
- Typ 3: Kinázové a související receptory (viz „Receptorová tyrosinkináza " a "Receptor vázaný na enzym ") - Skládají se z extracelulární domény obsahující vazebné místo pro ligand a intracelulární domény, často s enzymatickou funkcí, spojené jednou transmembránovou alfa šroubovicí. inzulinový receptor je příklad.
- Typ 4: Jaderné receptory - I když se jim říká jaderné receptory, ve skutečnosti se nacházejí v cytoplazma a migrovat do jádro po navázání s jejich ligandy. Skládají se z a C-terminál oblast vázající ligand, jádro Doména vázající DNA (DBD) a an N-terminál doména, která obsahuje doménu AF1(aktivační funkce 1) oblast. Oblast jádra má dva zinkové prsty, které jsou zodpovědné za rozpoznávání sekvencí DNA specifických pro tento receptor. N-konec interaguje s jinými buněčnými transkripčními faktory způsobem nezávislým na ligandu; a v závislosti na těchto interakcích může modifikovat vazbu / aktivitu receptoru. Steroidní a tyroidní hormonální receptory jsou příklady takových receptorů.[8]
Membránové receptory mohou být izolovány z buněčných membrán pomocí komplexních extrakčních postupů rozpouštědla, čistící prostředky a / nebo afinitní čištění.
Struktury a působení receptorů lze studovat pomocí biofyzikálních metod, jako jsou Rentgenová krystalografie, NMR, kruhový dichroismus, a duální polarizační interferometrie. Počítačové simulace dynamického chování receptorů byly použity k získání pochopení jejich mechanismů působení.
Vazba a aktivace
Ligandová vazba je rovnováha proces. Ligandy se vážou na receptory a disociují se od nich podle zákon hromadné akce v následující rovnici, pro ligand L a receptor, R. Závorky kolem chemických druhů označují jejich koncentrace.
Jedním z ukazatelů toho, jak dobře se molekula hodí k receptoru, je její vazebná afinita, která nepřímo souvisí s disociační konstanta K.d. Dobrá shoda odpovídá vysoké afinitě a nízké K.d. Konečná biologická odpověď (např. kaskáda druhého posla, svalová kontrakce), je dosaženo pouze po aktivaci významného počtu receptorů.
Afinita je měřítkem tendence ligandu vázat se na svůj receptor. Účinnost je míra vázaného ligandu k aktivaci jeho receptoru.
Agonisté versus antagonisté
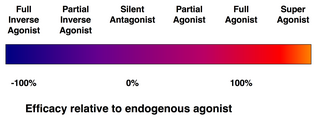
Ne každý ligand, který se váže na receptor, také aktivuje tento receptor. Existují následující třídy ligandů:
- (Úplný) agonisté jsou schopny aktivovat receptor a vést k silné biologické reakci. Přírodní endogenní ligand s největším účinnost pro daný receptor je ze své podstaty plný agonista (100% účinnost).
- Částeční agonisté neaktivujte receptory s maximální účinností, dokonce ani s maximální vazbou, což způsobuje částečné odpovědi ve srovnání s úplnými agonisty (účinnost mezi 0 a 100%).
- Antagonisté vázat se na receptory, ale neaktivovat je. To má za následek blokádu receptoru, inhibici vazby agonistů a inverzních agonistů. Antagonisté receptoru mohou být kompetitivní (nebo reverzibilní) a soutěžit s agonistou o receptor, nebo to mohou být ireverzibilní antagonisté, kteří tvoří kovalentní vazby (nebo nekovalentní vazby s extrémně vysokou afinitou) s receptorem a úplně jej blokovat. Inhibitor protonové pumpy omeprazol je příkladem nevratného antagonisty. Účinky ireverzibilního antagonismu lze zvrátit pouze syntézou nových receptorů.
- Inverzní agonisté snižují aktivitu receptorů inhibicí jejich konstitutivní aktivity (negativní účinnost).
- Allosterické modulátory: Neváží se na vazebné místo agonisty receptoru, ale místo toho na specifická alosterická vazebná místa, kterými modifikují účinek agonisty. Například, benzodiazepiny (BZD) se váží na web BZD na internetu GABAA receptor a potencovat účinek endogenní GABA.
Všimněte si, že myšlenka agonismu a antagonismu receptoru se týká pouze interakce mezi receptory a ligandy, a nikoli jejich biologických účinků.
Konstituční činnost
Receptor, který je schopen produkovat biologickou odpověď v nepřítomnosti navázaného ligandu, vykazuje „konstitutivní aktivitu“.[9] Konstitutivní aktivita receptoru může být blokována inverzní agonista. Léky proti obezitě rimonabant a taranabant jsou inverzní agonisté kanabinoidu CB1 receptor a přestože způsobily významnou ztrátu hmotnosti, oba byly staženy z důvodu vysokého výskytu deprese a úzkosti, o nichž se předpokládá, že souvisejí s inhibicí konstitutivní aktivity kanabinoidního receptoru.
The GABAA receptor má konstitutivní aktivitu a vede nějaký bazální proud v nepřítomnosti agonisty. To dovoluje beta karbolin působit jako inverzní agonista a snižovat proud níže bazální hladiny.
Mutace v receptorech, které vedou ke zvýšené konstitutivní aktivitě, jsou základem některých dědičných onemocnění, jako je předčasná puberta (kvůli mutacím v receptorech luteinizačního hormonu) a hypertyreóza (kvůli mutacím v receptorech hormonů stimulujících štítnou žlázu).
Teorie interakce lék-receptor
obsazení
Ústředním dogmatem farmakologie receptorů je, že účinek léku je přímo úměrný počtu obsazených receptorů.[Citace je zapotřebí ] Účinek léčiva dále ustává, když se komplex lék-receptor disociuje.
Ariëns & Stephenson zavedli výrazy „afinita“ a „účinnost“ k popisu působení ligandů vázaných na receptory.[10][11]
- Afinita: Schopnost léku kombinovat s receptorem za vzniku komplexu lék-receptor.
- Účinnost: Schopnost komplexu lék-receptor vyvolat reakci.
Hodnotit
Na rozdíl od přijatých Teorie povolání„Teorie rychlosti navrhuje, aby aktivace receptorů byla přímo úměrná celkovému počtu setkání léčiva s jeho receptory za jednotku času. Farmakologická aktivita je přímo úměrná rychlosti disociace a asociace, ne počet obsazených receptorů:[12]
- Agonista: Droga s rychlou asociací a rychlou disociací.
- Částečný agonista: Lék se střední asociací a střední disociací.
- Antagonista: Lék s rychlou asociací a pomalou disociací
Vyvoláno
Když se lék přiblíží k receptoru, změní tento receptor konformaci svého vazebného místa za vzniku komplexu lék-receptor.
Náhradní receptory
V některých receptorových systémech (např. Acetylcholin na neuromuskulárním spojení hladkého svalstva) jsou agonisté schopni vyvolat maximální odpověď při velmi nízkých úrovních obsazení receptorů (<1%). Tento systém má tedy rezervní receptory nebo rezervu receptorů. Toto uspořádání produkuje ekonomiku produkce a uvolňování neurotransmiterů.[8]
Regulace receptoru
Buňky se mohou zvětšit (upregulate ) nebo snížit (downregulate ) počet receptorů k danému hormon nebo neurotransmiter změnit jejich citlivost na různé molekuly. Jedná se o místně působící zpětná vazba mechanismus.
- Změna konformace receptoru tak, že vazba agonisty neaktivuje receptor. To je vidět u receptorů iontových kanálů.
- Odpojení receptoru efektorové molekuly je vidět s párovým receptorem G-proteinu.
- Receptor sekvestrace (internalizace).[13] např. v případě hormonálních receptorů.
Příklady a ligandy
Ligandy pro receptory jsou stejně rozmanité jako jejich receptory. GPCR (7TM) jsou obzvláště rozsáhlá rodina, která má nejméně 810 členů. Jsou tu také LGIC pro alespoň tucet endogenních ligandů a mnoho dalších receptorů možných prostřednictvím různých podjednotkových kompozic. Některé běžné příklady ligandů a receptorů zahrnují:[14]
Ionové kanály a receptory spojené s G proteinem
Některé příklady ionotropních (LGIC) a metabotropních (konkrétně GPCR) receptorů jsou uvedeny v tabulce níže. Hlavními neurotransmitery jsou glutamát a GABA; jiné neurotransmitery jsou neuromodulační. Tento seznam není v žádném případě vyčerpávající.
| Endogenní ligand | Receptor iontového kanálu (LGIC) | Receptor spojený s G proteinem (GPCR) | ||||
|---|---|---|---|---|---|---|
| Receptory | Ionový proud[pozn. 2] | Exogenní ligand | Receptory | G protein | Exogenní ligand | |
| Glutamát | iGluRs: NMDA, AMPA, a Kainátové receptory | Na+, K.+, Ca2+ [14] | Ketamin | Glutamátové receptory: mGluRs | Gq nebo Gi / o | - |
| GABA | GABAA (počítaje v to GABAA-rho ) | Cl− > HCO−3 [14] | Benzodiazepiny | GABAB receptor | Gi / o | Baclofen |
| Acetylcholin | nAChR | Na+, K.+, Ca2+[14] | Nikotin | mAChR | Gq nebo Gi | Muskarin |
| Glycin | Glycinový receptor (GlyR) | Cl− > HCO−3 [14] | Strychnin | - | - | - |
| Serotonin | 5-HT3 receptor | Na+, K.+ [14] | Cereulid | 5-HT1-2 nebo 4-7 | Gs, Gi / o nebo Gq | - |
| ATP | P2X receptory | Ca.2+, Na+, Mg2+ [14] | BzATP[Citace je zapotřebí ] | P2Y receptory | Gs, Gi / o nebo Gq | - |
| Dopamin | Žádné iontové kanály[Citace je zapotřebí ] | - | - | Dopaminový receptor | Gs nebo Gi / o | - |
Receptory spojené s enzymy
Mezi receptory spojené s enzymy patří receptorové tyrosinkinázy (RTK) serin / threonin-specifická protein kináza, jako v kostním morfogenetickém proteinu a guanylátcykláze, jako v receptoru atriálního natriuretického faktoru. Z RTK bylo identifikováno 20 tříd, přičemž 58 různých RTK bylo členy. Některé příklady jsou uvedeny níže:
| Rodina RTK / receptory | Člen | Endogenní ligand | Exogenní ligand |
|---|---|---|---|
| Já | EGFR | EGF | Gefitinib |
| II | Inzulínový receptor | Inzulín | Chaetochromin |
| IV | VEGFR | VEGF | Lenvatinib |
Intracelulární receptory
Receptory mohou být klasifikovány na základě jejich mechanismu nebo jejich polohy v buňce. Níže jsou uvedeny 4 příklady intracelulárního LGIC:
| Receptor | Ligand | Ionový proud |
|---|---|---|
| iontové kanály řízené cyklickými nukleotidy | cGMP (vidění ), tábor a cGTP (čich ) | Na+, K.+ [14] |
| IP3 receptor | IP3 | Ca.2+ [14] |
| Intracelulární ATP receptory | ATP (zavře kanál)[14] | K.+ [14] |
| Ryanodinový receptor | Ca.2+ | Ca.2+ [14] |
Role v genetických poruchách
Mnoho genetické poruchy zahrnovat dědičné vady v receptorových genech. Často je těžké určit, zda je receptor nefunkční nebo hormon se vyrábí na snížené úrovni; tím vzniká skupina „pseudo-hypo-“ endokrinní poruchy, kde se zdá, že je snížená hormonální hladina, zatímco ve skutečnosti je to receptor, který na hormon dostatečně nereaguje.
V imunitním systému
Hlavní receptory v imunitní systém jsou receptory rozpoznávání vzoru (PRR), mýtné receptory (TLR), zabiják aktivován a receptory inhibitorů zabijáka (KAR a KIR), receptory komplementu, Fc receptory, Receptory B buněk a Receptory T buněk.[15]
Viz také
- K.i Databáze
- Receptory spojené s iontovým kanálem
- Neuropsychofarmakologie
- Schildova regrese pro inhibici ligandového receptoru
- Transdukce signálu
- Značka kmenových buněk
- Seznam kódů MeSH (D12.776)
- Teorie receptorů
Poznámky
- ^ V případě Rhodopsinový receptor, vstup je a foton, ne chemická látka
- ^ Různé LGIC vedou proudy různých ionty. Toho je dosaženo pomocí filtrů selektivity, stejně jako u filtrů selektivní filtr kanálu K +
Reference
- ^ A b C Hall, JE (2016). Guyton a Hall učebnice lékařské fyziologie. Philadelphia, PA: Elsevier Saunders. str. 930–937. ISBN 978-1-4557-7005-2.
- ^ A b Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Základní buněčná biologie (Čtvrté vydání). New York, NY, USA: Garland Science. p. 534. ISBN 978-0-8153-4454-4.
- ^ Gotti, Cecilia; Marks, Michael. J .; Millar, Neil S .; Wonnacott, Susan (16. září 2019). „Nikotinové acetylcholinové receptory (verze 2019.4)“. Průvodce IUPHAR / BPS k farmakologii CITE. 2019 (4). doi:10.2218 / gtopdb / F76 / 2019.4. Citováno 17. listopadu 2020.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). „Kapitola 9: Autonomní nervový systém“. In Sydor A, Brown RY (eds.). Molekulární neurofarmakologie: Nadace pro klinickou neurovědu (2. vyd.). New York: McGraw-Hill Medical. p. 234. ISBN 9780071481274.
Nikotin ... je přírodní alkaloid tabákové rostliny. Lobeline je přírodní alkaloid indického tabáku. Oba léky jsou agonisté, jsou to nikotinové cholinergní receptory ...
- ^ https://www.drugs.com/mmx/curare.html
- ^ Congreve M, Marshall F (březen 2010). „Dopad struktur GPCR na farmakologii a design léčiv založený na struktuře“. British Journal of Pharmacology. 159 (5): 986–96. doi:10.1111 / j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ^ Qin K, Dong C, Wu G, Lambert NA (srpen 2011). „Předmontáž neaktivních stavů receptorů spárovaných s G (q) a heterotrimerů G (q)“. Přírodní chemická biologie. 7 (10): 740–7. doi:10.1038 / nchembio.642. PMC 3177959. PMID 21873996.
- ^ A b Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). Rang & Daleova farmakologie (7. vydání). Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8.
- ^ Milligan G (prosinec 2003). „Konstitutivní aktivita a inverzní agonisté receptorů spřažených s G proteinem: současná perspektiva“. Molekulární farmakologie. 64 (6): 1271–6. doi:10,1124 / mol.64.6.1271. PMID 14645655.
- ^ Ariens EJ (září 1954). "Afinita a vnitřní aktivita v teorii kompetitivní inhibice. I. Problémy a teorie". Archives Internationales de Pharmacodynamie et de Therapie. 99 (1): 32–49. PMID 13229418.
- ^ Stephenson RP (prosinec 1956). „Modifikace teorie receptorů“. British Journal of Pharmacology and Chemotherapy. 11 (4): 379–93. doi:10.1111 / j.1476-5381.1956.tb00006.x. PMC 1510558. PMID 13383117.
- ^ Silverman RB (2004). „3.2.C Teorie pro interakce drog - receptorů“. Organic Chemistry of Drug Design and Drug Action (2. vyd.). Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ Boulay G, Chrétien L, Richard DE, Guillemette G (listopad 1994). „Krátkodobá desenzibilizace receptoru angiotensinu II u buněk bovindové adrenální glomerulosy odpovídá posunu ze stavu s vysokou afinitou k nízkému.“ Endokrinologie. 135 (5): 2130–6. doi:10.1210 / cs.135.5.2130. PMID 7956936.
- ^ A b C d E F G h i j k l Boulpaep EL, Boron WF (2005). Lékařská fyziologie: buněčný a molekulární přístup. St. Louis, Mo: Elsevier Saunders. p. 90. ISBN 1-4160-2328-3.
- ^ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). Imunologie. Philadelphia: Wolters Kluwer Health / Lippincott Williams & Wilkins. p.20. ISBN 978-0-7817-9543-2.
externí odkazy
- Kompendium databáze IUPHAR GPCR a iontových kanálů
- Receptom lidské plazmatické membrány
- Buňka + povrch + receptory v americké národní lékařské knihovně Lékařské předměty (Pletivo)

![{ displaystyle {[{ ce {L}}] + [{ ce {R}}] { ce {<=> [{K_ {d}}]}} [{ text {LR}}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)