MAFF (gen) - MAFF (gene)
Transkripční faktor MafF je bZip Maf transkripční faktor protein že u lidí je kódován MAFF gen.[5][6]
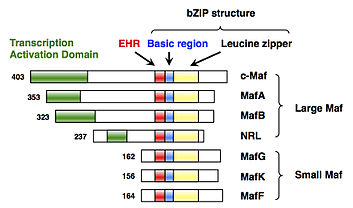
MafF je jedním z malý maf proteiny, které jsou základní oblastí a leucinový zip Transkripční faktory typu (bZIP). Genový název schválený Výborem pro genovou nomenklaturu HUGO MAFF je „v-maf ptačí muskuloaponeurotický fibrosarkom onkogenní homolog F“.
Objev
MafF byl poprvé klonován a identifikován u kuřat v roce 1993 jako člen malých genů Maf (sMaf).[5] MAFF byl identifikován u mnoha obratlovců, včetně lidí.[6] U obratlovců existují tři funkčně redundantní proteiny sMaf, MafF, MafG, a MafK.
Struktura
MafF má strukturu bZIP, která se skládá ze základní oblasti pro vazbu DNA a struktury leucinového zipu pro tvorbu dimeru.[5] Podobně jako u jiných sMafs, MafF postrádá jakékoli kanonické transkripční aktivační domény.[5]
Výraz
MAFF je široce, ale rozdílně exprimován v různých tkáních. MAFF exprese byla detekována ve všech 16 tkáních vyšetřovaných lidským BodyMap Project, ale relativně hojná v tkáních tukového, tlustého, plicního, prostatického a kosterního svalstva.[7] Člověk MAFF Gen je indukován prozánětlivými cytokiny, interleukinem 1 beta a faktorem nekrózy nádoru v myometriálních buňkách.[8]
Funkce
Z důvodu podobnosti sekvencí nebyly pozorovány žádné funkční rozdíly mezi sMafs, pokud jde o jejich bZIP struktury. sMaf tvoří samy homodimery a heterodimery s dalšími specifickými transkripčními faktory bZIP, jako jsou proteiny CNC (cap 'n' límec) [p45 NF-E2 (NFE2 ), Nrf1 (NFE2L1 ), Nrf2 (NFE2L2 ) a Nrf3 (NFE2L3 )][9][10][11][12] a Bachovy proteiny (BACH1 a BACH2 ).[13]
Cílové geny
sMaf regulují různé cílové geny v závislosti na svých partnerech. Například heterodimer p45-NF-E2-sMaf reguluje geny odpovědné za produkci krevních destiček.[9][14][15] Heterodimer Nrf2-sMaf reguluje řadu cytoprotektivních genů, jako jsou geny pro antioxidační / xenobiotické metabolizující enzymy.[11][16] Heterodimer Bach1-sMaf reguluje gen heme oxygenázy-1.[13] Zejména bylo hlášeno, že MafF reguluje gen receptoru pro oxytocin.[17] Příspěvek jednotlivých sMaf k transkripční regulaci jejich cílových genů nebyl dosud dobře prozkoumán.
Vazba nemoci
Ztráta sMafs má za následek fenotypy podobné chorobám, jak je shrnuto v tabulce níže. Myši bez MafF jsou v laboratorních podmínkách zdánlivě zdravé.[18] Myši bez MafG však vykazují mírný neuronální fenotyp a mírnou trombocytopenii,[19] chybí myši Mafg a jedna alela Mafk (Mafg−/−:: Mafk+/−) vykazují progresivní neuronální degeneraci, trombocytopenii a kataraktu,[20][21] a myši postrádající MafG a MafK (Mafg−/−:: Mafk−/−) vykazují závažnější neuronální degeneraci a umírají v perinatálním stadiu.[22] Myši postrádající MafF, MafG a MafK jsou embryonální letální, což ukazuje, že MafF je pro embryonální vývoj nepostradatelný.[23] Embryonální fibroblasty, z nichž jsou odvozeny Maff−/−:: Mafg-/−:: Mafk−/− myši v reakci na stres neaktivují cytoprotektivní geny závislé na Nrf2.[16]
| Genotyp | Myší fenotyp | ||
|---|---|---|---|
| Maff | Mafg | Mafk | |
| −/− | Žádný zjevný fenotyp za laboratorních podmínek [18] | ||
| −/− | Mírná motorická ataxie, mírná trombocytopenie [19] | ||
| −/− | +/− | Těžká motorická ataxie, progresivní neuronální degenerace, těžká trombocytopenie a katarakta [20][21] | |
| −/− | −/− | Závažnější neuronální fenotypy a perinatální smrtelné [22] | |
| −/− | +/− | −/− | Žádná závažná abnormalita [23] (Úrodná) |
| −/− | −/− | −/− | Zpomalení růstu, hypoplázie jater plodu a smrtící kolem embryonálního dne, 13.5 [23] |
| +/− (heterozygot ), −/− (homozygot ), prázdné (divoký typ) | |||
Hromadění důkazů navíc naznačuje, že jako partneři proteinů CNC a Bach se sMaf podílejí na vzniku a progresi různých lidských onemocnění, včetně neurodegenerace, arteriosklerózy a rakoviny.
Viz také
Poznámky
Verze tohoto článku z roku 2016 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Fumiki Katsuoka; Masayuki Yamamoto (4. dubna 2016), „Malé proteiny Maf (MafF, MafG, MafK): historie, struktura a funkce.“, Gen, 586 (2): 197–205, doi:10.1016 / J.GENE.2016.03.058, ISSN 0378-1119, PMC 4911266, PMID 27058431, Wikidata Q37014084 |
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000185022 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000042622 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d Fujiwara KT, Kataoka K, Nishizawa M (září 1993). „Dva noví členové rodiny onkogenů maf, mafK a mafF, kódují jaderné proteiny b-Zip bez domnělé domény trans-aktivátoru“. Onkogen. 8 (9): 2371–80. PMID 8361754.
- ^ A b „Entrez Gene: MAFF v-maf muskuloaponeurotický fibrosarkom onkogenní homolog F (ptačí)“.
- ^ Petryszak R, Burdett T, Fiorelli B, Fonseca NA, Gonzalez-Porta M, Hastings E, Huber W, Jupp S, Keays M, Kryvych N, McMurry J, Marioni JC, Malone J, Megy K, Rustici G, Tang AY, Taubert J, Williams E, Mannion O, Parkinson HE, Brazma A (leden 2014). „Aktualizace Expression Atlas - databáze genové a transkripční exprese z experimentů funkční genomiky založených na čipech a sekvencích“. Výzkum nukleových kyselin. 42 (Problém s databází): D926-32. doi:10.1093 / nar / gkt1270. PMC 3964963. PMID 24304889.
- ^ Massrieh W, Derjuga A, Doualla-Bell F, Ku CY, Sanborn BM, Blank V (duben 2006). „Regulace transkripčního faktoru MAFF prozánětlivými cytokiny v myometriálních buňkách“. Biologie reprodukce. 74 (4): 699–705. doi:10.1095 / biolreprod.105.045450. PMID 16371591. S2CID 11823930.
- ^ A b Igarashi K, Kataoka K, Itoh K, Hayashi N, Nishizawa M, Yamamoto M (únor 1994). „Regulace transkripce dimerizací erytroidního faktoru NF-E2 p45 s malými proteiny Maf“. Příroda. 367 (6463): 568–72. Bibcode:1994Natur.367..568I. doi:10.1038 / 367568a0. PMID 8107826. S2CID 4339431.
- ^ Johnsen O, Murphy P, Prydz H, Kolsto AB (leden 1998). „Interakce faktoru CNC-bZIP TCF11 / LCR-F1 / Nrf1 s MafG: výběr vazebného místa a regulace transkripce“. Výzkum nukleových kyselin. 26 (2): 512–20. doi:10.1093 / nar / 26.2.512. PMC 147270. PMID 9421508.
- ^ A b Itoh K, Chiba T, Takahashi S, Ishii T, Igarashi K, Katoh Y, Oyake T, Hayashi N, Satoh K, Hatayama I, Yamamoto M, Nabeshima Y (červenec 1997). „Nrf2 / malý Maf heterodimer zprostředkovává indukci genů detoxikačního enzymu fáze II prostřednictvím prvků antioxidační odpovědi“. Komunikace pro biochemický a biofyzikální výzkum. 236 (2): 313–22. doi:10.1006 / bbrc.1997.6943. PMID 9240432.
- ^ Kobayashi A, Ito E, Toki T, Kogame K, Takahashi S, Igarashi K, Hayashi N, Yamamoto M (březen 1999). „Molekulární klonování a funkční charakterizace nového transkripčního faktoru rodiny Cap'n 'límců Nrf3“. The Journal of Biological Chemistry. 274 (10): 6443–52. doi:10.1074 / jbc.274.10.6443. PMID 10037736.
- ^ A b Oyake T, Itoh K, Motohashi H, Hayashi N, Hoshino H, Nishizawa M, Yamamoto M, Igarashi K (listopad 1996). „Bachovy proteiny patří do nové rodiny transkripčních faktorů BTB-základního leucinového zipu, které interagují s MafK a regulují transkripci přes NF-E2 místo“. Molekulární a buněčná biologie. 16 (11): 6083–95. doi:10.1128 / mcb.16.11.6083. PMC 231611. PMID 8887638.
- ^ Shavit JA, Motohashi H, Onodera K, Akasaka J, Yamamoto M, Engel JD (červenec 1998). „Zhoršená megakaryopoéza a poruchy chování u mutovaných myší s nulovou hodnotou mafG“. Geny a vývoj. 12 (14): 2164–74. doi:10.1101 / gad.12.14.2164. PMC 317009. PMID 9679061.
- ^ Shivdasani RA, Rosenblatt MF, Zucker-Franklin D, Jackson CW, Hunt P, Saris CJ, Orkin SH (červen 1995). „Transkripční faktor NF-E2 je vyžadován pro tvorbu krevních destiček nezávisle na působení trombopoetinu / MGDF při vývoji megakaryocytů.“ Buňka. 81 (5): 695–704. doi:10.1016/0092-8674(95)90531-6. PMID 7774011. S2CID 14195541.
- ^ A b Katsuoka F, Motohashi H, Ishii T, Aburatani H, Engel JD, Yamamoto M (září 2005). „Genetický důkaz, že malé proteiny maf jsou nezbytné pro aktivaci genů závislých na antioxidační odezvě na prvku“. Molekulární a buněčná biologie. 25 (18): 8044–51. doi:10.1128 / MCB.25.18.8044-8051.2005. PMC 1234339. PMID 16135796.
- ^ Kimura T, Ivell R, Rust W, Mizumoto Y, Ogita K, Kusui C, Matsumura Y, Azuma C, Murata Y (říjen 1999). „Molekulární klonování lidského homologu MafF, který se specificky váže na gen pro oxytocinový receptor v termínu myometrium“. Komunikace pro biochemický a biofyzikální výzkum. 264 (1): 86–92. doi:10.1006 / bbrc.1999.1487. PMID 10527846.
- ^ A b Onodera K, Shavit JA, Motohashi H, Katsuoka F, Akasaka JE, Engel JD, Yamamoto M (červenec 1999). "Charakterizace myšího genu mafF". The Journal of Biological Chemistry. 274 (30): 21162–9. doi:10.1074 / jbc.274.30.21162. PMID 10409670.
- ^ A b Shavit JA, Motohashi H, Onodera K, Akasaka J, Yamamoto M, Engel JD (červenec 1998). „Zhoršená megakaryopoéza a poruchy chování u mutovaných myší s nulovou hodnotou mafG“. Geny a vývoj. 12 (14): 2164–74. doi:10.1101 / gad.12.14.2164. PMC 317009. PMID 9679061.
- ^ A b Katsuoka F, Motohashi H, Tamagawa Y, Kure S, Igarashi K, Engel JD, Yamamoto M (únor 2003). „Malé mutanty sloučeniny Maf vykazují degeneraci neuronů centrálního nervového systému, aberantní transkripci a nesprávnou lokalizaci Bachova proteinu shodnou s myoklonem a abnormální vyděšenou odpovědí“. Molekulární a buněčná biologie. 23 (4): 1163–74. doi:10.1128 / mcb.23.4.1163-1174.2003. PMC 141134. PMID 12556477.
- ^ A b Agrawal SA, Anand D, Siddam AD, Kakrana A, Dash S, Scheiblin DA, Dang CA, Terrell AM, Waters SM, Singh A, Motohashi H, Yamamoto M, Lachke SA (červenec 2015). „Složené myší mutanty transkripčních faktorů bZIP Mafg a Mafk odhalují regulační síť nekrystalických genů spojených se šedým zákalem“. Genetika člověka. 134 (7): 717–35. doi:10.1007 / s00439-015-1554-5. PMC 4486474. PMID 25896808.
- ^ A b Onodera K, Shavit JA, Motohashi H, Yamamoto M, Engel JD (březen 2000). „Perinatální syntetická letalita a hematopoetické defekty u sloučenin mafG :: mafK mutovaných myší“. Časopis EMBO. 19 (6): 1335–45. doi:10.1093 / emboj / 19.6.1335. PMC 305674. PMID 10716933.
- ^ A b C Yamazaki H, Katsuoka F, Motohashi H, Engel JD, Yamamoto M (únor 2012). „Embryonální letalita a apoptóza jater plodu u myší bez všech tří malých proteinů Maf“. Molekulární a buněčná biologie. 32 (4): 808–16. doi:10.1128 / MCB.06543-11. PMC 3272985. PMID 22158967.
Další čtení
- Ye X, Li Y, Huang Q, Yu Y, Yuan H, Wang P, Wan D, Gu J, Huo K, Li YY, Lu H (květen 2006). "Nový lidský gen MIP funguje jako koaktivátor hMafF". Archivy biochemie a biofyziky. 449 (1–2): 87–93. doi:10.1016 / j.abb.2006.02.011. PMID 16549056.
- Massrieh W, Derjuga A, Doualla-Bell F, Ku CY, Sanborn BM, Blank V (duben 2006). „Regulace transkripčního faktoru MAFF prozánětlivými cytokiny v myometriálních buňkách“. Biologie reprodukce. 74 (4): 699–705. doi:10.1095 / biolreprod.105.045450. PMID 16371591. S2CID 11823930.
- Marini MG, Asunis I, Chan K, Chan JY, Kan YW, Porcu L, Cao A, Moi P (2003). „Klonování MafF screeningem rozpoznávacího místa pomocí tandemové repetice NFE2 HS2: analýza jeho role v regulaci genů globinu a GCSl“. Krevní buňky, molekuly a nemoci. 29 (2): 145–58. doi:10.1006 / bcmd.2002.0550. PMID 12490281.
- Moran JA, Dahl EL, Mulcahy RT (leden 2002). „Diferenciální indukce exprese mafF, mafG a mafK aktivátory elementu elektrofilní reakce“. The Biochemical Journal. 361 (Pt 2): 371–7. doi:10.1042/0264-6021:3610371. PMC 1222317. PMID 11772409.
- Kataoka K, Yoshitomo-Nakagawa K, Shioda S, Nishizawa M (leden 2001). „Sada proteinů Hox interaguje s onkoproteinem Maf, aby inhibovala jeho vazbu na DNA, transaktivaci a transformační aktivity“. The Journal of Biological Chemistry. 276 (1): 819–26. doi:10,1074 / jbc.M007643200. PMID 11036080.
- Kimura T, Ivell R, Rust W, Mizumoto Y, Ogita K, Kusui C, Matsumura Y, Azuma C, Murata Y (říjen 1999). „Molekulární klonování lidského homologu MafF, který se specificky váže na gen pro oxytocinový receptor v termínu myometrium“. Komunikace pro biochemický a biofyzikální výzkum. 264 (1): 86–92. doi:10.1006 / bbrc.1999.1487. PMID 10527846.
- Johnsen O, Skammelsrud N, Luna L, Nishizawa M, Prydz H, Kolstø AB (listopad 1996). „Malé proteiny Maf interagují s lidským transkripčním faktorem TCF11 / Nrf1 / LCR-F1“. Výzkum nukleových kyselin. 24 (21): 4289–97. doi:10.1093 / nar / 24.21.4289. PMC 146217. PMID 8932385.
- Igarashi K, Kataoka K, Itoh K, Hayashi N, Nishizawa M, Yamamoto M (únor 1994). „Regulace transkripce dimerizací erytroidního faktoru NF-E2 p45 s malými proteiny Maf“. Příroda. 367 (6463): 568–72. Bibcode:1994Natur.367..568I. doi:10.1038 / 367568a0. PMID 8107826. S2CID 4339431.
externí odkazy
- MAFF + protein, + člověk v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- FactorBook MafF