G protein - G protein
G proteiny, také známý jako guaninové proteiny vázající nukleotidy, plocha rodina proteinů které fungují jako molekulární spínače uvnitř buněk a podílejí se na přenosu signálů z různých podnětů mimo a buňka do jeho interiéru. Jejich aktivita je regulována faktory, které řídí jejich schopnost vázat se a hydrolyzovat guanosin trifosfát (GTP) do guanosin difosfát (HDP). Pokud jsou vázáni na GTP, jsou „zapnuti“ a pokud jsou vázáni na HDP, jsou „vypnuti“. G proteiny patří do větší skupiny enzymů zvaných GTPasy.
Existují dvě třídy G proteinů. První funkce jako monomerní malé GTPasy (malé G-proteiny), zatímco druhá funguje jako heterotrimerní G protein komplexy. Druhá třída komplexů je tvořena alfa (α), beta (β) a gama (γ) podjednotky.[1] Kromě toho mohou beta a gama podjednotky tvořit stabilní dimerní komplex označovaný jako komplex beta-gama.[2]
Heterotrimerické G proteiny umístěné v buňce jsou aktivovány Receptory spojené s G proteinem (GPCR), které pokrývají buněčnou membránu.[3] Signální molekuly se vážou na doménu GPCR umístěnou mimo buňku a intracelulární doména GPCR pak aktivuje konkrétní G protein. Ukázalo se také, že některé GPCR v aktivním stavu jsou „předem spojené“ s G proteiny.[4] G protein aktivuje kaskádu dalších signálních událostí, které nakonec vedou ke změně buněčné funkce. Receptor spojený s G proteinem a G proteiny spolupracující přenášejí signály z mnoha hormony, neurotransmitery a další signalizační faktory.[5] G proteiny regulují metabolické enzymy, iontové kanály, transportní proteiny, a další části buněčného strojního zařízení, ovládání transkripce, pohyblivost, kontraktilita, a vylučování, které zase regulují různé systémové funkce jako např embryonální vývoj, učení a paměť, a homeostáza.[6]
Dějiny
G proteiny byly objeveny, když Alfred G. Gilman a Martin Rodbell zkoumaná stimulace buněk pomocí adrenalin. Zjistili, že když se adrenalin váže na receptor, receptor nestimuluje enzymy (uvnitř buňky) přímo. Místo toho receptor stimuluje G protein, který pak stimuluje enzym. Příkladem je adenylátcykláza, který vyrábí druhý posel cyklický AMP.[7] Za tento objev zvítězili v roce 1994 Nobelova cena za fyziologii nebo medicínu.[8]
Nobelovy ceny byly uděleny za mnoho aspektů signalizace G proteiny a GPCR. Tyto zahrnují antagonisté receptoru, neurotransmitery neurotransmiter zpětné vychytávání, Receptory spojené s G proteinem, G proteiny, druhí poslové, enzymy, které spouštějí bílkoviny fosforylace v reakci na tábor a následné metabolické procesy, jako je glykogenolýza.
Mezi významné příklady patří (v chronologickém pořadí udělování):
- 1947 Nobelova cena za fyziologii nebo medicínu na Carl Cori, Gerty Cori a Bernardo Houssay za jejich objev jak glykogen je rozdělena na glukóza a resyntetizován v těle, pro použití jako zásobárna a zdroj energie. Glykogenolýza je stimulován mnoha hormony a neurotransmitery počítaje v to adrenalin.
- 1970 Nobelova cena za fyziologii nebo medicínu na Julius Axelrod, Bernard Katz a Ulf von Euler za jejich práci na vydání a zpětné vychytávání z neurotransmitery.
- 1971 Nobelova cena za fyziologii nebo medicínu na Hrabě Sutherland za objevení klíčové role adenylátcykláza, který produkuje druhého posla cyklický AMP.[7]
- 1988 Nobelova cena za fyziologii nebo medicínu na George H. Hitchings, Sir James Black a Gertrude Elion „za objevy důležitých zásad pro léčbu drogové závislosti“ zaměřených na GPCR.
- 1992 Nobelova cena za fyziologii nebo medicínu na Edwin G. Krebs a Edmond H. Fischer za popis toho, jak reverzibilní fosforylace funguje jako přepínač k aktivaci bílkoviny a regulovat různé buněčné procesy včetně glykogenolýza.[9]
- 1994 Nobelova cena za fyziologii nebo medicínu na Alfred G. Gilman a Martin Rodbell za objev „G-proteinů a role těchto proteinů při signální transdukci v buňkách“.[10]
- 2000 Nobelova cena za fyziologii nebo medicínu na Eric Kandel, Arvid Carlsson a Paul Greengard, pro výzkum na neurotransmitery jako dopamin, které jednají prostřednictvím GPCR.
- V roce 2004 Nobelova cena za fyziologii nebo medicínu na Richard Axel a Linda B. Buck za jejich práci spojenou s G proteinem čichové receptory.[11]
- V roce 2012 Nobelova cena za chemii na Brian Kobilka a Robert Lefkowitz za jejich práci na funkci GPCR.[12]
Funkce
G proteiny jsou důležité přenos signálu molekuly v buňkách. „Porucha signálních drah GPCR [G Protein-Coupled Receptor] se účastní mnoha onemocnění, jako je cukrovka, slepota, alergie, deprese, kardiovaskulární vady a některé formy rakovina. Odhaduje se, že asi 30% buněčných cílů moderních léků jsou GPCR. “[13] Lidský genom kóduje zhruba 800[14] Receptory spojené s G proteinem, které detekují fotony světla, hormony, růstové faktory, léky a další endogenní ligandy. Přibližně 150 GPCR nalezených v lidském genomu má stále neznámé funkce.
Zatímco G proteiny jsou aktivovány Receptory spojené s G proteinem, jsou deaktivovány RGS proteiny (pro „Regulátor signalizace G proteinu“). Receptory stimulují vazbu GTP (zapnutí G proteinu). Proteiny RGS stimulují hydrolýzu GTP (vytvářejí GDP, čímž vypínají G protein).
Rozmanitost
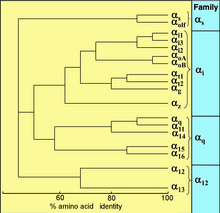
Všechny eukaryoty používají G proteiny pro signalizaci a vyvinuly si velkou rozmanitost G proteinů. Například lidé kódují 18 různých Gα bílkoviny, 5 Gβ bílkoviny a 12 G.y bílkoviny.[15]
Signalizace
G protein může odkazovat na dvě odlišné rodiny proteinů. Heterotrimerické G proteiny, někdy označované jako „velké“ G proteiny, jsou aktivovány pomocí Receptory spojené s G proteinem a jsou složeny z alfa (α), beta (β) a gama (γ) podjednotky. „Malé“ G proteiny (20-25 kDa) patří do Ras nadčeleď malé GTPasy. Tyto proteiny jsou homologní k alfa (α) podjednotce nalezené v heterotrimerech, ale jsou ve skutečnosti monomerní, skládající se pouze z jedné jednotky. Stejně jako jejich větší příbuzní však také vážou GTP a GDP a jsou zapojeni do signální transdukce.
Heterotrimerní
Různé typy heterotrimerních G proteinů sdílejí společný mechanismus. Jsou aktivovány v reakci na a konformační změna v GPCR, výměna GDP za GTP a disociace za účelem aktivace konkrétních dalších proteinů signální transdukce cesta. Specifické mechanismy se však u jednotlivých typů proteinů liší.
Společný mechanismus

Receptorem aktivované G proteiny jsou vázány na vnitřní povrch buněčná membrána. Skládají se z Gα a úzce související Gβγ podjednotky. Existuje mnoho tříd Gα podjednotky: Gsα (G stimulační), Giα (G inhibiční), GÓα (G ostatní), Gq / 11α a G.12/13α je několik příkladů. Chovají se odlišně při rozpoznávání efektorové molekuly, ale sdílejí podobný mechanismus aktivace.
Aktivace
Když ligand aktivuje Receptor spojený s G proteinem, indukuje konformační změnu v receptoru, která umožňuje, aby receptor fungoval jako guaninový nukleotidový výměnný faktor (GEF), která vyměňuje HDP za GTP - a tak zapíná GPCR. GTP (nebo GDP) je vázán na Gα podjednotka v tradičním pohledu na heterotrimerní aktivaci GPCR. Tato výměna spouští disociaci Gα podjednotka (která je vázána na GTP) z Gβγ dimer a receptor jako celek. Začínají se však přijímat modely, které naznačují molekulární přeskupení, reorganizaci a předkomplexování efektorových molekul.[4][17][18] Oba Gα-GTP a Gβγ pak může aktivovat různé signalizační kaskády (nebo druhý posel cesty) a efektorové proteiny, zatímco receptor je schopen aktivovat další G protein.[19]
Ukončení
Gα podjednotka nakonec hydrolyzovat připojený GTP k HDP ze své podstaty enzymatický činnost, která mu umožňuje znovu se spojit s G.βγ a zahájení nového cyklu. Skupina proteinů zvaná Regulátor signalizace G proteinu (RGS), jednají jako Proteiny aktivující GTPázu (GAP), jsou specifické pro Gα podjednotky. Tyto proteiny urychlují hydrolýzu GTP na GDP, čímž ukončují transdukovaný signál. V některých případech efektor sám může mít vlastní aktivitu GAP, což pak může pomoci deaktivovat cestu. To platí v případě fosfolipáza C -beta, která má v rámci své aktivity GAP C-terminál kraj. Toto je alternativní forma regulace pro Gα podjednotka. Takový Gα GAP nemají katalytické zbytky (specifické aminokyselinové sekvence) k aktivaci Gα protein. Pracují místo toho snížením požadované aktivační energie pro reakci.[20]
Specifické mechanismy
Gαs
Gαs aktivuje cesta závislá na cAMP stimulací produkce cyklický AMP (cAMP) z ATP. Toho je dosaženo přímou stimulací membránového enzymu adenylátcykláza. cAMP pak může fungovat jako druhý posel, který pokračuje v interakci a aktivaci protein kináza A (PKA). PKA může fosforylovat nesčetné následné cíle.
The cesta závislá na cAMP se používá jako signální transdukční cesta pro mnoho hormonů, včetně:
- ADH - Podporuje zadržování vody u ledviny (vytvořil magnocelulární neurosekreční buňky z zadní hypofýza )
- GHRH - Stimuluje syntézu a uvolňování GH (somatotropní buňky z přední hypofýza )
- GHIH - Inhibuje syntézu a uvolňování GH (somatotropní buňky přední hypofýzy)
- CRH - Stimuluje syntézu a uvolňování ACTH (přední hypofýza)
- ACTH - Stimuluje syntézu a uvolňování kortizol (zona fasciculata z kůra nadledvin v nadledvinách)
- TSH - Stimuluje syntézu a uvolňování většiny T4 (štítná žláza)
- LH - Stimuluje folikulární zrání a ovulaci u žen; nebo produkce testosteronu a spermatogeneze u mužů
- FSH - Stimuluje vývoj folikulů u žen; nebo spermatogeneze u mužů
- PTH - Zvyšuje se vápník v krvi úrovně. Toho je dosaženo prostřednictvím receptor parathormonu 1 (PTH1) v ledvinách a kostech nebo prostřednictvím receptor parathormonu 2 (PTH2) v centrálním nervovém systému a mozku, stejně jako v kostech a ledvinách.
- Kalcitonin - Snižuje hladinu vápníku v krvi (prostřednictvím kalcitoninový receptor ve střevech, kostech, ledvinách a mozku)
- Glukagon - Stimuluje glykogen rozpad v játrech
- hCG - Podporuje buněčnou diferenciaci a je potenciálně zapojen do apoptóza.[21]
- Adrenalin - propuštěn dřeň nadledvin během půstu, kdy je tělo pod metabolickým tlakem. Stimuluje glykogenolýza, kromě akcí glukagon.
Gαi
Gαi inhibuje produkci cAMP z ATP. např. somatostatin, prostaglandiny
Gαq / 11
Gαq / 11 stimuluje membránově vázané fosfolipáza C. beta, která poté štěpí PIP2 (vedlejší membrána fosfoinositol ) do dvou sekundových poslů, IP3 a diacylglycerol (DAG). Cesta závislá na fosfolipidech na inositolu se používá jako signální transdukční cesta pro mnoho hormonů, včetně:
- ADH (Vazopresin / AVP) - Indukuje syntézu a uvolnění glukokortikoidy (Zona fasciculata z kůra nadledvin v ledviny ); Indukuje vazokonstrikci (buňky V1 o Zadní hypofýza )
- TRH - indukuje syntézu a uvolňování TSH (Přední hypofýza )
- TSH - indukuje syntézu a uvolňování malého množství T4 (Štítná žláza )
- Angiotensin II - indukuje syntézu a uvolňování aldosteronu (zona glomerulosa kůry nadledvin v ledvinách)
- GnRH - indukuje syntézu a uvolňování FSH a LH (přední hypofýza)
Gα12 / 13
- Gα12 / 13 se účastní signalizace GTPázy rodiny Rho (viz Rodina Rho GTPas ). A to prostřednictvím nadrodiny RhoGEF zahrnující RhoGEF doména struktur proteinů). Ty se podílejí na řízení remodelace buněčného cytoskeletu, a tím na regulaci buněčné migrace.
Gβ
- The Gβγ komplexy někdy mají také aktivní funkce. Mezi příklady patří propojení a aktivace Vnitřně usměrňující draslíkové kanály spojené s G proteinem.
Malé GTPasy
Malé GTPázy, také známé jako malé G-proteiny, vážou GTP a GDP podobně a podílejí se na nich signální transdukce. Tyto proteiny jsou homologní s podjednotkou alfa (α), která se nachází v heterotrimerech, ale existují jako monomery. Jsou malé (20 kDa až 25 kDa) bílkoviny které se váží na guanosin trifosfát (GTP ). Tato rodina proteinů je homologní s Ras GTPasy a také se nazývá nadrodina Ras GTPasy.
Lipidace
Aby bylo možné přidružit se k vnitřnímu letáku[je zapotřebí objasnění ] plazmatické membrány je mnoho G proteinů a malých GTPáz lipidováno, to znamená kovalentně modifikováno lipidovými extenzemi. Mohou být myristoylovaný, palmitoylovaný nebo prenylovaný.
Reference
- ^ Hurowitz EH, Melnyk JM, Chen YJ, Kouros-Mehr H, Simon MI, Shizuya H (duben 2000). „Genomická charakterizace lidských heterotrimerních genů G proteinu alfa, beta a gama podjednotky“. Výzkum DNA. 7 (2): 111–20. doi:10.1093 / dnares / 7.2.111. PMID 10819326.
- ^ Clapham DE, Neer EJ (1997). "G protein beta gamma podjednotky". Roční přehled farmakologie a toxikologie. 37: 167–203. doi:10.1146 / annurev.pharmtox.37.1.167. PMID 9131251.
- ^ „Sedm transmembránových receptorů: Robert Lefkowitz“. 9. září 2012. Citováno 11. července 2016.
- ^ A b Qin K, Dong C, Wu G, Lambert NA (srpen 2011). „Předmontáž neaktivních stavů receptorů spárovaných s G (q) a heterotrimerů G (q)“. Přírodní chemická biologie. 7 (10): 740–7. doi:10.1038 / nchembio.642. PMC 3177959. PMID 21873996.
- ^ Reece J, C N (2002). Biologie. San Francisco: Benjamin Cummings. ISBN 0-8053-6624-5.
- ^ Neves SR, Ram PT, Iyengar R (květen 2002). "G proteinové dráhy". Věda. 296 (5573): 1636–9. Bibcode:2002Sci ... 296.1636N. doi:10.1126 / science.1071550. PMID 12040175.
- ^ A b Nobelova cena za fyziologii nebo medicínu 1994 Ilustrovaná přednáška.
- ^ Tisková zpráva: Nobelovo shromáždění na Karolinském institutu rozhodlo o udělení Nobelovy ceny za fyziologii nebo medicínu za rok 1994 společně Alfredu G. Gilmanovi a Martinovi Rodbellovi za objev „G-proteinů a role těchto proteinů v signální transdukci v buňkách“. 10. října 1994
- ^ „Tisková zpráva o Nobelově ceně za fyziologii nebo medicínu z roku 1992“. Nobel Assembly at Karolinska Institutet. Citováno 21. srpna 2013.
- ^ Tisková zpráva
- ^ „Tisková zpráva: Nobelova cena za fyziologii a medicínu z roku 2004“. Nobelprize.org. Citováno 8. listopadu 2012.
- ^ Královská švédská akademie věd (10. října 2012). „Nobelova cena za chemii 2012 Robert J. Lefkowitz, Brian K. Kobilka“. Citováno 10. října 2012.
- ^ Bosch DE, Siderovski DP (březen 2013). „Signalizace G proteinu u parazita Entamoeba histolytica“. Experimentální a molekulární medicína. 45 (1038): e15. doi:10.1038 / emm.2013.30. PMC 3641396. PMID 23519208.
- ^ Baltoumas FA, Theodoropoulou MC, Hamodrakas SJ (červen 2013). „Interakce α-podjednotek heterotrimerních G-proteinů s GPCR, efektory a RGS proteiny: kritický přehled a analýza interagujících povrchů, konformačních posunů, strukturální rozmanitosti a elektrostatických potenciálů“. Journal of Structural Biology. 182 (3): 209–18. doi:10.1016 / j.jsb.2013.03.004. PMID 23523730.
- ^ A b Syrovatkina V, Alegre KO, Dey R, Huang XY (září 2016). „Regulace, signalizace a fyziologické funkce G-proteinů“. Journal of Molecular Biology. 428 (19): 3850–68. doi:10.1016 / j.jmb.2016.08.002. PMC 5023507. PMID 27515397.
- ^ Stewart, Adele; Fisher, Rory A. (2015). Pokrok v molekulární biologii a translační vědě. 133. Elsevier. s. 1–11. doi:10.1016 / bs.pmbts.2015.03.002. ISBN 9780128029381. PMID 26123299.
- ^ Digby GJ, Lober RM, Sethi PR, Lambert NA (listopad 2006). „Některé heterotrimery G proteinu fyzicky disociují v živých buňkách“. Sborník Národní akademie věd Spojených států amerických. 103 (47): 17789–94. Bibcode:2006PNAS..10317789D. doi:10.1073 / pnas.0607116103. PMC 1693825. PMID 17095603.
- ^ Khafizov K, Lattanzi G, Carloni P (červen 2009). "Neaktivní a aktivní formy G proteinu vyšetřované simulačními metodami". Proteiny. 75 (4): 919–30. doi:10,1002 / prot. 22303. PMID 19089952.
- ^ Yuen JW, Poon LS, Chan AS, Yu FW, Lo RK, Wong YH (červen 2010). "Aktivace STAT3 specifickými podjednotkami Galpha a více dimery Gbetagamma". International Journal of Biochemistry & Cell Biology. 42 (6): 1052–9. doi:10.1016 / j.biocel.2010.03.017. PMID 20348012.
- ^ Sprang SR, Chen Z, Du X (2007). "Strukturální základ regulace efektoru a ukončení signálu v heterotrimerních proteinech Galpha". Pokroky v chemii proteinů. 74: 1–65. doi:10.1016 / S0065-3233 (07) 74001-9. ISBN 978-0-12-034288-4. PMID 17854654. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Cole LA (srpen 2010). „Biologické funkce hCG a molekul souvisejících s hCG“. Reprodukční biologie a endokrinologie. 8 (1): 102. doi:10.1186/1477-7827-8-102. PMC 2936313. PMID 20735820.
externí odkazy
 Média související s G proteiny na Wikimedia Commons
Média související s G proteiny na Wikimedia Commons- GTP-vázající proteiny v americké národní lékařské knihovně Lékařské předměty (Pletivo)