Transkripční faktor AP-1 - AP-1 transcription factor
| Proteiny AP-1 (Fos, ATF, JDP) | |
|---|---|
| Identifikátory | |
| Symbol | AP-1 |
| InterPro | IPR000837 |
| Transkripční faktor Jun | |
|---|---|
| Identifikátory | |
| Symbol | Leuzip_Jun |
| InterPro | IPR002112 |
Aktivátorový protein 1 (AP-1) je transkripční faktor který reguluje genová exprese v reakci na různé podněty, včetně cytokiny, růstové faktory, stres a bakteriální a virové infekce.[1] AP-1 řídí řadu buněčných procesů včetně diferenciace, proliferace, a apoptóza.[2] Struktura AP-1 je a heterodimer složený z proteinů patřících do c-Fos, c-červen, ATF a JDP rodiny.
Dějiny
AP-1 byl poprvé objeven jako transkripční faktor aktivovaný TPA, který se váže na a cis-regulační prvek člověka metalothionein IIa (hMTIIa ) promotér a SV40.[3] AP-1 vazebné místo byl identifikován jako 12-0-tetradekanoylforbol-13-acetát (TPA ) prvek odezvy (TRE) s konsensuální sekvence 5'-TGA G / C TCA-3 '.[4] AP-1 podjednotka Června byl identifikován jako román onkoprotein z virus ptačího sarkomu a protein p39 asociovaný s Fos byl identifikován jako transkript buněčného genu Jun. Fos byl nejprve izolován jako buněčný homolog dvou virových v-fos onkogenů, které oba indukují osteosarkom u myší a potkanů.[5] Od svého objevu bylo zjištěno, že AP-1 je spojován s mnoha regulačními a fyziologickými procesy a stále se zkoumají nové vztahy.
Struktura
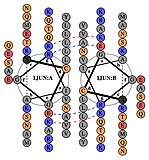
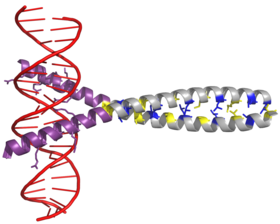
Transkripční faktor AP-1 je sestaven dimerizací charakteristiky doména bZIP (základní region leucinový zip ) v Fos a Června podjednotky. Typická doména bZIP se skládá z „leucinový zip “Region a„ základní region “. Leucinový zip je zodpovědný za dimerizaci Jun a Fos proteinové podjednotky. Tento strukturální motiv zvraty dva alfa helikální proteinové domény do "svinutá cívka “, Charakterizované periodicitou 3,5 zbytku na kolo a opakující se leuciny objevující se na každé sedmé pozici polypeptidový řetězec. V důsledku aminokyselina sekvence a periodicita šroubovic, leucin boční řetězy jsou uspořádány podél jedné strany α šroubovice a tvoří a hydrofobní povrch, který moduluje dimerizaci.[6] Hydrofobní zbytky doplňující leucin také tvoří charakteristické 3-4 opakování α šroubovic zapojených do interakcí „coiled-coil“ a pomáhají přispívat k hydrofobnímu obalu, který řídí dimerizaci. Dohromady tento hydrofobní povrch drží dvě podjednotky pohromadě.[7][8]
Základní oblast domény bZIP je těsně před leucinovým zipem a obsahuje pozitivně nabité zbytky. Tato oblast interaguje s Cílová místa DNA.[9] Kromě „leucinového zipu“ a „základní oblasti“, které jsou důležité pro dimerizaci a vazbu DNA, obsahuje protein c-jun tři krátké oblasti, které se skládají ze shluků negativně nabitých aminokyselin v jeho N-terminál polovina, která je důležitá pro transkripční aktivaci in vivo.[10]
Dimerizace probíhá mezi produkty c-jun a c-fos protoonkogeny, a je vyžadován pro vazbu DNA. Jun proteiny mohou tvořit jak homo, tak heterodimery, a proto jsou schopné vázat se na DNA samy. Fos proteiny se však navzájem nedimerují, a proto se mohou vázat pouze na DNA, když jsou navázány na Jun.[11][12] Heterodimer Jun-Fos je stabilnější a má vyšší vazebnou aktivitu k DNA než Jun homodimery.
Funkce
Bylo prokázáno, že transkripční faktor AP-1 má ruku v celé řadě buněčných procesů, včetně růst buněk, diferenciace, a apoptóza. Aktivita AP-1 je často regulována prostřednictvím posttranslační úpravy, Složení vazebného dimeru DNA a interakce s různými vazebnými partnery. Transkripční faktory AP-1 jsou také spojeny s řadou fyziologických funkcí, zejména při určování organismů životnost a tkáně regenerace. Níže jsou uvedeny některé z dalších důležitých funkcí a biologických rolí, v nichž bylo prokázáno, že jsou zapojeny transkripční faktory AP-1.
Růst, proliferace a stárnutí buněk
Ukázalo se, že transkripční faktor AP-1 hraje četné role v buněčném růstu a proliferaci. Zejména c-Fos a c-Jun se zdají být hlavními hráči v těchto procesech. Ukázalo se, že C-jun je nezbytný pro fibroblasty proliferace,[13] a bylo prokázáno, že hladiny obou podjednotek AP-1 jsou v průběhu exprimovány nad bazálními hladinami buněčné dělení.[14] Bylo také prokázáno, že C-fos zvyšuje expresi v reakci na zavedení růstové faktory v buňce, což dále podporuje jeho navrhované zapojení do buněčného cyklu. Růstové faktory TGF alfa, TGF beta, a IL2 Bylo prokázáno, že všechny stimulují c-Fos, a tím stimulují buněčnou proliferaci prostřednictvím aktivace AP-1.[10]
Buněčná stárnutí byl identifikován jako „dynamický a reverzibilní proces regulovaný (ne) aktivací předem stanoveného zesilovač krajina ovládaná průkopnický transkripční faktor AP-1 ", který" definuje organizační principy síť transkripčních faktorů který řídí transkripční program stárnoucích buněk ".[15][16]
Buněčná diferenciace
Transkripce AP-1 je hluboce zapojena do modulace genová exprese. Mohou vést ke změnám v expresi buněčných genů při zahájení syntézy DNA a tvorbě diferencovaných derivátů buněčná diferenciace.[10] Ukázalo se, že AP-1 se účastní buněčné diferenciace v několika systémech. Například vytvořením stabilních heterodimerů s c-Jun, oblast bZIP c-Fos zvyšuje vazbu c-Jun na cílové geny, jejichž aktivace se podílí na diferenciaci kuřecího embrya fibroblasty (CEF).[17]
Apoptóza
Transkripční faktor AP-1 je spojen se širokou škálou apoptóza související interakce. Aktivita AP-1 je indukována mnoha extracelulární matrix a genotoxické látky, navrhuje zapojení do programovaná buněčná smrt.[2] Mnoho z těchto podnětů aktivuje c-Jun N-terminální kinázy (JNK) vedoucí k fosforylace Jun proteinů a zvýšenou transkripční aktivitu genů závislých na AP-1.[2] Zvýšení hladin proteinů Jun a Fos a aktivita JNK byly hlášeny ve scénářích, kdy buňky procházejí apoptózou. Například inaktivované buňky c-Jun-ER vykazují normální morfologii, zatímco buňky aktivované c-Jun-ER se ukázaly být apoptotické.[18]
Regulace AP-1
Zvýšené úrovně AP-1 vedou ke zvýšení transaktivace exprese cílového genu. Regulace aktivity AP-1 je proto kritická pro funkci buněk a dochází k ní prostřednictvím specifických interakcí řízených složením dimeru, transkripční a posttranslační události a interakce s doplňkovými proteiny.[19]
Funkce AP-1 jsou silně závislé na konkrétních podjednotkách Fos a Jun přispívajících k dimerům AP-1.[10] Výsledek aktivace AP-1 závisí na komplexních kombinatorických vzorcích dimerů složek AP-1.[2] Komplex AP-1 se váže na palindromický motiv DNA (5’-TGA G / C TCA-3 ’), aby reguloval genovou expresi, ale specificita závisí na dimerním složení podjednotky bZIP.[2]
Fyziologická relevance
Ukázalo se, že transkripční faktor AP-1 se účastní fyziologie kůže, konkrétně tkáně regenerace. Proces metabolismu kůže je iniciován signály, které spouštějí diferenciaci nediferencovaných proliferativních buněk. Proto může být aktivita podjednotek AP-1 v reakci na extracelulární signály modifikována za podmínek, kdy je rovnováha keratinocyt šíření a diferenciace musí být rychle a časově změněny.[20]Bylo také prokázáno, že transkripční faktor AP-1 se podílí na růstu buněk rakoviny prsu prostřednictvím různých mechanismů, včetně regulace cyklin D1, E2F faktory a jejich cílové geny. c-Jun, který je jednou z dílčích jednotek AP-1, reguluje růst buněk rakoviny prsu. Aktivovaný c-Jun je převážně exprimován na invazivní frontě u rakoviny prsu a je spojen s proliferací prsních buněk.[21] Vzhledem k regulačním funkcím AP-1 v rakovinných buňkách je modulace AP-1 studována jako potenciální strategie prevence a léčby rakoviny.[22][23][24]
Regulome
Viz také
Reference
- ^ Hess J, Angel P, Schorpp-Kistner M (prosinec 2004). „Podjednotky AP-1: hádky a harmonie mezi sourozenci“. Journal of Cell Science. 117 (Pt 25): 5965–73. doi:10.1242 / jcs.01589. PMID 15564374.
- ^ A b C d E Ameyar M, Wisniewska M, Weitzman JB (srpen 2003). "Role AP-1 v apoptóze: případ pro a proti". Biochimie. 85 (8): 747–52. doi:10.1016 / j.biochi.2003.09.006. PMID 14585541.
- ^ Lee W, Haslinger A, Karin M, Tjian R (leden 1987). „Aktivace transkripce dvěma faktory, které vážou promotorové a enhancerové sekvence lidského genu pro metalothionein a SV40“. Příroda. 325 (6102): 368–72. Bibcode:1987 Natur.325..368L. doi:10.1038 / 325368a0. PMID 3027570. S2CID 4314423.
- ^ Angel P, Imagawa M, Chiu R, Stein B, Imbra RJ, Rahmsdorf HJ, Jonat C, Herrlich P, Karin M (červen 1987). „Geny indukovatelné forbolem obsahují běžný cis prvek rozpoznávaný trans-působícím faktorem modulovaným TPA“. Buňka. 49 (6): 729–39. doi:10.1016/0092-8674(87)90611-8. PMID 3034432. S2CID 23154076.
- ^ Wagner EF (duben 2001). „AP-1 - Úvodní poznámky“. Onkogen. 20 (19): 2334–5. doi:10.1038 / sj.onc.1204416. PMID 11402330.
- ^ Landschulz WH, Johnson PF, McKnight SL (červen 1988). „Leucinový zip: hypotetická struktura společná pro novou třídu proteinů vázajících DNA“. Věda. 240 (4860): 1759–64. Bibcode:1988Sci ... 240.1759L. doi:10.1126 / science.3289117. PMID 3289117.
- ^ O'Shea EK, Rutkowski R, Kim PS (leden 1989). "Důkaz, že leucinový zip je svinutá cívka". Věda. 243 (4890): 538–42. Bibcode:1989Sci ... 243..538O. doi:10.1126 / science.2911757. PMID 2911757.
- ^ O'Shea EK, Rutkowski R, Stafford WF, Kim PS (srpen 1989). "Přednostní tvorba heterodimerů izolovanými zipy leucínu od fos a jun". Věda. 245 (4918): 646–8. Bibcode:1989Sci ... 245..646O. doi:10.1126 / science.2503872. PMID 2503872.
- ^ Vogt PK, Bos TJ (1990). "jun: onkogen a transkripční faktor". Pokroky ve výzkumu rakoviny. 55: 1–35. doi:10.1016 / s0065-230x (08) 60466-2. ISBN 9780120066551. PMID 2166997.
- ^ A b C d Angel P, Karin M (prosinec 1991). "Role Jun, Fos a komplexu AP-1 v buněčné proliferaci a transformaci". Biochimica et Biophysica Acta (BBA) - Recenze na rakovinu. 1072 (2–3): 129–57. doi:10.1016 / 0304-419X (91) 90011-9. PMID 1751545.
- ^ Kouzarides T, Ziff E (prosinec 1988). "Role leucinového zipu v interakci fos-jun". Příroda. 336 (6200): 646–51. Bibcode:1988Natur.336..646K. doi:10.1038 / 336646a0. PMID 2974122. S2CID 4355663.
- ^ Nakabeppu Y, Ryder K, Nathans D (prosinec 1988). "DNA vazebné aktivity tří myších proteinů Jun: stimulace Fos". Buňka. 55 (5): 907–15. doi:10.1016/0092-8674(88)90146-8. PMID 3142691. S2CID 11057487.
- ^ Karin M, Liu Z, Zandi E (duben 1997). "Funkce a regulace AP-1". Aktuální názor na buněčnou biologii. 9 (2): 240–6. doi:10.1016 / S0955-0674 (97) 80068-3. PMID 9069263.
- ^ Yamashita J, McCauley LK (2006). „Aktivační transkripční komplex protein-1: základní a mnohostranné role v kostech“. Klinické hodnocení kostního a minerálního metabolismu. 4 (2): 107–122. doi:10,1385 / BMM: 4: 2: 107. S2CID 90318354.
- ^ Zumerle S, Alimonti A (2020). "Dovnitř a ven ze stárnutí". Nat Cell Biol. 22 (7): 753–754. doi:10.1038 / s41556-020-0540-x. PMID 32591745. S2CID 220071911.
- ^ Martínez-Zamudio R, Roux P, de Freitas J a kol. (2020). "AP-1 otiskuje reverzibilní transkripční program senescentních buněk". Nat Cell Biol. 22 (7): 842–855. doi:10.1038 / s41556-020-0529-5. PMID 32514071. S2CID 219543898.
- ^ Shaulian E, Karin M (květen 2002). "AP-1 jako regulátor života a smrti buněk". Přírodní buněčná biologie. 4 (5): E131–6. doi:10.1038 / ncb0502-e131. PMID 11988758. S2CID 34337538.
- ^ Bossy-Wetzel E, Bakiri L, Yaniv M (duben 1997). „Indukce apoptózy transkripčním faktorem c-červen“. Časopis EMBO. 16 (7): 1695–709. doi:10.1093 / emboj / 16.7.1695. PMC 1169773. PMID 9130714.
- ^ Veselý PW, Staber PB, Hoefler G, Kenner L (červenec 2009). "Translační regulační mechanismy proteinů AP-1". Mutační výzkum. 682 (1): 7–12. doi:10.1016 / j.mrrev.2009.01.001. PMID 19167516.
- ^ Angel P, Szabowski A, Schorpp-Kistner M (duben 2001). „Funkce a regulace podjednotek AP-1 ve fyziologii a patologii kůže“. Onkogen. 20 (19): 2413–23. doi:10.1038 / sj.onc.1204380. PMID 11402337.
- ^ Shen Q, Uray IP, Li Y, Krisko TI, Strecker TE, Kim HT, Brown PH (leden 2008). „Transkripční faktor AP-1 reguluje růst buněk rakoviny prsu prostřednictvím cyklinů a faktorů E2F“. Onkogen. 27 (3): 366–77. doi:10.1038 / sj.onc.1210643. PMID 17637753.
- ^ Eferl R, Wagner EF (listopad 2003). „AP-1: meč s dvojitým ostřím v tumorigenezi“. Recenze přírody. Rakovina. 3 (11): 859–68. doi:10.1038 / nrc1209. PMID 14668816. S2CID 35328722.
- ^ Tewari D, Nabavi SF, Nabavi SM, Sureda A, Farooqi AA, Atanasov AG, Vacca RA, Sethi G, Bishayee A (únor 2018). „Cílení na signální dráhu aktivačního proteinu 1 bioaktivními přírodními látkami: Možná terapeutická strategie pro prevenci a intervenci proti rakovině“. Farmakologický výzkum. 128: 366–375. doi:10.1016 / j.phrs.2017.09.014. PMID 28951297. S2CID 20160666.
- ^ Kamide D, Yamashita T, Araki K, Tomifuji M, Tanaka Y, Tanaka S, Shiozawa S, Shiotani A (květen 2016). „Selektivní aktivátor inhibitoru proteinu 1 T-5224 zabraňuje metastázám do lymfatických uzlin v modelu orální rakoviny“. Cancer Science. 107 (5): 666–73. doi:10.1111 / cas.12914. PMC 4970834. PMID 26918517.
- ^ Proffitt J, Crabtree G, Grove M, Daubersies P, Bailleul B, Wright E, Plumb M (leden 1995). „ATF / CREB-vazebné místo je nezbytné pro buněčně specifickou a indukovatelnou transkripci myšího genu pro MIP-1 beta cytokin“. Gen. 152 (2): 173–9. doi:10.1016 / 0378-1119 (94) 00701-S. PMID 7835696.
- ^ Rainio EM, Sandholm J, Koskinen PJ (únor 2002). „Špička: Transkripční aktivita NFATc1 je zvýšena kinázou Pim-1“. Journal of Immunology. 168 (4): 1524–7. doi:10,4049 / jimmunol.168.4.1524. PMID 11823475.
- ^ Sanyal S, Sandstrom DJ, Hoeffer CA, Ramaswami M (duben 2002). "AP-1 funguje před CREB k ovládání synaptické plasticity v Drosophile". Příroda. 416 (6883): 870–4. Bibcode:2002 Natur.416..870S. doi:10.1038 / 416870a. PMID 11976688. S2CID 4329320.
- ^ Hirayama J, Cardone L, Doi M, Sassone-Corsi P (červenec 2005). „Běžné dráhy v hodinách cirkadiánního a buněčného cyklu: aktivace Fos / AP-1 závislá na světle v kontrolách zebrafish CRY-1a a WEE-1“. Sborník Národní akademie věd Spojených států amerických. 102 (29): 10194–9. Bibcode:2005PNAS..10210194H. doi:10.1073 / pnas.0502610102. PMC 1177375. PMID 16000406.
- ^ Wai PY, Mi Z, Gao C, Guo H, Marroquin C, Kuo PC (červenec 2006). „Ets-1 a runx2 regulují transkripci metastatického genu, osteopontinu, v myších buňkách kolorektálního karcinomu“. The Journal of Biological Chemistry. 281 (28): 18973–82. doi:10,1074 / jbc.M511962200. PMID 16670084.
- ^ Collins-Hicok J, Lin L, Spiro C, Laybourn PJ, Tschumper R, Rapacz B, McMurray CT (květen 1994). „Indukce krysího prodynorfinového genu prostřednictvím receptorů spřažených s Gs může zahrnovat derepresi a aktivaci závislou na fosforylaci“. Molekulární a buněčná biologie. 14 (5): 2837–48. doi:10.1128 / MCB.14.5.2837. PMC 358652. PMID 8164647.
- ^ A b Behren A, Simon C, Schwab RM, Loetzsch E, Brodbeck S, Huber E, Stubenrauch F, Zenner HP, Iftner T (prosinec 2005). „Protein E2 papilomaviru indukuje expresi matrixové metaloproteinázy-9 prostřednictvím signální dráhy extracelulárního signálu regulovaného kinázového / aktivátorového proteinu-1“. Výzkum rakoviny. 65 (24): 11613–21. doi:10.1158 / 0008-5472.CAN-05-2672. PMID 16357172.
- ^ Hennigan RF, Stambrook PJ (srpen 2001). „Dominantní negativní c-jun inhibuje aktivaci komplexů cyklin D1 a cyklin E kinázy“. Molekulární biologie buňky. 12 (8): 2352–63. doi:10,1091 / mbc. 12. 8. 2352. PMC 58599. PMID 11514621.
- ^ Knöchel S, Schuler-Metz A, Knöchel W (listopad 2000). „c-Jun (AP-1) aktivuje transkripci BMP-4 v embryích Xenopus“. Mechanismy rozvoje. 98 (1–2): 29–36. doi:10.1016 / S0925-4773 (00) 00448-2. PMID 11044605. S2CID 18150052.
- ^ A b Kidd M, Hinoue T, Eick G, Lye KD, Mane SM, Wen Y, Modlin IM (prosinec 2004). „Globální analýza exprese buněk ECL v žaludeční sliznici Mastomys natalensis identifikuje změny v dráze AP-1 vyvolané transformací zprostředkovanou gastrinem“. Fyziologická genomika. 20 (1): 131–42. doi:10.1152 / physiolgenomics.00216.2003. PMID 15602048.
- ^ Heim JM, Singh S, Fülle HJ, Gerzer R (leden 1992). "Srovnání klonované ANF-citlivé guanylátcyklázy (GC-A) s partikulární guanylátcyklázou z kůry nadledvin". Naunyn-Schmiedebergův archiv farmakologie. 345 (1): 64–70. doi:10.1007 / BF00175471. PMID 1347156. S2CID 22605840.
- ^ Kuo YR, Wu WS, Wang FS (duben 2007). „Laser s pulzními barvami Flashlamp potlačil expresi a proliferaci TGF-beta1 v kultivovaných keloidních fibroblastech zprostředkovanou cestou MAPK“. Lasery v chirurgii a medicíně. 39 (4): 358–64. doi:10,1002 / lsm.20489. PMID 17457842.
- ^ Wu J, Bresnick EH (březen 2007). „Požadavek na synergismus glukokortikoidů a růstových faktorů pro aktivaci chromatinové domény Notch4“. Molekulární a buněčná biologie. 27 (6): 2411–22. doi:10.1128 / MCB.02152-06. PMC 1820485. PMID 17220278.
- ^ Martins G, Calame K (2008). "Regulace a funkce Blimp-1 v T a B lymfocytech". Výroční přehled imunologie. 26: 133–69. doi:10.1146 / annurev.immunol.26.021607.090241. PMID 18370921.
- ^ Lunec J, Holloway K, Cooke M, Evans M (2003). „Redoxní regulace opravy DNA“. Biofaktory. 17 (1–4): 315–24. doi:10,1002 / biof.5520170131. PMID 12897453. S2CID 30654477.
- ^ Manicassamy S, Gupta S, Huang Z, Sun Z (červen 2006). „Signály zprostředkované proteinkinázou C-theta zvyšují přežití CD4 + T buněk up-regulací Bcl-xL“. Journal of Immunology. 176 (11): 6709–16. doi:10,4049 / jimmunol.176.11.6709. PMID 16709830.
- ^ Wang N, Verna L, Hardy S, Forsayeth J, Zhu Y, Stemerman MB (září 1999). „Nadměrná exprese c-Jun a c-Fos zprostředkovaná adenovirem indukuje mezibuněčnou adhezní molekulu-1 a monocytový chemoatraktantový protein-1 v lidských endoteliálních buňkách“. Arterioskleróza, trombóza a vaskulární biologie. 19 (9): 2078–84. doi:10.1161 / 01.ATV.19.9.2078. PMID 10479648.
- ^ Fujita S, Ito T, Mizutani T, Minoguchi S, Yamamichi N, Sakurai K, Iba H (květen 2008). „Genová exprese miR-21 spouštěná AP-1 je udržována prostřednictvím mechanismu dvojité negativní zpětné vazby“. Journal of Molecular Biology. 378 (3): 492–504. doi:10.1016 / j.jmb.2008.03.015. PMID 18384814.
- ^ von Knethen A, Callsen D, Brüne B (únor 1999). „NF-kappaB a AP-1 aktivace oxidem dusnatým oslabila apoptotickou buněčnou smrt v makrofágech RAW 264.7“. Molekulární biologie buňky. 10 (2): 361–72. doi:10,1091 / mbc. 10.2.361. PMC 25174. PMID 9950682.
- ^ Phelan JP, Millson SH, Parker PJ, Piper PW, Cooke FT (říjen 2006). „Fab1p a AP-1 jsou vyžadovány pro obchodování s endogenně všudypřítomnými náklady do vakuola lumen v S. cerevisiae“. Journal of Cell Science. 119 (Pt 20): 4225–34. doi:10.1242 / jcs.03188. PMID 17003107.
- ^ Nolasco LH, Turner NA, Bernardo A, Tao Z, Cleary TG, Dong JF, Moake JL (prosinec 2005). „Shiga toxiny spojené s hemolyticko-uremickým syndromem podporují sekreci endoteliálních buněk a zhoršují ADAMTS13 štěpení neobvykle velkých multimerů von Willebrandova faktoru“. Krev. 106 (13): 4199–209. doi:10.1182 / krev-2005-05-2111. PMC 1895236. PMID 16131569.
- ^ Hommura F, Katabami M, Leaner VD, Donninger H, Sumter TF, Resar LM, Birrer MJ (květen 2004). „HMG-I / Y je cílový gen c-Jun / aktivátor protein-1 a je nezbytný pro růst nezávislý na ukotvení indukovaný c-Jun v buňkách Rat1a“. Výzkum molekulární rakoviny. 2 (5): 305–14. PMID 15192124.
- ^ Chang CJ, Chao JC (duben 2002). "Vliv lidského mléka a epidermálního růstového faktoru na růst lidských střevních buněk Caco-2". Journal of Pediatric Gastroenterology and Nutrition. 34 (4): 394–401. doi:10.1097/00005176-200204000-00015. PMID 11930096. S2CID 25446228.
- ^ Weber JR, Skene JH (červenec 1998). „Aktivita vysoce promiskuitního prvku AP-1 může být omezena na neurony tkáňově selektivním represivním prvkem“. The Journal of Neuroscience. 18 (14): 5264–74. doi:10.1523 / jneurosci.18-14-05264.1998. PMC 6793474. PMID 9651209.
- ^ Lee W, Mitchell P, Tjian R (červen 1987). "Purifikovaný transkripční faktor AP-1 interaguje s TPA-indukovatelnými zesilovacími prvky". Buňka. 49 (6): 741–52. doi:10.1016 / 0092-8674 (87) 90612-X. PMID 3034433. S2CID 37036603.
- ^ Cohen MP, Ziyadeh FN, Lautenslager GT, Cohen JA, Shearman CW (květen 1999). „Glykovaná albuminová stimulace aktivity PKC-beta souvisí se zvýšeným obsahem kolagenu IV v mezangiálních buňkách“. Americký žurnál fyziologie. 276 (5 Pt 2): F684–90. doi:10.1152 / ajprenal.1999.276.5.F684. PMID 10330050.
- ^ Stark CJ, Atreya CD (duben 2005). „Molekulární pokroky v buněčné biologii SARS-CoV a současné strategie prevence nemocí“. Virology Journal. 2: 35. doi:10.1186 / 1743-422X-2-35. PMC 1087510. PMID 15833113.
- ^ A b C Lane SJ, Adcock IM, Richards D, Hawrylowicz C, Barnes PJ, Lee TH (prosinec 1998). „Bronchiální astma rezistentní na kortikosteroidy je spojeno se zvýšenou expresí c-fos v monocytech a T lymfocytech“. The Journal of Clinical Investigation. 102 (12): 2156–64. doi:10,1172 / JCI2680. PMC 509170. PMID 9854051.
- ^ Steiner C, Peters WH, Gallagher EP, Magee P, Rowland I, Pool-Zobel BL (březen 2007). „Genistein chrání lidské epiteliální buňky mléčné žlázy před benzo (a) pyren-7,8-dihydrodiol-9,10-epoxidem a 4-hydroxy-2-nonenální genotoxicitou modulováním systému glutathion / glutathion S-transferáza“. Karcinogeneze. 28 (3): 738–48. doi:10.1093 / carcin / bgl180. PMID 17065199.
- ^ Ahn JD, Morishita R, Kaneda Y, Lee KU, Park JY, Jeon YJ, Song HS, Lee IK (červen 2001). „Návnada transkripčního faktoru pro aktivátorový protein-1 (AP-1) inhibuje expresi genu s vysokou koncentrací genu indukovaného inhibitorem aktivátoru plazminogenu aktivátoru typu 1 (PAI-1) typu glukózy a angiotensinu II v kultivovaných lidských buňkách hladkého svalstva cévního systému“. Diabetologie. 44 (6): 713–20. doi:10,1007 / s001250051680. PMID 11440364.
- ^ Kang S, Fisher GJ, Voorhees JJ (listopad 2001). "Photoaging: patogeneze, prevence a léčba". Kliniky v geriatrické medicíně. 17 (4): 643–59, v – vi. doi:10.1016 / S0749-0690 (05) 70091-4. PMID 11535421.
- ^ Navasa M, Gordon DA, Hariharan N, Jamil H, Shigenaga JK, Moser A, Fiers W, Pollock A, Grunfeld C, Feingold KR (červen 1998). „Regulace exprese mRNA proteinu mikrosomálního triglyceridu přenášejícího endotoxiny a cytokiny“. Journal of Lipid Research. 39 (6): 1220–30. PMID 9643353.
- ^ Suetsugu M, Takano A, Nagai A, Takeshita A, Hirose K, Matsumoto K a kol. (2007). „Kyselina retinová inhibuje sérem stimulovaný aktivátorový protein-1 přes potlačení c-fos a c-jun genové exprese během diferenciace myší osteoblastické buněčné linie buněk MC3T3-E1 indukované vitamíny "" (PDF). J. Meikai Dent. Med. 36 (1): 42–50.
- ^ Inagi R, Miyata T, Nangaku M, Ueyama H, Takeyama K, Kato S, Kurokawa K (listopad 2002). „Transkripční regulace genu převládajícího mesangium, megsin“. Časopis Americké nefrologické společnosti. 13 (11): 2715–22. doi:10.1097 / 01.ASN.0000033507.32175.FA. PMID 12397041.
- ^ Kim S, Yu SS, Lee IS, Ohno S, Yim J, Kim S, Kang HS (duben 1999). „Protein IE1 lidského cytomegaloviru aktivuje AP-1 prostřednictvím buněčné proteinové kinázy“. The Journal of General Virology. 80 (Pt 4) (4): 961–9. doi:10.1099/0022-1317-80-4-961. PMID 10211966.
- ^ Masuda A, Yoshikai Y, Kume H, Matsuguchi T (listopad 2004). „Interakce mezi proteiny GATA a aktivátorovým proteinem-1 podporuje transkripci IL-13 v žírných buňkách“. Journal of Immunology. 173 (9): 5564–73. doi:10,4049 / jimmunol. 173,9,5564. PMID 15494506.
- ^ Navas TA, Baldwin DT, Stewart TA (listopad 1999). „RIP2 je rafinem aktivovaná mitogenem aktivovaná protein kináza“. The Journal of Biological Chemistry. 274 (47): 33684–90. doi:10.1074 / jbc.274.47.33684. PMID 10559258.
- ^ Simantov R (srpen 1995). "Neurotransporters: regulace, zapojení do neurotoxicity a užitečnost antisense nukleových kyselin". Biochemická farmakologie. 50 (4): 435–42. doi:10.1016 / 0006-2952 (95) 00068-B. PMID 7646547.
- ^ Yang HS, Jansen AP, Nair R, Shibahara K, Verma AK, Cmarik JL, Colburn NH (únor 2001). „Nový supresor transformace, Pdcd4, inhibuje transaktivaci AP-1, ale nikoli transaktivaci NF-kappaB nebo ODC“. Onkogen. 20 (6): 669–76. doi:10.1038 / sj.onc.1204137. PMID 11314000.
- ^ Xie J, Pan H, Yoo S, Gao SJ (prosinec 2005). „Indukce herpesviru asociovaného s Kaposiho sarkomem AP-1 a interleukinu 6 během primární infekce zprostředkovaná více mitogenem aktivovanými proteinkinázovými cestami“. Journal of Virology. 79 (24): 15027–37. doi:10.1128 / JVI.79.24.15027-15037.2005. PMC 1316010. PMID 16306573.
- ^ Khan MA, Bouzari S, Ma C, Rosenberger CM, Bergstrom KS, Gibson DL, Steiner TS, Vallance BA (duben 2008). „Flagellin-dependentní a nezávislá zánětlivá reakce po infekci enteropatogenní Escherichia coli a Citrobacter rodentium“. Infekce a imunita. 76 (4): 1410–22. doi:10.1128 / IAI.01141-07. PMC 2292885. PMID 18227166.
- ^ Kida Y, Inoue H, Shimizu T, Kuwano K (leden 2007). "Serratia marcescens serralysin indukuje zánětlivé reakce prostřednictvím proteázou aktivovaného receptoru 2". Infekce a imunita. 75 (1): 164–74. doi:10.1128 / IAI.01239-06. PMC 1828393. PMID 17043106.
- ^ Gutzman JH, Rugowski DE, Schroeder MD, Watters JJ, Schuler LA (prosinec 2004). „Několik kinázových kaskád zprostředkovává signály prolaktinu k aktivaci proteinu-1 v buňkách rakoviny prsu“. Molekulární endokrinologie. 18 (12): 3064–75. doi:10.1210 / me.2004-0187. PMC 1634796. PMID 15319452.
- ^ Brinkmann MM, Glenn M, Rainbow L, Kieser A, Henke-Gendo C, Schulz TF (září 2003). "Aktivace mitogenem aktivované proteinové kinázy a NF-kappaB drah membránovým proteinem herpesviru K15 spojeným s Kaposiho sarkomem". Journal of Virology. 77 (17): 9346–58. doi:10.1128 / JVI.77.17.9346-9358.2003. PMC 187392. PMID 12915550.
- ^ Greenstein S, Ghias K, Krett NL, Rosen ST (červen 2002). „Mechanismy apoptózy zprostředkované glukokortikoidy u hematologických malignit“. Klinický výzkum rakoviny. 8 (6): 1681–94. PMID 12060604.
- ^ Yokoo T, Kitamura M (květen 1996). „Antioxidant PDTC indukuje expresi stromelysinu v mezangiálních buňkách cestou tyrosinkinázy-AP-1“. Americký žurnál fyziologie. 270 (5 Pt 2): F806–11. doi:10.1152 / ajprenal.1996.270.5.F806. PMID 8928842.
- ^ Chang CF, Cho S, Wang J (duben 2014). „(-) - Epikatechin chrání hemoragický mozek prostřednictvím synergických drah Nrf2“. Annals of Clinical and Translational Neurology. 1 (4): 258–271. doi:10,1002 / acn3,54. PMC 3984761. PMID 24741667.
- ^ Gibbings DJ, Ghetu AF, Dery R, Befus AD (únor 2008). „Faktor inhibice migrace makrofágů má motiv a funkci podobnou MHC třídy I“. Skandinávský žurnál imunologie. 67 (2): 121–32. doi:10.1111 / j.1365-3083.2007.02046.x. PMID 18201367.
- ^ Databáze Uniprot
- ^ Hseu YC, Vudhya Gowrisankar Y, Chen XZ, Yang YC, Yang HL (únor 2020). „Antiagingová aktivita ergothioneinu v lidských dermálních fibroblastech ozářených UVA prostřednictvím inhibice dráhy AP-1 a aktivace antioxidačních genů zprostředkovaných Nrf2“. Oxid Med Cell Longev. 2020 (2576823): 1–13. doi:10.1155/2020/2576823. PMC 7038158. PMID 32104530.