ELK1 - ELK1
ETS Like-1 protein Elk-1 je protein že u lidí je kódován ELK1.[5] Elk-1 funguje jako a transkripční aktivátor. Je klasifikován jako ternární komplexní faktor (TCF), podtřída Rodina ETS, který se vyznačuje společným proteinová doména který reguluje DNA vazba na cílové sekvence. Elk1 hraje důležitou roli v různých kontextech, včetně dlouhodobá paměť formace, drogová závislost, Alzheimerova choroba, Downův syndrom, rakovina prsu, a Deprese.
Struktura

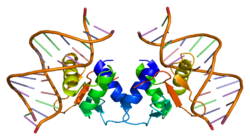
Jak je znázorněno na obrázku 1, protein Elk1 se skládá z několika domén. Lokalizovaný v N-koncové oblasti, doména A je nutná pro vazbu Elk1 na DNA. Tato oblast také obsahuje a signál jaderné lokalizace (NLS) a a jaderný exportní signál (NES), které jsou odpovědné za jaderný dovoz a vývoz. Doména B umožňuje Elk1 vázat se na dimer svého kofaktoru, faktor sérové odpovědi (SRF). Nachází se v sousedství domény B, doména R se účastní potlačení transkripční aktivity Elk1. Tato doména ukrývá zbytky lysinu, které pravděpodobně podstoupí SUMOylace, posttranslační událost, která posiluje inhibiční funkci R domény. Doména D hraje klíčovou roli vazby na aktivní Mitogenem aktivované proteinové kinázy (MAPK). Doména C, která se nachází v C-terminální oblasti Elk1, zahrnuje aminokyseliny které se ve skutečnosti staly fosforylovaný podle MAPK. V této oblasti jsou Serine 383 a 389 klíčovými místy, která musí být fosforylovaný aby došlo k transkripci zprostředkované Elk1. Nakonec je doména DEF specifická pro interakci aktivovaných kináza regulovaná extracelulárním signálem (Erk), typ MAPK, s Elk1.[6]
Výraz
Vzhledem k jeho roli jako transkripční faktor „Elk1 je exprimován v jádrech jiných než neuronálních buněk. Protein je přítomen v cytoplazmě i v jádře zralých neuronů.[6] V post-mitotických neuronech je varianta Elk1, sElk1, exprimována pouze v jádře, protože jí chybí NES místo přítomné v proteinu plné délky.[7] Navíc, zatímco Elk1 je široce exprimován, skutečné hladiny se mezi tkáněmi liší. Mozek krysy je například extrémně bohatý na Elk1, ale protein je exprimován výhradně v neuronech.[8]
Varianty spoje
Kromě proteinu plné délky může gen Elk1 poskytnout dvě zkrácené verze Elk1: ∆Elk1 a sElk1. Alternativní sestřih produkuje ∆Elk1. Tato varianta postrádá část domény vázající DNA, která umožňuje interakci se SRF.[9] Na druhé straně má sElk1 intaktní oblast, která se váže na SRF, ale chybí jí prvních 54 aminokyselin, které obsahují NES. Nalezeno pouze v neuronech, sElk1 je vytvořen pomocí interního výchozího místa překladu.[10] Jak ∆Elk1, tak sElk1, zkrácené verze proteinu plné délky, jsou schopné vázat se na DNA a indukovat různé buněčné signalizace. Ve skutečnosti sElk1 působí proti Elk1 v neuronální diferenciaci a regulaci nervový růstový faktor /ERK signalizace.[8]
Signalizace

Následný cíl Elk1 je prvek sérové odpovědi (SRE) z c-fos protoonkogen.[11][12] K výrobě c-fos, protein kódovaný Fos gen, Elk1 musí být fosforylovaný MAPK na jeho C-konci.[13][14] MAPK jsou konečné efektory drah signální transdukce, které začínají na plazmatická membrána.[15] Fosforylace výsledkem MAPK vede ke konformační změně Elk1.[16] Jak je vidět na obrázku 2, Raf kináza působí před MAPK a aktivuje je pomocí fosforylační a tím aktivují kinázy MEK nebo MAPK nebo ERK.[17][18][19][20] Samotný Raf je aktivován Ras, který je spojen s receptory růstových faktorů tyrosinkináza aktivita prostřednictvím Grb2 a Sos.[21] Grb2 a Sos mohou stimulovat Ras až po navázání růstové faktory na jejich odpovídající receptory. Aktivace Raf však nezávisí výlučně na Ras. Protein kináza C, kterou aktivuje estery forbolů, může plnit stejnou funkci jako Ras.[22] MEK kináza (MEKK) může také aktivovat MEK, které pak aktivují MAPK, takže Raf je občas zbytečný.[23] Různé signální transdukční cesty proto procházejí MEK a MAPK a vedou k aktivaci Elk1. Po stimulaci Elk1, SRF, který umožňuje Elk1 vázat se na c-fos promotér, musí být přijat. Vazba Elk1 na SRF nastává v důsledku interakce protein-protein mezi doménou B Elk1 a SRF a interakce protein-DNA prostřednictvím domény A.[6]
Výše uvedené proteiny jsou jako recepty na určitý signální výstup. Pokud některá z těchto složek chybí, například SRF, dojde k jinému výstupu. V tomto případě nedostatek SRF vede k aktivaci jiného genu Elk1.[16] Elk1 může tedy nezávisle interagovat s vazebným místem ETS, jako v případě lck protoonkogen na obrázku 2.[16] Rozteč a relativní orientace vazebného místa Elk1 na SRE je navíc poměrně flexibilní,[24] což naznačuje, že časné geny regulované SRE jiné než c-fos mohly být terčem Elk1. egr-1 je příkladem cíle Elk1, který závisí na SRE interakci.[16] Nakonec, fosforylace Elk1 může vést k produkci mnoha proteinů v závislosti na dalších zúčastněných faktorech a jejich specifických vzájemných interakcích.
Při studiu signálních drah mohou mutace dále zdůraznit důležitost každé komponenty použité k aktivaci cíle po směru toku. Například narušení C-terminální domény Elk1, že MAPK fosforyláty spouští inhibici c-fos aktivace.[16] Podobně vede k nefunkčnímu SRF, který normálně svazuje Elk1 na SRE Fos neprovádí se přepis.[21] Současně bez Elk1 nemůže SRF vyvolat c-fos transkripce po stimulaci MAPK.[16] Z těchto důvodů představuje Elk1 základní vazbu mezi signálními transdukčními cestami a zahájením genové transkripce.
Klinický význam
Dlouhodobá paměť
Vznik dlouhodobá paměť může záviset na Elk1. Inhibitory MEK blok Elk1 fosforylace a tím narušit získanou podmíněnou averzi chuti. Navíc, vyhýbání se učení, který zahrnuje učení předmětu, že konkrétní reakce vede k prevenci averzivního podnětu, souvisí s definitivním zvýšením aktivace Erk, Elk1 a c-fos v hipokampus. Tato oblast mozku se podílí na krátkodobém a dlouhodobém ukládání informací. Když je vazba Elk1 nebo SRF na DNA blokována v hipokampu potkana, pouze sekvestrace SRF interferuje s dlouhodobým prostorová paměť. I když interakce Elk1 s DNA nemusí být nezbytná pro formování paměti, je třeba ještě prozkoumat jeho specifickou roli. Je to proto, že aktivace Elk1 může vyvolat další molekulární události, které nevyžadují, aby se Elk1 vážil na DNA. Například Elk1 je zapojen do fosforylace z histony, zvýšená interakce se SRF a nábor bazálního transkripčního aparátu, které všechny nevyžadují přímou vazbu Elk1 na DNA.[6]
Drogová závislost
Aktivace Elk1 hraje ústřední roli v drogová závislost. Po podání myší kokain, silný a okamžitý hyperfosforylace Erk a Elk1 je pozorován ve striatu. Když jsou tyto myši podány Inhibitory MEK, Elk1 fosforylace není přítomen. Bez aktivního Elk1, c-fos produkce a vyvolaná kokainem preferované podmíněné místo jsou zobrazeny jako blokované. Navíc akutní ethanol požití vede k nadměrnému fosforylace Elk1 v amygdala. Bylo také zjištěno, že umlčování aktivity Elk1 snižuje buněčné reakce na abstinenční signály a přetrvávající léčbu opioidy, jedna z nejstarších známých drog na světě. Celkově tyto výsledky zdůrazňují, že Elk1 je důležitou součástí drogové závislosti.[6]
Patofyziologie
Nahromadění beta amyloid Ukázalo se, že (Ap) peptidy způsobují a / nebo spouští Alzheimerova choroba. Ap interferuje s BDNF -indukovaný fosforylace Elk1. Když je v této cestě bráněna aktivace Elk1, vede regulace genů řízená SRE ke zvýšené zranitelnosti neuronů. Elk1 také inhibuje transkripci presenilin 1 (PS1), který kóduje protein, který je nezbytný pro poslední krok sekvenčního proteolytického zpracování amyloidový prekurzorový protein (APLIKACE). APP vyrábí varianty Ap (polypeptid Ap42 / 43). Kromě toho je PS1 geneticky spojena s většinou případů rodinné Alzheimerovy choroby s časným nástupem. Tato data zdůrazňují zajímavou souvislost mezi Ap, Elk1 a PS1.[6]
Další podmínka spojená s Elk1 je Downův syndrom. Fetální a staré myši s tímto patofyziologickým stavem ukázaly pokles aktivity kalcineurin, hlavní fosfatáza pro Elk1. Tyto myši mají také změny aktivace ERK závislé na věku. Navíc vyjádření SUMO3, který potlačuje aktivitu Elk1, se zvyšuje u dospělých pacientů s Downovým syndromem. Proto Downův syndrom souvisí se změnami v dráhách ERK, kalcineurinu a SUMO, které všechny působí antagonisticky na aktivitu Elk1.[6]
Elk1 také interaguje s BRCA1 sestřihové varianty, jmenovitě BRCA1a a BRCA1b. Tato interakce zvyšuje potlačení růstu zprostředkovaného BRCA1 v rakovina prsu buňky. Elk1 může být downstream cílem BRCA1 v jeho dráze kontroly růstu. Nedávná literatura to ukazuje c-fos aktivita promotoru je inhibována, zatímco nadměrná exprese BRCA1a / 1b snižuje MEK indukovanou aktivaci SRE. Tyto výsledky ukazují, že jeden mechanismus růstu a potlačení nádoru proteiny BRCA1a / 1b působí prostřednictvím potlačení exprese Elk1 downstream cílových genů, jako je Fos.[25]
Deprese byl spojen s Elk1. Snížený Erk zprostředkovaný Elk1 fosforylace je pozorován v hipokampu a prefrontální kůra mozků posmrtných sebevražedných jedinců. Nevyvážená signalizace Erk koreluje s depresí a sebevražedným chováním. Budoucí výzkum odhalí přesnou roli Elk1 v patofyziologii deprese.[6]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000126767 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000009406 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Rao VN, Huebner K, Isobe M, Rushdi A, Croce CM, Reddy ES (1989). „elk, tkáňově specifické geny související s ets na chromozomech X a 14 poblíž hraničních bodů translokace“. Věda. 244 (4900): 66–70. doi:10.1126 / science.2539641. PMID 2539641.
- ^ A b C d E F G h Besnard A, Galan-Rodriguez B, Vanhoutte P, Caboche J (2011). „Elk-1 transkripční faktor s více aspekty v mozku“. Přední Neurosci. 5: 35. doi:10,3389 / fnins.2011.00035. PMC 3060702. PMID 21441990.
- ^ Sgambato V, Vanhoutte P, Pagès C, Rogard M, Hipskind R, Besson MJ, Caboche J (leden 1998). „In vivo exprese a regulace Elk-1, cíle extracelulárně regulované signální dráhy kinázy, v mozku dospělého potkana“. J. Neurosci. 18 (1): 214–26. doi:10.1523 / JNEUROSCI.18-01-00214.1998. PMC 6793414. PMID 9412502.
- ^ A b Janknecht R, Zinck R, Ernst WH, Nordheim A (duben 1994). "Funkční disekce transkripčního faktoru Elk-1". Onkogen. 9 (4): 1273–8. PMID 8134131.
- ^ Rao VN, Reddy ES (leden 1993). „Delta elk-1, varianta elk-1, selhává při interakci s faktorem odezvy na sérum a váže se na DNA s modulovanou specificitou.“ Cancer Res. 53 (2): 215–20. PMID 8417810.
- ^ Vanhoutte P, Nissen JL, Brugg B, Gaspera BD, Besson MJ, Hipskind RA, Caboche J (únor 2001). „Protichůdné role Elk-1 a jeho mozkové specifické izoformy, krátké Elk-1, v diferenciaci PC12 vyvolané nervovým růstovým faktorem“. J. Biol. Chem. 276 (7): 5189–96. doi:10,1074 / jbc.M006678200. PMID 11050086.
- ^ Hipskind RA, Rao VN, Mueller CG, Reddy ES, Nordheim A (1991). „Protein Elk-1 související s Ets je homologní s regulačním faktorem c-fos p62TCF“. Příroda. 354 (6354): 531–4. Bibcode:1991 Natur.354..531H. doi:10.1038 / 354531a0. PMID 1722028. S2CID 4305708.
- ^ Dalton S, Treisman R (únor 1992). "Charakterizace SAP-1, proteinu získaného faktorem odezvy séra na prvek odpovědi c-fos séra". Buňka. 68 (3): 597–612. doi:10.1016 / 0092-8674 (92) 90194-H. PMID 1339307. S2CID 26274460.
- ^ Gille H, Kortenjann M, Strahl T, Shaw PE (březen 1996). „Na fosforylaci závislá tvorba kvartérního komplexu na c-fos SRE“. Mol. Buňka. Biol. 16 (3): 1094–102. doi:10,1128 / mcb.16.3.1094. PMC 231092. PMID 8622654.
- ^ Zinck R, Hipskind RA, Pingoud V, Nordheim A (červen 1993). „transkripční aktivace a represe c-fos dočasně korelují se stavem fosforylace TCF“. EMBO J.. 12 (6): 2377–87. doi:10.1002 / j.1460-2075.1993.tb05892.x. PMC 413468. PMID 8389697.
- ^ Marx J (únor 1993). „Studie buněčné smrti poskytují stopy po rakovině“. Věda. 259 (5096): 760–1. Bibcode:1993Sci ... 259..760M. doi:10.1126 / science.8430327. PMID 8430327.
- ^ A b C d E F Janknecht R, Ernst WH, Pingoud V, Nordheim A (prosinec 1993). "Aktivace ternárního komplexního faktoru Elk-1 MAP kinázami". EMBO J.. 12 (13): 5097–104. doi:10.1002 / j.1460-2075.1993.tb06204.x. PMC 413771. PMID 8262053.
- ^ Dent P, Haser W, Haystead TA, Vincent LA, Roberts TM, Sturgill TW (září 1992). "Aktivace mitogenem aktivované proteinkinázy kinázy pomocí v-Raf v buňkách NIH 3T3 a in vitro". Věda. 257 (5075): 1404–7. Bibcode:1992Sci ... 257.1404D. doi:10.1126 / science.1326789. PMID 1326789.
- ^ Howe LR, Leevers SJ, Gómez N, Nakielny S, Cohen P, Marshall CJ (říjen 1992). "Aktivace dráhy MAP kinázy proteinovou kinázou raf". Buňka. 71 (2): 335–42. doi:10.1016 / 0092-8674 (92) 90361-F. PMID 1330321. S2CID 6640043.
- ^ Kyriakis JM, App H, Zhang XF, Banerjee P, Brautigan DL, Rapp UR, Avruch J (červenec 1992). "Raf-1 aktivuje MAP kinázu-kinázu". Příroda. 358 (6385): 417–21. Bibcode:1992 Natur.358..417K. doi:10.1038 / 358417a0. PMID 1322500. S2CID 4335307.
- ^ Wu J, Harrison JK, Dent P, Lynch KR, Weber MJ, Sturgill TW (srpen 1993). „Identifikace a charakterizace nové savčí mitogenem aktivované proteinkinázy kinázy, MKK2“. Mol. Buňka. Biol. 13 (8): 4539–48. doi:10,1128 / mcb.13.8.4539. PMC 360070. PMID 8393135.
- ^ A b Moodie SA, Willumsen BM, Weber MJ, Wolfman A (červen 1993). "Komplexy Ras.GTP s Raf-1 a mitogenem aktivovanou protein kinázou kinázy". Věda. 260 (5114): 1658–61. Bibcode:1993Sci ... 260,1658 mil. doi:10.1126 / science.8503013. PMID 8503013.
- ^ Kolch W, Heidecker G, Kochs G, Hummel R, Vahidi H, Mischak H, Finkenzeller G, Marmé D, Rapp UR (červenec 1993). „Protein kináza C alfa aktivuje RAF-1 přímou fosforylací“. Příroda. 364 (6434): 249–52. Bibcode:1993 Natur.364..249K. doi:10.1038 / 364249a0. PMID 8321321. S2CID 4368316.
- ^ Lange-Carter CA, Pleiman CM, Gardner AM, Blumer KJ, Johnson GL (duben 1993). "Divergence v regulační síti MAP kinázy definovaná MEK kinázou a Rafem". Věda. 260 (5106): 315–9. Bibcode:1993Sci ... 260..315L. doi:10.1126 / science.8385802. PMID 8385802. S2CID 40484420.
- ^ Treisman R, Marais R, Wynne J (prosinec 1992). „Prostorová flexibilita v ternárních komplexech mezi SRF a jeho doplňkovými proteiny“. EMBO J.. 11 (12): 4631–40. doi:10.1002 / j.1460-2075.1992.tb05565.x. PMC 557039. PMID 1425594.
- ^ Chai Y, Chipitsyna G, Cui J, Liao B, Liu S, Aysola K, Yezdani M, Reddy ES, Rao VN (březen 2001). „Regulátor onkogenu c-Fos Elk-1 interaguje s variantami sestřihu BRCA1 BRCA1a / 1b a zvyšuje BRCA1a / 1b zprostředkovanou potlačení růstu v buňkách rakoviny prsu“. Onkogen. 20 (11): 1357–67. doi:10.1038 / sj.onc.1204256. PMID 11313879.