Lešení protein - Scaffold protein
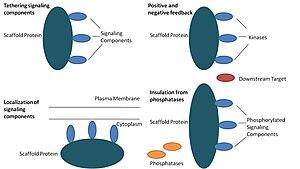
V biologii proteiny lešení jsou rozhodujícími regulátory mnoha klíčových signální dráhy. Ačkoli lešení nejsou striktně definována ve funkci, je známo, že interagují a / nebo se vážou s více členy signální cesty a spojují je do komplexy. V takových drahách regulují přenos signálu a pomáhají lokalizovat komponenty dráhy (organizované v komplexech) do konkrétních oblastí buňky, jako je plazmatická membrána, cytoplazma, jádro, Golgi, endozomy a mitochondrie.
Dějiny
První objevený signální protein lešení byl Ste5 bílkoviny z kvasnic Saccharomyces cerevisiae. Ukázalo se, že tři odlišné domény Ste5 se sdružují s proteinové kinázy Ste11, Ste7, a Fus3 za vzniku multikinázového komplexu.[2]
Funkce
Proteiny lešení působí nejméně čtyřmi způsoby: upoutáním signálních komponent, lokalizací těchto komponent do specifických oblastí buňky, regulací přenosu signálu koordinací pozitivní a negativní zpětná vazba signály a izolaci správných signálních proteinů od konkurenčních proteinů.[1]
Tethering signalizační komponenty
Tato konkrétní funkce je považována za nejzákladnější funkci lešení. Lešení sestavují signalizační komponenty a kaskáda do komplexů. Tato sestava může být schopna zvýšit specifičnost signalizace zabráněním zbytečných interakcí mezi signálními proteiny a zvýšit účinnost signalizace zvýšením blízkosti a účinné koncentrace složek v komplexu lešení. Běžným příkladem toho, jak lešení zvyšují specificitu, je lešení, které váže proteinovou kinázu a její substrát, čímž zajišťuje specifickou fosforylaci kinázy. Některé signální proteiny navíc vyžadují aktivaci více interakcí a uvázání lešení může být schopné tyto interakce převést na jednu interakci, která vede k několika modifikacím.[3][4] Lešení mohou být také katalytická, protože může dojít k interakci se signálními proteiny alosterický změny těchto signalizačních komponent.[5] Takové změny mohou být schopné zesílit nebo inhibovat aktivaci těchto signálních proteinů. Příkladem je lešení Ste5 v mitogenem aktivované proteinkináze (MAPK ) cesta. Ste5 bylo navrženo k přímé signalizaci páření přes Fus3 MAPK katalytickým odblokováním této konkrétní kinázy pro aktivaci jejím MAPKK Ste7.[6]
Lokalizace signalizačních složek v buňce
Lešení lokalizují signalizační reakci na konkrétní oblast v buňce, což je proces, který by mohl být důležitý pro místní produkci signalizačních meziproduktů. Konkrétním příkladem tohoto procesu je skelet, kotvící proteiny A-kinázy (AKAP), které se zaměřují na cyklickou AMP-dependentní proteinovou kinázu (PKA ) na různá místa v buňce.[7] Tato lokalizace je schopna lokálně regulovat PKA a vede k místní fosforylaci PKA jejích substrátů.
Koordinace pozitivní a negativní zpětné vazby
Mnoho hypotéz o tom, jak lešení koordinují pozitivní a negativní zpětnou vazbu, pochází z inženýrských lešení a matematického modelování. V signalizačních kaskádách se třemi kinázami se lešení váží na všechny tři kinázy, zvyšují specificitu kinázy a omezují amplifikaci signálu omezením kinázové fosforylace pouze na jeden cílový cíl.[3][8][9] Tyto schopnosti mohou souviset se stabilitou interakce mezi lešením a kinázami, bazálními fosfatáza aktivita v buňce, umístění lešení a úrovně exprese signalizačních složek.[3][8]
Izolace správných signálních proteinů z inaktivace
Signální dráhy jsou často inaktivovány enzymy, které mění stav aktivace a / nebo indukují degradaci signalizačních složek. Pro ochranu aktivovaných signálních molekul před inaktivací a / nebo degradací byla navržena lešení. Matematické modelování ukázalo, že kinázy v kaskádě bez lešení mají vyšší pravděpodobnost, že budou defosforylovány fosfatázami, než budou vůbec schopny fosforylovat cílové body.[8] Kromě toho se ukázalo, že lešení izolují kinázy od substrátově a ATP-kompetitivních inhibitorů.[10]
Shrnutí bílkovin lešení
| Lešení proteiny | Cesta | Potenciální funkce | Popis |
|---|---|---|---|
| KSR | MAPK | Sestavení a lokalizace cesty RAS-ERK | Jednou z nejlépe studovaných signálních drah v biologii je RAS-ERK cesta, ve které RAS G-protein aktivuje MAPKKK RAF, který aktivuje MAPKK MEK1 (MAPK / ERK kináza 1), která poté aktivuje MAPK ERK. Bylo identifikováno několik proteinů lešení, které se účastní této dráhy a dalších podobných drah MAPK. Jedním z takových proteinů lešení je KSR, což je nejpravděpodobnější ekvivalent dobře studovaného kvasinkového proteinu MAPK lešení Ste5.[11] Je to pozitivní regulátor dráhy a váže mnoho proteinů v dráze, včetně všech tří kináz v kaskádě.[6] Ukázalo se, že KSR je lokalizován na plazmatickou membránu během aktivace buněk, čímž hraje roli při sestavování složek dráhy ERK a při lokalizaci aktivované ERK na plazmatickou membránu.[12] |
| MEKK1 | MAPK | Sestavení a lokalizace signalosomu receptoru smrti | Mezi další proteiny lešení patří lymfom B-buněk 10 (BCL-10 ) a MEK kináza 1 (MEKK1 ), které mají role v JUN N-terminální kináze (JNK ) cesta. |
| BCL-10 | MAPK | Shromáždění a specifičnost JNK | |
| AKAP | PKA Cesty | Koordinace fosforylace PKA na navazující cíle | Tato rodina proteinů souvisí pouze strukturálně ve své schopnosti vázat regulační podjednotku PKA, ale jinak může vázat velmi rozmanitou sadu enzymů a substrátů |
| AHNAK-1 | Vápníková signalizace | Montáž a lokalizace vápníkových kanálů | Vápníková signalizace je nezbytná pro správnou funkci imunitních buněk. Nedávné studie ukázaly, že protein lešení, AHNAK1, je důležitý pro efektivní signalizaci vápníku a NFAT aktivace v T buňky díky své schopnosti správně lokalizovat vápníkové kanály na plazmatické membráně [14]. V neimunních buňkách se také ukázalo, že AHNAK1 váže vápníkové kanály s fosfolipázou Cγ (PLC-γ ) a PKC.[1] Proteiny vázající vápník často potlačují většinu vstupujícího vápníku, takže propojení těchto efektorů vápníku může být zvláště důležité, když jsou signály indukovány slabým přílivem vápníku. |
| HOMER | Vápníková signalizace | Inhibice aktivace NFAT | Dalším příkladem proteinu lešení, který moduluje vápníkovou signalizaci, jsou proteiny rodiny HOMER. Bylo prokázáno, že proteiny HOMER soutěží kalcineurin vázat se na N konec NFAT v aktivovaných T buňkách.[13] Prostřednictvím této soutěže jsou proteiny HOMER schopny snížit aktivaci NFAT, což také snižuje produkci IL-2 cytokin.[13] Naproti tomu se ukázalo, že proteiny HOMER také pozitivně regulují vápníkovou signalizaci v neuronech spojením glutamátový receptor s trifosfátovými receptory v endoplazmatickém retikulu.[14] |
| Pellino | Vrozená imunitní signalizace | Sestavení signalosomu TLR | Existují důkazy, že proteiny Pellino fungují jako proteiny lešení v důležité vrozené imunitní signální cestě, Toll-like receptoru (TLR ) cesta. Mnoho funkcí Pellino je spekulace; proteiny Pellino se však mohou spojit s IRAK1, TRAF6 a TAK1 po aktivaci IL-1R, což naznačuje, že mohou sestavit a lokalizovat složky TLR dráhy poblíž svého receptoru.[15][16] |
| NLRP | Vrozená imunitní signalizace | Shromáždění inflammasomu | Rodina NLR je vysoce konzervovaná a velká rodina receptorů zapojených do vrozené imunity. Rodina receptorů NLRP (rodina NLR, obsahující pyrinovou doménu) funguje jako lešení sestavením inflammasomu, komplexu, který vede k sekreci prozánětlivých cytokinů, jako jsou IL-18 a IL-1β.[17] |
| DLG1 | Receptor T-buněk signalizace | Sestavení a lokalizace signálních molekul TCR, aktivace p38 | DLG1 je vysoce konzervovaný v imunitních buňkách a je důležitý pro aktivaci T-buněk na periferii. Je získáván do imunologické synapse a spojuje ζ-řetězec receptoru T-buněk (TCR ) na CBL, WASP, p38, LCK, VAV1 a ZAP70.[18][19][20][21] Tato data naznačují, že DLG1 hraje roli při propojení signalizačního aparátu TCR s regulátory cytoskeletu a také naznačuje roli při alternativní aktivaci dráhy p38. Není však jasné, zda DLG1 pozitivně nebo negativně reguluje aktivaci T-buněk. |
| Spinofilin | Dendritická buňka signalizace | Sestavení DC imunologicko-synaptických proteinů | Spinofilin se podílí na dendritický funkce buněk konkrétně při tvorbě imunologických synapsí. Spinofilin je rekrutován do synapsí po kontaktu dendritických buněk s T buňkami. Tento nábor se zdá být důležitý, protože bez spinofilinu dendritické buňky nemohou aktivovat T buňky in vitro nebo in vivo.[22] Jak spinofilin v tomto případě usnadňuje prezentaci antigenu, stále není známo, i když je možné, že spinofilin reguluje trvání buněčného kontaktu v synapse nebo reguluje recyklaci kostimulačních molekul v buňce, jako jsou molekuly MHC.[1] |
| Rostlinný regulační protein FLU[23] | Koordinace negativní zpětné vazby během protochlorofylid biosyntéza. | Sestavení a lokalizace dráhy, která mění syntézu vysoce toxických látek protochlorofylid, předchůdce chlorofyl. | Syntéza protochlorofylidu musí být přísně regulována, protože jeho přeměna na chlorofyl vyžaduje světlo. FLU regulační protein se nachází v thylakoid membrána a obsahuje pouze několik míst interakce protein-protein bez katalytické aktivity. Mutanti bez tohoto proteinu ve tmě hromadili protochlorofylid. Interakční partneři nejsou známí. Protein prošel během evoluce zjednodušením. |
Huntingtin protein
Huntingtin protein se lokalizuje společně s bankomat opravit protein na stránkách Poškození DNA.[24] Huntingtin je protein lešení v komplexu reakce na poškození oxidační DNA ATM.[24] Huntingtonova choroba pacienti s aberantním proteinem huntingtin mají nedostatečnou opravu oxidační poškození DNA. Zdá se, že oxidační poškození DNA je základem Huntingtonovy choroby patogeneze.[25] Huntingtonova choroba je pravděpodobně způsobena dysfunkcí mutantního proteinu lešení huntingtin Oprava DNA což vede ke zvýšenému poškození oxidační DNA v metabolicky aktivních buňkách.[24]
Jiné použití termínu Scaffold Protein
V některých dalších případech v biologii (ne nutně o buněčné signalizaci) se termín „Scaffold protein“ používá v širším smyslu, kde protein drží několik věcí pohromadě pro jakýkoli účel.
- Při skládání chromozomů
- Chromozomové lešení hraje důležitou roli při udržování kompaktinu chromatinu chromozóm. Chromozomové lešení je vyrobeno z bílkovin včetně kondenzin, topoizomeráza IIα a člen rodiny kinesinů 4 (KIF4)[26] Proteiny, které tvoří základní složku chromozomu, se také nazývají protein lešení.
- Při enzymatické reakci
- Velké multifunkční enzymy, které provádějí řadu reakčních řetězců společnou cestou, někdy nazývaných proteiny lešení.[27] jako je pyruvátdehydrogenáza.
- Při tvorbě tvaru molekuly
- Enzym nebo strukturní protein, který drží několik molekul pohromadě, aby je udržel ve správném prostorovém uspořádání, jako jsou proteiny shluku železné síry.[28][29]
- Strukturální lešení
- v cytoskelet a ECM, molekuly poskytují mechanické lešení. Například kolagen typu 4[30]
Reference
- ^ A b C d Shaw, Andrey S .; Filbert, Erin L. (leden 2009). "Proteiny lešení a signalizace imunitních buněk". Recenze přírody Imunologie. 9 (1): 47–56. doi:10.1038 / nri2473. PMID 19104498. S2CID 13443447.
- ^ Choi, Kang-Yell; Satterberg, Brett; Lyons, David M .; Elion, Elaine A. (srpen 1994). "Ste5 spojuje více proteinových kináz v MAP kinázové kaskádě potřebné pro spojení S. cerevisiae". Buňka. 78 (3): 499–512. doi:10.1016/0092-8674(94)90427-8. PMID 8062390. S2CID 20541545.
- ^ A b C Levchenko, Andre; Bruck, Jehoshua; Sternberg, Paul W. (23. května 2000). „Proteiny lešení mohou bifázicky ovlivňovat hladiny signalizace proteinkinázy aktivované mitogenem a snižovat její prahové vlastnosti“. Sborník Národní akademie věd. 97 (11): 5818–5823. Bibcode:2000PNAS ... 97.5818L. doi:10.1073 / pnas.97.11.5818. PMC 18517. PMID 10823939.
- ^ Ferrell, James E. (3. října 2000). „Co vlastně dělají lešení proteiny?“. Vědecká signalizace. 2000 (52): pe1. doi:10.1126 / stke.522000pe1. S2CID 219192522.
- ^ Burack, W Richard; Shaw, Andrey S (duben 2000). "Transdukce signálu: visí na lešení". Současný názor na buněčnou biologii. 12 (2): 211–216. doi:10.1016 / S0955-0674 (99) 00078-2. PMID 10712921.
- ^ A b Dobře, Matthew; Tang, Grace; Singleton, Julie; Reményi, Attila; Lim, Wendell A. (březen 2009). „Lešení Ste5 řídí signalizaci páření katalytickým odblokováním kinázy Fus3 MAP pro aktivaci“. Buňka. 136 (6): 1085–1097. doi:10.1016 / j.cell.2009.01.049. PMC 2777755. PMID 19303851.
- ^ Wong, Wei; Scott, John D. (prosinec 2004). "Signální komplexy AKAP: kontaktní místa v prostoru a čase". Nature Reviews Molecular Cell Biology. 5 (12): 959–970. doi:10.1038 / nrm1527. PMID 15573134. S2CID 15268680.
- ^ A b C Locasale, Jason W .; Shaw, Andrey S .; Chakraborty, Arup K. (14. srpna 2007). „Proteiny lešení propůjčují kaskádám proteinových kináz různé regulační vlastnosti“. Sborník Národní akademie věd. 104 (33): 13307–13312. Bibcode:2007PNAS..10413307L. doi:10.1073 / pnas.0706311104. PMID 17686969. S2CID 8907943.
- ^ Uhlik, Mark T; Abell, Amy N; Cuevas, Bruce D; Nakamura, Kazuhiro; Johnson, Gary L (1. prosince 2004). "Schémata zapojení regulace MAPK podle MEKK1, 2 a 3". Biochemie a buněčná biologie. 82 (6): 658–663. doi:10.1139 / o04-114. PMID 15674433.
- ^ Greenwald, Eric C .; Redden, John M .; Dodge-Kafka, Kimberly L .; Saucerman, Jeffrey J. (24. ledna 2014). „Přepínání stavu lešení zesiluje, zrychluje a izoluje signalizaci proteinkinázy C“. Journal of Biological Chemistry. 289 (4): 2353–2360. doi:10.1074 / jbc.M113.497941. PMC 3900978. PMID 24302730.
- ^ Clapéron, A .; Therrien, M. (květen 2007). „KSR a CNK: dvě lešení regulující aktivaci RAF zprostředkovanou RAS“. Onkogen. 26 (22): 3143–3158. doi:10.1038 / sj.onc.1210408. PMID 17496912. S2CID 31061333.
- ^ Müller, Jürgen; Ory, Stéphane; Copeland, Terry; Piwnica-Worms, Helen; Morrison, Deborah K. (listopad 2001). "C-TAK1 reguluje Ras signalizaci fosforylací lešení MAPK, KSR1". Molekulární buňka. 8 (5): 983–993. doi:10.1016 / S1097-2765 (01) 00383-5. PMID 11741534.
- ^ A b Huang, Guo N .; Huso, David L .; Bouyain, Samuel; Tu, Jianchen; McCorkell, Kelly A .; May, Michael J .; Zhu, Yuwen; Lutz, Michael; Collins, Samuel; Dehoff, Marlin; Kang, Shin; Whartenby, Katharine; Powell, Jonathan; Leahy, Daniel; Worley, Paul F. (25. ledna 2008). „Vazba NFAT a regulace aktivace T buněk cytoplazmatickými lešeními Homerovy proteiny“. Věda. 319 (5862): 476–481. Bibcode:2008Sci ... 319..476H. doi:10.1126 / science.1151227. PMC 3602998. PMID 18218901.
- ^ Xiao, Bo; Cheng Tu, Jian; Worley, Paul F (červen 2000). "Homer: souvislost mezi nervovou aktivitou a funkcí glutamátového receptoru". Aktuální názor v neurobiologii. 10 (3): 370–374. doi:10.1016 / S0959-4388 (00) 00087-8. PMID 10851183. S2CID 8699597.
- ^ Jiang, Zhengfan; Johnson, H. Jan; Nie, Huiqing; Qin, Jinzhong; Bird, Timothy A .; Li, Xiaoxia (28. března 2003). „Pellino 1 je vyžadováno pro signalizaci zprostředkovanou interleukinem-1 (IL-1) prostřednictvím jeho interakce s komplexem kinázy 4 (IRAK4) -IRAK-IRAK-faktor nekrotizující s faktorem 6 (TRAF6) spojeným s receptorem IL-1“. Journal of Biological Chemistry. 278 (13): 10952–10956. doi:10,1074 / jbc.M212112200. PMID 12496252. S2CID 10165785.
- ^ Yu, Kang-Yeol; Kwon, Hyung-Joo; Norman, David A. M .; Vig, Eva; Goebl, Mark G .; Harrington, Maureen A. (15. října 2002). „Špička: Myš Pellino-2 moduluje signalizaci IL-1 a lipopolysacharidů“. The Journal of Immunology. 169 (8): 4075–4078. doi:10,4049 / jimmunol.169.8.4075. PMID 12370331. S2CID 25317655.
- ^ Pétrilli, Virginie; Dostert, Catherine; Muruve, Daniel A; Tschopp, Jürg (prosinec 2007). „Inflammasom: komplex snímající nebezpečí spouštějící vrozenou imunitu“. Aktuální názor na imunologii. 19 (6): 615–622. doi:10.1016 / j.coi.2007.09.002. PMID 17977705.
- ^ Xavier, Ramnik; Rabizadeh, Shahrooz; Ishiguro, Kazuhiro; Andre, Niko; Ortiz, J. Bernabe; Wachtel, Heather; Morris, David G .; Lopez-Ilasaca, Marco; Shaw, Albert C .; Swat, Wojciech; Seed, Brian (19. července 2004). „Disky velké (Dlg1) komplexy v aktivaci lymfocytů“. Journal of Cell Biology. 166 (2): 173–178. doi:10.1083 / jcb.200309044. PMC 2172307. PMID 15263016.
- ^ Hanada, Toshihiko; Lin, Lunhui; Chandy, K. George; Oh, S. Steven; Chishti, Athar H. (24. října 1997). „Lidský homolog disků Drosophila Large Supresor tumoru se váže na p56 lck tyrosinkinázy a třepačky typu Kv1.3 draslíkový kanál v T lymfocytech“. Journal of Biological Chemistry. 272 (43): 26899–26904. doi:10.1074 / jbc.272.43.26899. PMID 9341123. S2CID 23446334.
- ^ Kolo, červen L .; Humphries, Lisa A .; Tomassian, Tamar; Mittelstadt, Paul; Zhang, Min; Miceli, M. Carrie (únor 2007). „Lešenový protein Dlgh1 koordinuje alternativní aktivaci kinázy p38 a směruje signály receptorů T buněk směrem k NFAT, ale nikoli k transkripčním faktorům NF-kB“. Přírodní imunologie. 8 (2): 154–161. doi:10.1038 / ni1422. PMID 17187070. S2CID 11906543.
- ^ Kolo, červen L .; Tomassian, Tamar; Zhang, Min; Patel, Viresh; Schoenberger, Stephen P .; Miceli, M. Carrie (7. února 2005). „Dlgh1 koordinuje aktinovou polymeraci, agregaci receptorů synaptických T buněk a agregaci lipidových raftů a efektorovou funkci v T buňkách“. Journal of Experimental Medicine. 201 (3): 419–430. doi:10.1084 / jem.20041428. PMC 2213022. PMID 15699074.
- ^ Bloom, Ona; Unternaehrer, Julia J .; Jiang, Aimin; Shin, Jeong-Sook; Delamarre, Lélia; Allen, Patrick; Mellman, Ira (21. dubna 2008). „Spinofilin se podílí na přenosu informací na imunologických synapsích“. Journal of Cell Biology. 181 (2): 203–211. doi:10.1083 / jcb.200711149. PMID 18411312. S2CID 1717736.
- ^ Meskauskiene, Rasa; Nater, Mena; Goslings, David; Kessler, Felix; Camp, Roel op den; Apel, Klaus (23. října 2001). „FLU: Negativní regulátor biosyntézy chlorofylu u Arabidopsis thaliana“. Sborník Národní akademie věd. 98 (22): 12826–12831. Bibcode:2001PNAS ... 9812826M. doi:10.1073 / pnas.221252798. PMC 60138. PMID 11606728.
- ^ A b C Maiuri, Tamara; Mocle, Andrew J .; Hung, Claudia L .; Xia, Jianrun; van Roon-Mom, Willeke M. C .; Truant, Ray (25. prosince 2016). „Huntingtin je protein lešení v komplexu reakce na poškození oxidační DNA ATM“. Lidská molekulární genetika. 26 (2): 395–406. doi:10,1093 / hmg / ddw395. PMID 28017939.
- ^ Ayala-Peña, Sylvette (září 2013). „Role poškození oxidační DNA při mitochondriální dysfunkci a patogenezi Huntingtonovy choroby“. Volná radikální biologie a medicína. 62: 102–110. doi:10.1016 / j.freeradbiomed.2013.04.017. PMC 3722255. PMID 23602907.
- ^ Poonperm, Rawin; Takata, Hideaki; Hamano, Tohru; Matsuda, Atsushi; Uchiyama, Susumu; Hiraoka, Yasushi; Fukui, Kiichi (1. července 2015). „Chromozomové lešení je dvojvláknová sestava lešenových proteinů“. Vědecké zprávy. 5 (1): 11916. Bibcode:2015NatSR ... 511916P. doi:10.1038 / srep11916. PMC 4487240. PMID 26132639.
- ^ molekulární biologie buněk od Lodish[úplná citace nutná ]
- ^ Ayala-Castro, Carla; Saini, Avneesh; Outten, F. Wayne (2008). „Cesty shlukování Fe-S v bakteriích“. Recenze mikrobiologie a molekulární biologie. 72 (1): 110–125. doi:10.1128 / MMBR.00034-07. PMC 2268281. PMID 18322036.
- ^ Adrover, Miquel; Howes, Barry D .; Iannuzzi, Clara; Smulevich, Giulietta; Pastore, Annalisa (1. června 2015). „Anatomie proteinu lešení clusteru železo-síra: Porozumění determinantům stability [2Fe – 2S] clusteru na IscU“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1853 (6): 1448–1456. doi:10.1016 / j.bbamcr.2014.10.023. PMID 25447544.
- ^ Molecular Cell Biology od Lodish et al. vydání 5[stránka potřebná ]
