Arylový uhlovodíkový receptor - Aryl hydrocarbon receptor
The aryl uhlovodíkový receptor (AhR nebo AHR nebo ahr nebo ahR) je protein že u lidí je kódováno AHR gen. Arylový uhlovodíkový receptor je a transkripční faktor který reguluje genovou expresi. Původně se předpokládalo, že funguje především jako senzor xenobiotikum chemikálie a také jako regulátor enzymů, jako je cytochrom P450s které tyto chemikálie metabolizují. Nejpozoruhodnější z těchto xenobiotických chemikálií jsou aromatické (aryl) uhlovodíky od kterého receptor odvozuje svůj název.
Více nedávno bylo objeveno, že AhR je aktivován (nebo deaktivován) řadou endogenní indol deriváty jako např kynurenin. Kromě regulace metabolismu enzymů má AhR také roli v regulaci imunity, kmenová buňka údržba a buněčná diferenciace.[5][6][7]
Arylový uhlovodíkový receptor je členem rodiny základní šroubovice-smyčka-šroubovice transkripční faktory. AHR váže několik exogenních ligandů, jako je přírodní rostlina flavonoidy, polyfenoly a indoly, jakož i syntetické polycyklické aromatické uhlovodíky a sloučeniny podobné dioxinům. AhR je cytosolický transkripční faktor, který je normálně neaktivní a je vázán na několik pomocné chaperony. Na ligand vazba na chemikálie jako např 2,3,7,8-tetrachlorodibenzostr-dioxin (TCDD), chaperony distancovat což má za následek přemístění AhR do jádro a dimerování s ARNT (AhR jaderný translokátor), což vede ke změnám v gen transkripce.
Proteinové funkční domény

AhR protein obsahuje několik domén zásadních pro funkci a je klasifikován jako člen základní šroubovice-smyčka-šroubovice /Per-Arnt-Sim (bHLH / PAS) rodina transkripční faktory.[8][9] Motiv bHLH je umístěn v N-terminál proteinu a je běžnou entitou v celé řadě transkripční faktory.[10] Členové nadrodiny bHLH mají dvě funkčně charakteristické a vysoce konzervované domény. První je základní oblast (b), která se podílí na vazbě transkripčního faktoru na DNA. Druhým je oblast helix-loop-helix (HLH), která usnadňuje interakce protein-protein. AhR obsahuje také dvě domény PAS, PAS-A a PAS-B, což jsou úseky 200 - 350 aminokyseliny které vykazují vysokou sekvenční homologii s proteinovými doménami, které byly původně nalezeny v Drosophila období genů (Per) a single-minded (Sim) a v dimerizačním partnerovi AhR nukleární translokátor aryl uhlovodíkových receptorů (ARNT).[11] Domény PAS podporují specifické sekundární interakce s jinými proteiny obsahujícími doménu PAS, jako je tomu v případě AhR a ARNT, takže se mohou tvořit dimerní a heteromerní proteinové komplexy. Vazebné místo ligandu AhR je obsaženo v doméně PAS-B[12] a obsahuje několik konzervovaných zbytků kritických pro vazbu ligandu.[13] Nakonec a glutamin -rich (bohatá na Q) se nachází v doméně C-terminál oblast proteinu a podílí se na náboru a transaktivaci koaktivátorů.[14]
Ligandy
AhR ligandy byly obecně rozděleny do dvou kategorií, syntetických nebo přirozeně se vyskytujících. První objevené ligandy byly syntetické a členy halogenovaných aromatických uhlovodíků (polychlorované dibenzodioxiny, dibenzofurany a bifenyly ) a polycyklické aromatické uhlovodíky (3-methylcholanthren, benzo [A] pyren, benzanthracenes a benzoflavony ).[15][16]
Výzkum se zaměřil na přirozeně se vyskytující sloučeniny s nadějí na identifikaci endogenního ligandu. Přirozeně se vyskytující sloučeniny, které byly identifikovány jako ligandy Ahr, zahrnují deriváty tryptofan jako indigo barvivo a indirubin,[17] tetrapyrroly jako bilirubin,[18] the kyselina arachidonová metabolity lipoxin A4 a prostaglandin G.,[19] upraveno lipoprotein s nízkou hustotou[20] a několik dietních karotenoidy.[16] Jedním z předpokladů při hledání endogenního ligandu je, že ligandem bude receptor agonista. Práce však Savouret et al. ukázaly, že tomu tak nemusí být, protože jejich nálezy ukazují, že 7-ketocholesterol kompetitivně inhibuje přenos signálu Ahr.[21]
Karbidopa je selektivní modulátor aryl-uhlovodíkových receptorů (SAhRM).[22]
Indolokarbazol (ICZ) je jedním z nejsilnějších nehalogenovaných agonistů pro AHR popsaných in vitro.[23]
Signalizační cesta
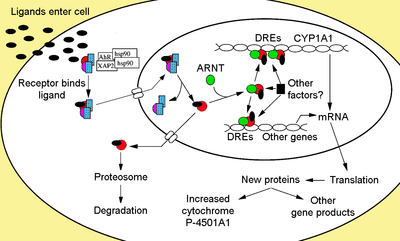
Cytosolický komplex
Na ligand vázaný Ahr není zadržen cytoplazma jako neaktivní protein komplex skládající se z dimeru Hsp90,[24][25] prostaglandin E syntáza 3 (PTGES3, str. 23)[26][27][28][29] a jediná molekula imunofilin -jako Protein interagující s AH receptorem, známý také jako protein 2 asociovaný s virem hepatitidy B (XAP2),[30] AhR interagující protein (AIP),[31][32] a aktivovaná AhR 9 (ARA9).[33] Dimer Hsp90, spolu s PTGES3 (p23), má multifunkční roli v ochraně receptoru před proteolýzou, omezuje receptor v konformaci vnímavé k vazbě ligandu a brání předčasné vazbě ARNT.[12][27][29][34][35][36] AIP interaguje s karboxylovým terminálem Hsp90 a váže se na AhR sekvence nukleární lokalizace (NLS) zabránění nevhodnému obchodování s receptorem do jádra.[37][38][39]
Aktivace receptoru
Po navázání ligandu na AhR se uvolní AIP, což vede k expozici NLS, který se nachází v oblasti bHLH,[40] což vede k importu do jádra.[41] Předpokládá se, že jakmile v jádru Hsp90 disociuje vystavením dvou PAS domén umožňujících vazbu ARNT.[36][42][43][44] Aktivovaný heterodimerový komplex AhR / ARNT je poté schopen přímé nebo nepřímé interakce s DNA vazbou na rozpoznávací sekvence lokalizované v 5'-regulační oblasti genů reagujících na dioxiny.[36][43][45]
Vazba DNA (prvek xenobiotické odpovědi - XRE)
Klasický rozpoznávací motiv komplexu AhR / ARNT, označovaný jako prvek reagující na AhR-, dioxin- nebo xenobiotikum (AHRE, DRE nebo XRE), obsahuje základní sekvenci 5'-GCGTG-3 '[46] v rámci konsensuální sekvence 5'-T / GNGCGTGA / CG / CA-3 '[47][48] v promotor region genů reagujících na AhR. Heterodimer AhR / ARNT se přímo váže na sekvenci jádra AHRE / DRE / XRE asymetrickým způsobem tak, že ARNT se váže na 5'-GTG-3 'a AhR se váže na 5'-TC / TGC-3'.[49][50][51] Nedávný výzkum naznačuje, že druhý typ prvku označovaného jako AHRE-II, 5'-CATG (N6) C [T / A] TG-3 ', je schopen nepřímo působit s komplexem AhR / ARNT.[52][53] Bez ohledu na prvek odpovědi je konečným výsledkem řada různých změn v genové expresi.
Funkční role ve fyziologii a toxikologii
Role ve vývoji
Z hlediska evoluce je nejstarší fyziologická role AhR ve vývoji. Předpokládá se, že AhR se vyvinulo z bezobratlých kde sloužil roli nezávislou na ligandu v normálních procesech vývoje.[54] Homolog AhR v Drosophila, bezpáteřní (ss) je nezbytný pro vývoj distálních segmentů antény a nohy.[55][56] Ss dimerizuje s tango (tgo), což je homolog k savčímu Arnt, k zahájení transkripce genu. Vývoj receptoru v obratlovců vedlo ke schopnosti vázat ligand a mohlo by lidem pomoci vyvinout se, aby snášely kouř ohně. Při vývoji obratlovců AhR zdánlivě hraje roli v buněčné proliferaci a diferenciaci.[57] Přes nedostatek jasného endogenního ligandu se zdá, že AhR hraje roli v diferenciaci mnoha vývojových cest, včetně hematopoézy,[58] lymfoidní systémy,[59][60] T-buňky,[61] neurony,[62] a hepatocyty.[63] Bylo také zjištěno, že AhR má důležitou funkci v krvetvorných kmenových buňkách: antagonismus AhR podporuje jejich sebeobnovu a expanzi ex-vivo[64] a podílí se na diferenciaci megakaryocytů.[65]
Adaptivní a vrozená reakce
Adaptivní odpověď se projevuje indukcí enzymů metabolizujících xenobiotika. Důkaz této odpovědi byl poprvé pozorován indukcí cytochromu P450, rodiny 1, podčeledi A, polypeptidu 1 (Cyp1a1), který byl výsledkem expozice TCDD, u které bylo stanoveno, že přímo souvisí s aktivací Ahr signální dráhy.[66][67][68] Hledání dalších metabolizujících genů indukovaných AhR ligandy, kvůli přítomnosti DRE, vedlo k identifikaci „AhR genové baterie“ metabolických enzymů fáze I a fáze II sestávající z CYP1A1, CYP1A2, CYP1B1, NQO1, ALDH3A1, UGT1A2 a GSTA1.[69] Pravděpodobně mají obratlovci tuto funkci, aby byli schopni detekovat širokou škálu chemikálií, což naznačuje široká škála substrátů, které je AhR schopen vázat a usnadnit jejich biotransformace a eliminace. AhR může také signalizovat přítomnost toxických chemikálií v potravinách a způsobit averzi těchto potravin.[70]
Zdá se, že aktivace AhR je také důležitá pro imunologické reakce a inhibici zánětu [60] prostřednictvím vyšší regulace interleukin 22 [71] a downregulace Čt17 Odezva.[72]Knockdown AHR většinou snižuje expresi genů vrozené imunity u Buňky THP-1.[73]
Toxická reakce
Rozšíření adaptivní reakce jsou toxické reakce vyvolané aktivací AhR. Toxicita je výsledkem dvou různých způsobů signalizace AhR. První je vedlejším účinkem adaptivní reakce, při které indukce metabolických enzymů vede k produkci toxických metabolitů. Například polycyklický aromatický uhlovodík benzo [A] pyren (BaP), ligand pro AhR, indukuje svůj vlastní metabolismus a bioaktivaci na toxický metabolit indukcí CYP1A1 a CYP1B1 v několika tkáních.[74] Druhý přístup k toxicitě je výsledkem aberantních změn v globální transkripci genů nad rámec těch, které byly pozorovány v „AhR genové baterii“. Tyto globální změny v genové expresi vedou k nepříznivým změnám v buněčných procesech a funkcích.[75] Microarray analýza se ukázalo jako nejvýhodnější pro pochopení a charakterizaci této odpovědi.[57][76][77][78]
Interakce protein-protein
Kromě výše zmíněných proteinových interakcí bylo prokázáno, že také AhR komunikovat s:
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000106546 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000019256 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Esser C (2016). "Arylový uhlovodíkový receptor v imunitě: nástroje a potenciál". Potlačení a regulace imunitních odpovědí. Metody v molekulární biologii. 1371. 239–57. doi:10.1007/978-1-4939-3139-2_16. ISBN 978-1-4939-3138-5. PMID 26530806.
- ^ Kawajiri K, Fujii-Kuriyama Y (květen 2017). „Arylový uhlovodíkový receptor: multifunkční chemický senzor pro obranu hostitele a homeostatickou údržbu“. Experimentální zvířata. 66 (2): 75–89. doi:10.1538 / expanim.16-0092. PMC 5411294. PMID 27980293.
- ^ Gutiérrez-Vázquez C, Quintana FJ (leden 2018). „Regulace imunitní odpovědi receptorem arylových uhlovodíků“. Imunita. 48 (1): 19–33. doi:10.1016 / j.immuni.2017.12.012. PMC 5777317. PMID 29343438.
- ^ Burbach KM, Polsko A, Bradfield CA (září 1992). „Klonování cDNA receptoru Ah odhaluje výrazný transkripční faktor aktivovaný ligandem“. Sborník Národní akademie věd Spojených států amerických. 89 (17): 8185–9. doi:10.1073 / pnas.89.17.8185. PMC 49882. PMID 1325649.
- ^ Fukunaga BN, Probst MR, Reisz-Porszasz S, Hankinson O (prosinec 1995). "Identifikace funkčních domén arylového uhlovodíkového receptoru". The Journal of Biological Chemistry. 270 (49): 29270–8. doi:10.1074 / jbc.270.49.29270. PMID 7493958.
- ^ Jones S (2004). "Přehled základních proteinů helix-loop-helix". Genome Biology. 5 (6): 226. doi:10.1186 / gb-2004-5-6-226. PMC 463060. PMID 15186484.
- ^ Ema M, Sogawa K, Watanabe N, Chujoh Y, Matsushita N, Gotoh O, Funae Y, Fujii-Kuriyama Y (duben 1992). "klonování cDNA a struktura myšího domnělého Ah receptoru". Sdělení o biochemickém a biofyzikálním výzkumu. 184 (1): 246–53. doi:10.1016 / 0006-291X (92) 91185-S. PMID 1314586.
- ^ A b Coumailleau P, Poellinger L, Gustafsson JA, Whitelaw ML (říjen 1995). „Definice minimální domény dioxinového receptoru, která je spojena s Hsp90 a udržuje afinitu a specificitu vazby ligandu divokého typu“. The Journal of Biological Chemistry. 270 (42): 25291–300. doi:10.1074 / jbc.270.42.25291. PMID 7559670.
- ^ Goryo K, Suzuki A, Del Carpio CA, Siizaki K, Kuriyama E, Mikami Y, Kinoshita K, Yasumoto K, Rannug A, Miyamoto A, Fujii-Kuriyama Y, Sogawa K (březen 2007). "Identifikace aminokyselinových zbytků v Ah receptoru podílejících se na vazbě ligandu". Sdělení o biochemickém a biofyzikálním výzkumu. 354 (2): 396–402. doi:10.1016 / j.bbrc.2006.12.227. PMID 17227672.
- ^ Kumar MB, Ramadoss P, Reen RK, Vanden Heuvel JP, Perdew GH (listopad 2001). „Subdoména transaktivační domény lidského Ah receptoru bohatá na Q je vyžadována pro transkripční aktivitu zprostředkovanou dioxiny“. The Journal of Biological Chemistry. 276 (45): 42302–10. doi:10,1074 / jbc.M104798200. PMID 11551916.
- ^ Denison MS, Pandini A, Nagy SR, Baldwin EP, Bonati L (září 2002). "Vazba ligandu a aktivace Ah receptoru". Chemicko-biologické interakce (Vložený rukopis). 141 (1–2): 3–24. doi:10.1016 / S0009-2797 (02) 00063-7. PMID 12213382.
- ^ A b C Denison MS, Nagy SR (2003). "Aktivace arylového uhlovodíkového receptoru strukturně různými exogenními a endogenními chemikáliemi". Roční přehled farmakologie a toxikologie. 43: 309–34. doi:10.1146 / annurev.pharmtox.43.100901.135828. PMID 12540743.
- ^ Adachi J, Mori Y, Matsui S, Takigami H, Fujino J, Kitagawa H, Miller CA, Kato T, Saeki K, Matsuda T (srpen 2001). „Indirubin a indigo jsou silné ligandy aryl-uhlovodíkových receptorů přítomné v lidské moči“. The Journal of Biological Chemistry. 276 (34): 31475–8. doi:10,1074 / jbc.C100238200. PMID 11425848.
- ^ Sinal CJ, Bend JR (říjen 1997). „Indukce cyp1a1 závislá na aryl-uhlovodíkovém receptoru bilirubinem v buňkách myšího hepatomu hepa 1c1c7“. Molekulární farmakologie. 52 (4): 590–9. doi:10,1124 / mol. 52,4.590. PMID 9380021.
- ^ Seidel SD, Winters GM, Rogers WJ, Ziccardi MH, Li V, Keser B, Denison MS (2001). "Aktivace signální dráhy receptoru Ah prostaglandiny". Journal of Biochemical and Molecular Toxicology. 15 (4): 187–96. doi:10,1002 / jbt.16. PMID 11673847. S2CID 21953408.
- ^ McMillan BJ, Bradfield CA (leden 2007). „Arylový uhlovodíkový receptor je aktivován modifikovaným lipoproteinem s nízkou hustotou“. Sborník Národní akademie věd Spojených států amerických. 104 (4): 1412–7. doi:10.1073 / pnas.0607296104. PMC 1783125. PMID 17227852.
- ^ Savouret JF, Antenos M, Quesne M, Xu J, Milgrom E, Casper RF (únor 2001). „7-ketocholesterol je endogenní modulátor pro arylhydrokarbonový receptor“. The Journal of Biological Chemistry. 276 (5): 3054–9. doi:10,1074 / jbc.M005988200. PMID 11042205.
- ^ Safe, Stephen (2017). „Carbidopa: Selektivní modulátor receptoru Ah (SAhRM)“. Biochemical Journal. 474 (22): 3763–3765. doi:10.1042 / BCJ20170728. PMID 29109131.
- ^ Wincent, Emma; Shirani, Hamid; Bergman, Jan; Rannug, Ulf; Janosik, Tomasz (únor 2009). „Syntéza a biologické hodnocení kondenzovaných thio- a selenopyranů jako nových analogů indolokarbazolu s afinitou k aryl-uhlovodíkovým receptorům“. Bioorganická a léčivá chemie. 17 (4): 1648–1653. doi:10.1016 / j.bmc.2008.12.072. PMID 19186062.
- ^ Denis M, Cuthill S, Wikström AC, Poellinger L, Gustafsson JA (září 1988). „Sdružení dioxinového receptoru s proteinem tepelného šoku Mr 90 000: strukturní příbuznost s glukokortikoidovým receptorem“. Sdělení o biochemickém a biofyzikálním výzkumu. 155 (2): 801–7. doi:10.1016 / S0006-291X (88) 80566-7. PMID 2844180.
- ^ Perdew GH (září 1988). „Sdružení receptoru Ah s proteinem tepelného šoku 90 kDa“. The Journal of Biological Chemistry. 263 (27): 13802–5. PMID 2843537.
- ^ Cox MB, Miller CA (březen 2004). „Spolupráce proteinu 90 a p23 tepelného šoku v signalizaci aryl-uhlovodíkových receptorů“. Stres buněk a chaperony. 9 (1): 4–20. doi:10.1379/460.1. PMC 1065305. PMID 15270073.
- ^ A b Kazlauskas A, Poellinger L, Pongratz I (květen 1999). „Důkaz, že cochaperon p23 reguluje citlivost ligandu na dioxinový (aryl uhlovodíkový) receptor“. The Journal of Biological Chemistry. 274 (19): 13519–24. doi:10.1074 / jbc.274.19.13519. PMID 10224120.
- ^ Kazlauskas A, Sundström S, Poellinger L, Pongratz I (duben 2001). „Chaperonový komplex hsp90 reguluje intracelulární lokalizaci dioxinového receptoru“. Molekulární a buněčná biologie. 21 (7): 2594–607. doi:10.1128 / MCB.21.7.2594-2607.2001. PMC 86890. PMID 11259606.
- ^ A b Shetty PV, Bhagwat BY, Chan WK (březen 2003). „P23 zvyšuje tvorbu komplexu aryl-uhlovodíkový receptor-DNA“. Biochemická farmakologie. 65 (6): 941–8. doi:10.1016 / S0006-2952 (02) 01650-7. PMID 12623125.
- ^ Meyer BK, Pray-Grant MG, Vanden Heuvel JP, Perdew GH (únor 1998). „Protein 2 asociovaný s virem hepatitidy B je podjednotkou jádrového komplexu neligandovaného arylového uhlovodíkového receptoru a vykazuje aktivitu zesilovače transkripce.“. Molekulární a buněčná biologie. 18 (2): 978–88. doi:10.1128 / MCB.18.2.978. PMC 108810. PMID 9447995.
- ^ Ma Q, Whitlock JP (duben 1997). „Nový cytoplazmatický protein, který interaguje s receptorem Ah, obsahuje tetratrikopeptidové opakující se motivy a zvyšuje transkripční odpověď na 2,3,7,8-tetrachlorodibenzo-p-dioxin.“. The Journal of Biological Chemistry. 272 (14): 8878–84. doi:10.1074 / jbc.272.14.8878. PMID 9083006.
- ^ Zhou Q, Lavorgna A, Bowman M, Hiscott J, Harhaj EW (červen 2015). „Aryl Uhlovodíkový receptor interagující s proteiny cílí IRF7 na potlačení antivirové signalizace a indukci interferonu typu I“. The Journal of Biological Chemistry. 290 (23): 14729–39. doi:10,1074 / jbc.M114,633065. PMC 4505538. PMID 25911105.
- ^ Carver LA, Bradfield CA (duben 1997). „Ligandově závislá interakce arylového uhlovodíkového receptoru s novým imunofilinovým homologem in vivo“. The Journal of Biological Chemistry. 272 (17): 11452–6. doi:10.1074 / jbc.272.17.11452. PMID 9111057.
- ^ Carver LA, Jackiw V, Bradfield CA (prosinec 1994). „Protein 90-kDa tepelného šoku je nezbytný pro signalizaci receptoru Ah v kvasinkovém expresním systému“. The Journal of Biological Chemistry. 269 (48): 30109–12. PMID 7982913.
- ^ Pongratz I, Mason GG, Poellinger L (červenec 1992). „Dvojí role proteinu hsp90 s 90 kDa tepelného šoku v modulaci funkčních aktivit dioxinového receptoru. Důkaz, že dioxinový receptor funkčně patří do podtřídy jaderných receptorů, které vyžadují hsp90 jak pro aktivitu vázání ligandů, tak pro potlačení vnitřní aktivity vázání DNA. . The Journal of Biological Chemistry. 267 (19): 13728–34. PMID 1320028.
- ^ A b C Whitelaw M, Pongratz I, Wilhelmsson A, Gustafsson JA, Poellinger L (duben 1993). „Nábor arntového regulátoru závislý na ligandu určuje rozpoznání DNA receptorem dioxinu“. Molekulární a buněčná biologie. 13 (4): 2504–14. doi:10.1128 / MCB.13.4.2504. PMC 359572. PMID 8384309.
- ^ Carver LA, LaPres JJ, Jain S, Dunham EE, Bradfield CA (prosinec 1998). „Charakterizace proteinu asociovaného s receptorem Ah, ARA9“. The Journal of Biological Chemistry. 273 (50): 33580–7. doi:10.1074 / jbc.273.50.33580. PMID 9837941.
- ^ Petrulis JR, Hord NG, Perdew GH (prosinec 2000). „Subcelulární lokalizace arylového uhlovodíkového receptoru je modulována proteinem 2 asociovaným s imunofilinovým homologem s virem hepatitidy B“. The Journal of Biological Chemistry. 275 (48): 37448–53. doi:10,1074 / jbc.M006873200. PMID 10986286.
- ^ Petrulis JR, Kusnadi A, Ramadoss P, Hollingshead B, Perdew GH (leden 2003). „Hsp90 Co-chaperon XAP2 mění importin beta rozpoznávání bipartitního nukleárního lokalizačního signálu Ah receptoru a potlačuje transkripční aktivitu“. The Journal of Biological Chemistry. 278 (4): 2677–85. doi:10,1074 / jbc.M209331200. PMID 12431985.
- ^ Ikuta T, Eguchi H, Tachibana T, Yoneda Y, Kawajiri K (leden 1998). "Jaderná lokalizace a exportní signály lidského aryl-uhlovodíkového receptoru". The Journal of Biological Chemistry. 273 (5): 2895–904. doi:10.1074 / jbc.273.5.2895. PMID 9446600.
- ^ Pollenz RS, Barbour ER (srpen 2000). „Analýza komplexního vztahu mezi exportem jader a regulací genů zprostředkovanou aryl uhlovodíkovými receptory“. Molekulární a buněčná biologie. 20 (16): 6095–104. doi:10.1128 / MCB.20.16.6095-6104.2000. PMC 86085. PMID 10913191.
- ^ Hoffman EC, Reyes H, Chu FF, Sander F, Conley LH, Brooks BA, Hankinson O (květen 1991). "Klonování faktoru požadovaného pro aktivitu receptoru Ah (dioxin)". Věda. 252 (5008): 954–8. doi:10.1126 / science.1852076. PMID 1852076.
- ^ A b Probst MR, Reisz-Porszasz S, Agbunag RV, Ong MS, Hankinson O (září 1993). „Role jaderného translokátorového proteinu arylovodíkového receptoru při působení na aryl- uhlovodíkový (dioxinový) receptor“. Molekulární farmakologie. 44 (3): 511–8. PMID 8396713.
- ^ Reyes H, Reisz-Porszasz S, Hankinson O (květen 1992). „Identifikace jaderného translokátorového proteinu Ah receptoru (Arnt) jako složky formy vázající DNA na Ah receptor“. Věda. 256 (5060): 1193–5. doi:10.1126 / science.256.5060.1193. PMID 1317062. S2CID 34075046.
- ^ Dolwick KM, Swanson HI, Bradfield CA (září 1993). „In vitro analýza domén receptoru Ah zapojených do rozpoznávání DNA aktivované ligandem“. Sborník Národní akademie věd Spojených států amerických. 90 (18): 8566–70. doi:10.1073 / pnas.90.18.8566. PMC 47398. PMID 8397410.
- ^ Shen ES, Whitlock JP (duben 1992). „Interakce protein-DNA na zesilovači reagujícím na dioxiny. Mutační analýza vazebného místa DNA pro ligandovaný Ah receptor“. The Journal of Biological Chemistry. 267 (10): 6815–9. PMID 1313023.
- ^ Lusska A, Shen E, Whitlock JP (březen 1993). „Interakce protein-DNA na zesilovači reagujícím na dioxiny. Analýza šesti míst vázajících DNA v dobré víře pro ligandovaný Ah receptor“. The Journal of Biological Chemistry. 268 (9): 6575–80. PMID 8384216.
- ^ Yao EF, Denison MS (červen 1992). "Determinanty sekvence DNA pro vazbu transformovaného Ah receptoru na zesilovač reagující na dioxin". Biochemie. 31 (21): 5060–7. doi:10.1021 / bi00136a019. PMID 1318077.
- ^ Wharton KA, Franks RG, Kasai Y, Crews ST (prosinec 1994). "Kontrola transkripce střední linie CNS pomocí asymetrických prvků podobných E-boxu: podobnost s xenobiotickou responzivní regulací". Rozvoj. 120 (12): 3563–9. PMID 7821222.
- ^ Bacsi SG, Reisz-Porszasz S, Hankinson O (březen 1995). "Orientace komplexu heterodimerního aryl-uhlovodíkového (dioxinového) receptoru na jeho asymetrickou DNA rozpoznávací sekvenci". Molekulární farmakologie. 47 (3): 432–8. PMID 7700240.
- ^ Swanson HI, Chan WK, Bradfield CA (listopad 1995). „DNA vazebné specificity a pravidla párování Ah receptoru, ARNT a SIM proteinů“. The Journal of Biological Chemistry. 270 (44): 26292–302. doi:10.1074 / jbc.270.44.26292. PMID 7592839.
- ^ Boutros PC, Moffat ID, Franc MA, Tijet N, Tuomisto J, Pohjanvirta R, Okey AB (srpen 2004). „Dioxin-responzivní AHRE-II genová baterie: identifikace pomocí fylogenetické stopy“. Sdělení o biochemickém a biofyzikálním výzkumu. 321 (3): 707–15. doi:10.1016 / j.bbrc.2004.06.177. PMID 15358164.
- ^ Sogawa K, Numayama-Tsuruta K, Takahashi T, Matsushita N, Miura C, Nikawa J, Gotoh O, Kikuchi Y, Fujii-Kuriyama Y (červen 2004). „Nový indukční mechanismus krysího genu CYP1A2 zprostředkovaný heterodimerem Ah receptor-Arnt“. Sdělení o biochemickém a biofyzikálním výzkumu. 318 (3): 746–55. doi:10.1016 / j.bbrc.2004.04.090. PMID 15144902.
- ^ Hahn ME, Karchner SI, Evans BR, Franks DG, Merson RR, Lapseritis JM (září 2006). „Neočekávaná rozmanitost arylových uhlovodíkových receptorů u obratlovců jiných než savců: poznatky ze srovnávací genomiky“. Časopis experimentální zoologie Část A: Srovnávací experimentální biologie. 305 (9): 693–706. doi:10.1002 / jez.a.323. PMID 16902966.
- ^ Duncan DM, Burgess EA, Duncan I (květen 1998). „Kontrola distální anténní identity a vývoje tarzu u Drosophily pomocí spineless-aristapedia, homologu savčího dioxinového receptoru“. Geny a vývoj. 12 (9): 1290–303. doi:10,1101 / gad 12. 9. 1290. PMC 316766. PMID 9573046.
- ^ Emmons RB, Duncan D, Estes PA, Kiefel P, Mosher JT, Sonnenfeld M, Ward MP, Duncan I, Crews ST (září 1999). „Bezpáteřové aristapedie a tango proteiny bHLH-PAS interagují a regulují vývoj antén a tarzálu v Drosophile“. Rozvoj. 126 (17): 3937–45. PMID 10433921.
- ^ A b Tijet N, Boutros PC, Moffat ID, Okey AB, Tuomisto J, Pohjanvirta R (leden 2006). „Arylový uhlovodíkový receptor reguluje odlišné genové baterie závislé na dioxinech a nezávislé na dioxinech“. Molekulární farmakologie. 69 (1): 140–53. doi:10,1124 / mol. 105,018705. PMID 16214954. S2CID 1913812.
- ^ Gasiewicz TA, Singh KP, Casado FL (březen 2010). „Arylový uhlovodíkový receptor hraje důležitou roli v regulaci hematopoézy: důsledky pro toxicitu krvetvorby vyvolanou benzenem“. Chemicko-biologické interakce. 184 (1–2): 246–51. doi:10.1016 / j.cbi.2009.10.019. PMC 2846208. PMID 19896476.
- ^ Kiss EA, Vonarbourg C, Kopfmann S, Hobeika E, Finke D, Esser C, Diefenbach A (prosinec 2011). "Přirozené ligandy arylových uhlovodíkových receptorů řídí organogenezi střevních lymfoidních folikulů". Věda. 334 (6062): 1561–5. doi:10.1126 / science.1214914. PMID 22033518. S2CID 206537957.
- ^ A b Li Y, Innocentin S, Withers DR, Roberts NA, Gallagher AR, Grigorieva EF, Wilhelm C, Veldhoen M (říjen 2011). „Exogenní podněty udržují intraepiteliální lymfocyty prostřednictvím aktivace aryl-uhlovodíkových receptorů“. Buňka. 147 (3): 629–40. doi:10.1016 / j.cell.2011.09.025. PMID 21999944. S2CID 16090460.
- ^ Quintana FJ, Basso AS, Iglesias AH, Korn T, Farez MF, Bettelli E, Caccamo M, Oukka M, Weiner HL (květen 2008). "Kontrola diferenciace buněk T (reg) a T (H) 17 receptorem aryl uhlovodíku". Příroda. 453 (7191): 65–71. doi:10.1038 / nature06880. PMID 18362915. S2CID 4384276.
- ^ Akahoshi E, Yoshimura S, Ishihara-Sugano M (září 2006). „Nadměrná exprese AhR (aryl-uhlovodíkový receptor) indukuje neurální diferenciaci buněk Neuro2a: neurotoxikologická studie“. Environmentální zdraví. 5: 24. doi:10.1186 / 1476-069X-5-24. PMC 1570454. PMID 16956419.
- ^ Walisser JA, Glover E, Pande K, Liss AL, Bradfield CA (prosinec 2005). „Vývoj jater závislý na arylových uhlovodíkových receptorech a hepatotoxicita jsou zprostředkovány různými typy buněk“. Sborník Národní akademie věd Spojených států amerických. 102 (49): 17858–63. doi:10.1073 / pnas.0504757102. PMC 1308889. PMID 16301529.
- ^ Boitano AE, Wang J, Romeo R, Bouchez LC, Parker AE, Sutton SE, Walker JR, Flaveny CA, Perdew GH, Denison MS, Schultz PG, Cooke MP (září 2010). „Antagonisté arylových uhlovodíkových receptorů podporují expanzi lidských hematopoetických kmenových buněk“. Věda. 329 (5997): 1345–8. doi:10.1126 / science.1191536. PMC 3033342. PMID 20688981.
- ^ Lindsey S, Papoutsakis ET (únor 2011). „Transkripční faktor arylovodíkového receptoru (AHR) reguluje megakaryocytovou polyploidizaci“. British Journal of Hematology. 152 (4): 469–84. doi:10.1111 / j.1365-2141.2010.08548.x. PMC 3408620. PMID 21226706.
- ^ Israel DI, Whitlock JP (září 1983). "Indukce mRNA specifická pro cytochrom P1-450 v buňkách divokého typu a variantních myších hepatomů". The Journal of Biological Chemistry. 258 (17): 10390–4. PMID 6885786.
- ^ Israel DI, Whitlock JP (květen 1984). „Regulace transkripce genu cytochromu P1-450 2,3,7,8-tetrachlorodibenzo-p-dioxinem v buňkách divokého typu a variantních myších hepatomů“. The Journal of Biological Chemistry. 259 (9): 5400–2. PMID 6715350.
- ^ Ko HP, Okino ST, Ma Q, Whitlock JP (leden 1996). „Dioxinem indukovaná transkripce CYP1A1 in vivo: aromatický uhlovodíkový receptor zprostředkovává transaktivaci, komunikaci zesilovač-promotor a změny struktury chromatinu“. Molekulární a buněčná biologie. 16 (1): 430–6. doi:10.1128 / MCB.16.1.430. PMC 231019. PMID 8524325.
- ^ Nebert DW, Roe AL, Dieter MZ, Solis WA, Yang Y, Dalton TP (leden 2000). „Role receptoru aromatických uhlovodíků a baterie [Ah] genu v reakci na oxidační stres, řízení buněčného cyklu a apoptóza“. Biochemická farmakologie. 59 (1): 65–85. doi:10.1016 / S0006-2952 (99) 00310-X. PMID 10605936.
- ^ Lensu S, Tuomisto JT, Tuomisto J, Viluksela M, Niittynen M, Pohjanvirta R (červen 2011). „Okamžitá a vysoce citlivá averzní reakce na novou potravinu související se stimulací AH receptoru“. Toxikologické dopisy. 203 (3): 252–7. doi:10.1016 / j.toxlet.2011.03.025. PMID 21458548.
- ^ Monteleone I, Rizzo A, Sarra M, Sica G, Sileri P, Biancone L, MacDonald TT, Pallone F, Monteleone G (červenec 2011). „Signály indukované arylovými uhlovodíkovými receptory zvyšují regulaci produkce IL-22 a inhibují zánět v gastrointestinálním traktu“. Gastroenterologie. 141 (1): 237–48, 248.e1. doi:10.1053 / j.gastro.2011.04.007. PMID 21600206.
- ^ Wei P, Hu GH, Kang HY, Yao HB, Kou W, Liu H, Zhang C, Hong SL (květen 2014). „Ligand receptoru arylových uhlovodíků působí na dendritické buňky a T buňky a potlačuje reakci Th17 u pacientů s alergickou rýmou“. Laboratorní vyšetřování; Journal of Technical Methods and Pathology. 94 (5): 528–35. doi:10.1038 / labinvest.2014.8. PMID 24514067.
- ^ Memari B, Bouttier M, Dimitrov V, Ouellette M, Behr MA, Fritz JH, White JH (listopad 2015). „Zapojení arylovodíkového receptoru do makrofágů infikovaných Mycobacterium tuberculosis má pleiotropní účinky na vrozenou imunitní signalizaci“. Journal of Immunology. 195 (9): 4479–91. doi:10,4049 / jimmunol.1501141. PMID 26416282.
- ^ Harrigan JA, Vezina CM, McGarrigle BP, Ersing N, Box HC, Maccubbin AE, Olson JR (únor 2004). „Tvorba DNA aduktu v precizně řezaných krysích játrech a plicích vystavených benzo [a] pyrenu“. Toxikologické vědy. 77 (2): 307–14. doi:10.1093 / toxsci / kfh030. PMID 14691214.
- ^ Lindén J, Lensu S, Tuomisto J, Pohjanvirta R (říjen 2010). "Dioxiny, arylový uhlovodíkový receptor a centrální regulace energetické rovnováhy". Frontiers in Neuroendocrinology. 31 (4): 452–78. doi:10.1016 / j.yfrne.2010.07.002. PMID 20624415. S2CID 34036181.
- ^ Martinez JM, Afshari CA, Bushel PR, Masuda A, Takahashi T, Walker NJ (říjen 2002). „Diferenciální toxikogenomické reakce na 2,3,7,8-tetrachlorodibenzo-p-dioxin v maligních a nemaligních lidských epiteliálních buňkách dýchacích cest“. Toxikologické vědy. 69 (2): 409–23. doi:10.1093 / toxsci / 69.2.409. PMID 12377990.
- ^ Vezina CM, Walker NJ, Olson JR (listopad 2004). „Subchronická expozice TCDD, PeCDF, PCB126 a PCB153: účinek na expresi jaterních genů“. Perspektivy zdraví a životního prostředí. 112 (16): 1636–44. doi:10,1289 / ehp.7253. PMC 1247661. PMID 15598615.
- ^ Ovando BJ, Vezina CM, McGarrigle BP, Olson JR (prosinec 2006). „Downregulace jaterních genů po akutní a subchronické expozici 2,3,7,8-tetrachlorodibenzo-p-dioxinu“. Toxikologické vědy. 94 (2): 428–38. doi:10.1093 / toxsci / kfl111. PMID 16984957.
- ^ Zhou Q, Lavorgna A, Bowman M, Hiscott J, Harhaj EW (červen 2015). „Aryl Uhlovodíkový receptor interagující s proteiny cílí IRF7 na potlačení antivirové signalizace a indukci interferonu typu I“. The Journal of Biological Chemistry. 290 (23): 14729–39. doi:10,1074 / jbc.M114,633065. PMC 4505538. PMID 25911105.
- ^ Hogenesch JB, Chan WK, Jackiw VH, Brown RC, Gu YZ, Pray-Grant M, Perdew GH, Bradfield CA (březen 1997). "Charakterizace podmnožiny nadrodiny základní-spirála-smyčka-spirála-PAS, která interaguje se složkami dioxinové signalizační dráhy". The Journal of Biological Chemistry. 272 (13): 8581–93. doi:10.1074 / jbc.272.13.8581. PMID 9079689.
- ^ Tian Y, Ke S, Chen M, Sheng T (listopad 2003). „Interakce mezi arylovým uhlovodíkovým receptorem a P-TEFb. Sekvenční nábor transkripčních faktorů a diferenciální fosforylace C-koncové domény RNA polymerázy II na promotoru cyp1a1“. The Journal of Biological Chemistry. 278 (45): 44041–8. doi:10,1074 / jbc.M306443200. PMID 12917420.
- ^ Wormke M, Stoner M, Saville B, Walker K, Abdelrahim M, Burghardt R, Safe S (březen 2003). „Arylový uhlovodíkový receptor zprostředkovává degradaci estrogenového receptoru alfa aktivací proteazomů“. Molekulární a buněčná biologie. 23 (6): 1843–55. doi:10.1128 / MCB.23.6.1843-1855.2003. PMC 149455. PMID 12612060.
- ^ Klinge CM, Kaur K, Swanson HI (leden 2000). „Arylový uhlovodíkový receptor interaguje s estrogenovými receptory alfa a osiřelými receptory COUP-TFI a ERRalpha1“. Archivy biochemie a biofyziky. 373 (1): 163–74. doi:10.1006 / abbi.1999.1552. PMID 10620335.
- ^ Beischlag TV, Wang S, Rose DW, Torchia J, Reisz-Porszasz S, Muhammad K, Nelson WE, Probst MR, Rosenfeld MG, Hankinson O (červen 2002). „Nábor rodiny NCoA / SRC-1 / p160 transkripčních koaktivátorů nukleárním translokátorovým komplexem aryl uhlovodíkový receptor / aryl uhlovodíkový receptor“. Molekulární a buněčná biologie. 22 (12): 4319–33. doi:10.1128 / MCB.22.12.4319-4333.2002. PMC 133867. PMID 12024042.
- ^ Antenos M, Casper RF, Brown TJ (listopad 2002). „Interakce s Nedd8, proteinem podobným ubikvitinu, zvyšuje transkripční aktivitu arylového uhlovodíkového receptoru“. The Journal of Biological Chemistry. 277 (46): 44028–34. doi:10,1074 / jbc.M202413200. PMID 12215427.
- ^ Kumar MB, Tarpey RW, Perdew GH (srpen 1999). „Diferenciální nábor koaktivátoru RIP140 Ah a estrogenovými receptory. Absence role pro motivy LXXLL“. The Journal of Biological Chemistry. 274 (32): 22155–64. doi:10.1074 / jbc.274.32.22155. PMID 10428779.
- ^ Kim DW, Gazourian L, Quadri SA, Romieu-Mourez R, Sherr DH, Sonenshein GE (listopad 2000). „RelA NF-kappaB podjednotka a aryl uhlovodíkový receptor (AhR) spolupracují na transaktivaci promotoru c-myc v buňkách mléčné žlázy“. Onkogen. 19 (48): 5498–506. doi:10.1038 / sj.onc.1203945. PMID 11114727.
- ^ Ruby CE, Leid M, Kerkvliet NI (září 2002). „2,3,7,8-Tetrachlorodibenzo-p-dioxin potlačuje aktivaci NF-kappaB / Rel v tumorových nekrotických faktorech alfa a anti-CD40 v dendritických buňkách: aktivace p50 homodimeru není ovlivněna“. Molekulární farmakologie. 62 (3): 722–8. doi:10,1124 / mol. 62.3.722. PMID 12181450.
- ^ Vogel CF, Sciullo E, Li W, Wong P, Lazennec G, Matsumura F (prosinec 2007). „RelB, nový partner transkripce zprostředkované receptorem arylových uhlovodíků“. Molekulární endokrinologie. 21 (12): 2941–55. doi:10.1210 / me.2007-0211. PMC 2346533. PMID 17823304.
- ^ Ge NL, Elferink CJ (srpen 1998). „Přímá interakce mezi arylovým uhlovodíkovým receptorem a proteinem retinoblastomu. Vazba dioxinové signalizace na buněčný cyklus“. The Journal of Biological Chemistry. 273 (35): 22708–13. doi:10.1074 / jbc.273.35.22708. PMID 9712901.
externí odkazy
- Aryl + uhlovodík + receptor v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Člověk AHR umístění genomu a AHR stránka s podrobnostmi o genu v UCSC Genome Browser.
- Člověk ARNT umístění genomu a ARNT stránka s podrobnostmi o genu v UCSC Genome Browser.




