Receptor buněčného povrchu - Cell surface receptor
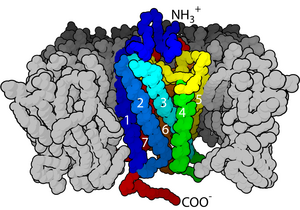
Receptory na povrchu buněk (membránové receptory, transmembránové receptory) jsou receptory které jsou vloženy do plazmatická membrána z buňky. Jednají buněčná signalizace přijetím (vazba na) extracelulární molekuly. Jsou specializovaní integrální membránové proteiny které umožňují komunikaci mezi buňkou a extracelulární prostor. Extracelulární molekuly mohou být hormony, neurotransmitery, cytokiny, růstové faktory, molekuly buněčné adheze nebo živiny; reagují s receptorem a vyvolávají změny v metabolismus a aktivita buňky. V procesu signální transdukce, vazba ligandu ovlivňuje a kaskádová chemická změna přes buněčnou membránu.
Struktura a mechanismus
Mnoho membránových receptorů je transmembránové proteiny. Existují různé druhy, včetně glykoproteiny a lipoproteiny.[1] Jsou známy stovky různých receptorů a mnoho dalších je ještě třeba studovat.[2][3] Transmembránové receptory jsou obvykle klasifikovány na základě jejich terciární (trojrozměrná) struktura. Pokud je trojrozměrná struktura neznámá, lze ji klasifikovat na základě topologie membrány. V nejjednodušších receptorech polypeptidové řetězce zkřížit lipidová dvojvrstva jednou, zatímco ostatní, například Receptory spojené s G-proteinem, křížit až sedmkrát. Každý buněčná membrána může mít několik druhů membránových receptorů s různými povrchovými distribucemi. Jeden receptor může být také různě distribuován v různých polohách membrány, v závislosti na druhu membránové a buněčné funkce. Receptory se často shlukují na povrchu membrány, spíše než rovnoměrně.[4][5]
Mechanismus
Byly navrženy dva modely, které vysvětlují mechanismus účinku transmembránových receptorů.
- Dimerizace: Dimerizační model naznačuje, že před vazbou ligandu existují receptory v a monomerní formulář. Když dojde k navázání agonisty, monomery se spojí a vytvoří aktivní dimer.
- Otáčení: Vazba ligandu na extracelulární část receptoru indukuje rotaci (konformační změnu) části transmembránových šroubovic receptoru. Rotace mění, které části receptoru jsou vystaveny na intracelulární straně membrány, a mění způsob, jakým může receptor interagovat s jinými proteiny v buňce.[6]
Domény
Transmembránové receptory v plazmatická membrána lze obvykle rozdělit na tři části.
Extracelulární domény
Extracelulární doména pouze externě z buňky nebo organela. Pokud polypeptidový řetězec několikrát překročí dvojvrstvu, vnější doména obsahuje smyčky propletené membránou. Podle definice je hlavní funkcí receptoru rozpoznávat a reagovat na typ ligandu. Například a neurotransmiter, hormon nebo atomové ionty se mohou každý vázat na extracelulární doménu jako ligand spojený s receptorem. Klotho je enzym, který působí na receptor, aby rozpoznal ligand (FGF23 ).
Transmembránové domény
Dvě nejhojnější třídy transmembránových receptorů jsou GPCR a jednoprůchodové transmembránové proteiny.[7][8] V některých receptorech, jako je nikotinový acetylcholinový receptor transmembránová doména tvoří proteinový pór přes membránu nebo kolem iontový kanál. Po aktivaci extracelulární domény navázáním příslušného ligandu se póry stanou přístupnými pro ionty, které pak difundují. V jiných receptorech procházejí transmembránové domény po navázání konformační změnou, která ovlivňuje intracelulární podmínky. V některých receptory, jako jsou členové Nadčeleď 7TM transmembránová doména zahrnuje kapsu vázající ligand.
Intracelulární domény
Intracelulární (nebo cytoplazmatický ) doména receptoru interaguje s vnitřkem buňky nebo organely a přenáší signál. Existují dvě základní cesty pro tuto interakci:
- Intracelulární doména komunikuje prostřednictvím interakcí protein-protein proti efektorové proteiny, které zase předají signál do cíle.
- S receptory spojené s enzymy, intracelulární doména má enzymatická aktivita. Často je to tak tyrosinkináza aktivita. Enzymatická aktivita může být také způsobena enzymem spojeným s intracelulární doménou.
Transdukce signálu

Transdukce signálu procesy prostřednictvím membránových receptorů zahrnují vnější reakce, při kterých se ligand váže na membránový receptor, a vnitřní reakce, při nichž se spouští intracelulární reakce.[9][10]
Transdukce signálu přes membránové receptory vyžaduje čtyři části:
- Extracelulární signální molekula: extracelulární signální molekula je produkována jednou buňkou a je alespoň schopná cestovat do sousedních buněk.
- Receptorový protein: buňky musí mít proteinové receptory buněčného povrchu, které se vážou na signální molekulu a komunikují dovnitř do buňky.
- Intracelulární signální proteiny: tyto přenášejí signál do organel buňky. Vazba signální molekuly na receptorový protein aktivuje intracelulární signální proteiny, které iniciují signální kaskádu.
- Cílové proteiny: konformace nebo jiné vlastnosti cílových proteinů se mění, když je signální dráha aktivní a mění chování buňky.[10]

Membránové receptory se dělí hlavně strukturou a funkcí do 3 tříd: The receptor spojený s iontovým kanálem; The receptor spojený s enzymem; a Receptor spojený s G proteinem.
- Receptory spojené s iontovým kanálem mají iontové kanály pro anionty a kationty a tvoří velkou rodinu víceprůchodových transmembránových proteinů. Podílejí se na událostech rychlé signalizace, které se obvykle nacházejí v elektricky aktivních buňkách, jako jsou neurony. Také se jim říká ligandem řízené iontové kanály. Otevírání a zavírání iontových kanálů je řízeno pomocí neurotransmitery.
- Receptory spojené s enzymy jsou buď samotné enzymy, nebo přímo aktivují přidružené enzymy. Jedná se typicky o jednoprůchodové transmembránové receptory, přičemž enzymatická složka receptoru je udržována intracelulárně. Většina receptorů spojených s enzymy je proteinová kináza nebo se s ní spojuje.
- Receptory spojené s G proteinem jsou integrální membránové proteiny, které mají sedm transmembránových šroubovic. Tyto receptory aktivují a G protein na agonista vazba a G-protein zprostředkovává účinky receptoru na intracelulární signální dráhy.
Receptor spojený s iontovým kanálem
Během události přenosu signálu v neuronu se neurotransmiter váže na receptor a mění konformaci proteinu. Tím se otevře iontový kanál a umožní se do buňky extracelulární ionty. Ionová permeabilita plazmatické membrány se mění, a to transformuje extracelulární chemický signál na intracelulární elektrický signál, který mění vzrušivost buněk.[11]
Acetylcholin receptor je receptor spojený s kationtovým kanálem. Protein se skládá ze 4 podjednotek: α, β, γ a δ podjednotek. Existují dvě podjednotky α, každé s jedním vazebným místem acetylcholinu. Tento receptor může existovat ve třech konformacích. Uzavřený a neobsazený stav je konformace nativního proteinu. Jelikož se dvě molekuly acetylcholinu váží na vazebná místa na podjednotkách α, mění se konformace receptoru a otevírá se brána, což umožňuje vstup mnoha iontů a malých molekul. Tento otevřený a obsazený stav však trvá jen malou dobu a poté se brána zavře a stane se uzavřeným a obsazeným stavem. Obě molekuly acetylcholinu se brzy oddělí od receptoru a vrátí jej do nativního uzavřeného a neobsazeného stavu.[12][13]
Receptory spojené s enzymy
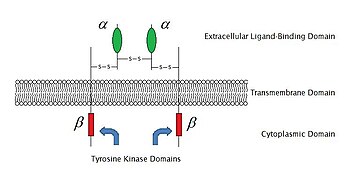
Od roku 2009 existuje 6 známých typů receptory spojené s enzymy: Receptor tyrosinkinázy; Receptory spojené s tyrosinkinázou; Receptor tyrosin fosfatázy; Receptor serin /threonin kinázy; Receptor guanylylcyklázy a histidinkináza asociované receptory. Receptorové tyrosinkinázy mají největší populaci a nejširší uplatnění. Většina z těchto molekul jsou receptory pro růstové faktory jako epidermální růstový faktor (EGF), růstový faktor odvozený z krevních destiček (PDGF), fibroblastový růstový faktor (FGF), růstový faktor hepatocytů (HGF), nervový růstový faktor (NGF) a hormony jako inzulín Většina z těchto receptorů po navázání se svými ligandy dimerizuje, aby se aktivovaly další signální transdukce. Například po epidermální růstový faktor (EGF) Receptor se váže na svůj ligand EGF, oba receptory dimerizují a poté podstupují fosforylace z tyrosin zbytky v části enzymu každé molekuly receptoru. To aktivuje tyrosinkinázu a katalyzuje další intracelulární reakce.
Receptory spojené s G proteinem
Receptory spojené s G proteinem obsahují velké protein rodina transmembránových receptorů. Nacházejí se pouze v eukaryoty.[14] The ligandy které se vážou a aktivují tyto receptory zahrnují: fotocitlivé sloučeniny, pachy, feromony, hormony, a neurotransmitery. Ty se liší velikostí od malých molekul po peptidy a velké bílkoviny. Receptory spojené s G proteinem se účastní mnoha nemocí, a proto jsou cílem mnoha moderních léčivých přípravků.[15]
Existují dvě hlavní dráhy přenosu signálu zahrnující receptory spojené s G-proteinem: the tábor signální cesta a fosfatidylinositol signální dráha.[16] Oba jsou zprostředkovány prostřednictvím G protein aktivace. G-protein je trimerní protein se třemi podjednotkami označenými jako α, β a γ. V reakci na aktivaci receptoru uvolňuje α podjednotka vázané guanosin difosfát (HDP), který je vytlačen o guanosin trifosfát (GTP), čímž se aktivuje podjednotka α, která se poté disociuje z podjednotek β a γ. Aktivovaná podjednotka α může dále přímo ovlivňovat intracelulární signální proteiny nebo cílové funkční proteiny.
Pokud jsou membránové receptory denaturované nebo nedostatečné, může být bráněno přenosu signálu a způsobit onemocnění. Některá onemocnění jsou způsobena poruchami funkce membránových receptorů. To je způsobeno nedostatkem nebo degradací receptoru prostřednictvím změn v genech, které kódují a regulují receptorový protein. Membránový receptor TM4SF5 ovlivňuje migraci jaterních buněk a hepatom.[17] Kortikální NMDA receptor také ovlivňuje tekutost membrány a je změněn u Alzheimerovy choroby.[18] Když je buňka infikována neobaleným virem, virus se nejprve váže na specifické membránové receptory a poté sám nebo subvirová složka prochází na cytoplazmatickou stranu buněčné membrány. V případě poliovirus, je známo in vitro, že interakce s receptory způsobují konformační přesmyky, které uvolňují virionový protein zvaný VP4. N-konec VP4 je myristylovaný a tedy hydrofobní 【kyselina myristová = CH3(CH2)12COOH】. Předpokládá se, že konformační změny vyvolané vazbou na receptory vedou k navázání kyseliny myristové na VP4 a vytvoření kanálu pro RNA.
Strukturovaný design léčiv

Prostřednictvím metod, jako je Rentgenová krystalografie a NMR spektroskopie informace o 3D strukturách cílových molekul dramaticky vzrostla, stejně jako strukturální informace o ligandech. To vede k rychlému rozvoji strukturovaný design léčiv. Některé z těchto nových léků cílí na membránové receptory. Současné přístupy k navrhování léků na základě struktury lze rozdělit do dvou kategorií. První kategorie je o stanovení ligandů pro daný receptor. Toho je obvykle dosaženo prostřednictvím databázových dotazů, biofyzikálních simulací a konstrukcí chemických knihoven. V každém případě se testuje velké množství potenciálních molekul ligandu, aby se našly ty, které odpovídají vazebné kapse receptoru. Tento přístup se obvykle označuje jako návrh léku na bázi ligandu. Klíčovou výhodou vyhledávání v databázi je, že šetří čas a energii při získávání nových účinných sloučenin. Další přístup konstrukce léků na základě struktury se týká kombinatorického mapování ligandů, které se označuje jako návrh léků na bázi receptorů. V tomto případě jsou molekuly ligandu konstruovány v rámci omezení vazebné kapsy postupným sestavováním malých kousků. Tyto části mohou být atomy nebo molekuly. Klíčovou výhodou takové metody je, že lze objevit nové struktury.[19][20][21]
Další příklady
- Adrenergní receptor,
- Čichové receptory,
- Receptorové tyrosinkinázy
- Receptor epidermálního růstového faktoru
- Inzulínový receptor
- Receptory růstových faktorů fibroblastů,
- Vysoce afinitní neurotropinové receptory
- Efrinové receptory
- Integriny
- Receptor nervového růstového faktoru s nízkou afinitou
- NMDA receptor
- Několik Imunitní receptory
Viz také
Reference
- ^ Cuatrecasas P. (1974). "Membránové receptory". Roční přehled biochemie. 43: 169–214. doi:10.1146 / annurev.bi.43.070174.001125. PMID 4368906. S2CID 44727052.
- ^ Dautzenberg FM, Hauger RL (únor 2002). „Rodina peptidů CRF a jejich receptory: objeveno ještě více partnerů“. Trends Pharmacol. Sci. 23 (2): 71–7. doi:10.1016 / S0165-6147 (02) 01946-6. PMID 11830263.
- ^ Rivière S, Challet L, Fluegge D, Spehr M, Rodriguez I (květen 2009). „Formyl peptidové receptory podobné receptorům jsou novou rodinou vomeronasálních chemosenzorů“. Příroda. 459 (7246): 574–7. doi:10.1038 / nature08029. PMID 19387439.
- ^ Rothberg K.G .; Ying Y.S .; Kamen B.A .; Anderson R.G. (1990). „Cholesterol řídí shlukování membránového receptoru ukotveného v glykofosfolipidu pro 5-methyltetrahydrofolát“. The Journal of Cell Biology. 111 (6): 2931–2938. doi:10.1083 / jcb.111.6.2931. PMC 2116385. PMID 2148564.
- ^ Jacobson C .; Côté P.D .; Rossi S.G .; Rotundo R.L .; Carbonetto S. (2001). „Komplex dystroglykanu je nezbytný pro stabilizaci klastrů acetylcholinových receptorů na neuromuskulárních spojích a tvorbu synaptické membrány ve suterénu“. The Journal of Cell Biology. 152 (3): 435–450. doi:10.1083 / jcb.152.3.435. PMC 2195998. PMID 11157973.
- ^ Marujama, Ichiro N. (01.09.2015). „Aktivace transmembránových buněčných povrchových receptorů pomocí společného mechanismu? Rotační model.“"". BioEssays. 37 (9): 959–967. doi:10.1002 / bies.201500041. ISSN 1521-1878. PMC 5054922. PMID 26241732.
- ^ Superrodiny jednoprůchodových transmembránových receptorů v Membranomová databáze
- ^ Superrodiny jednoprůchodových transmembránových proteinových ligandů a regulátorů receptorů v Membranomová databáze
- ^ Ullricha A., Schlessingerb J .; Schlessinger, J (1990). "Transdukce signálu receptory s aktivitou tyrosinkinázy". Buňka. 61 (2): 203–212. doi:10.1016 / 0092-8674 (90) 90801-K. PMID 2158859.
- ^ A b Kenneth B. Storey (1990). Funkční metabolismus. Wiley-IEEE. str. 87–94. ISBN 978-0-471-41090-4.
- ^ Hille B. (2001). Iontové kanály dráždivých membrán. Sunderland, Massachusetts. ISBN 978-0-87893-321-1.
- ^ Miyazawa A .; Fujiyoshi Y .; Unwin N. (2003). "Struktura a hradlovací mechanismus póru acetylcholinového receptoru". Příroda. 423 (6943): 949–955. doi:10.1038 / nature01748. PMID 12827192.
- ^ Akabas M.H .; Stauffer D.A .; Xu M .; Karlin A. (1992). "Struktura kanálu acetylcholinového receptoru sondovaná v cysteinových substitučních mutantech". Věda. 258 (5080): 307–310. doi:10.1126 / science.1384130. PMID 1384130.
- ^ King N, Hittinger CT, Carroll SB (2003). "Vývoj klíčových buněčných signálních a adhezivních rodin proteinů předchází zvířecímu původu". Věda. 301 (5631): 361–3. doi:10.1126 / science.1083853. PMID 12869759.
- ^ Filmore, David (2004). „Je to svět GPCR“. Moderní objev drog. 2004 (Listopad): 24–28.
- ^ Gilman A.G. (1987). „G proteiny: převodníky signálů generovaných receptory“. Roční přehled biochemie. 56: 615–649. doi:10.1146 / annurev.bi.56.070187.003151. PMID 3113327. S2CID 33992382.
- ^ Müller-Pillascha F .; Wallrappa C .; Lachera U .; Friessb H .; Büchlerb M .; Adlera G .; Gress T. M. (1998). "Identifikace nového antigenu spojeného s nádorem TM4SF5 a jeho exprese v lidské rakovině". Gen. 208 (1): 25–30. doi:10.1016 / S0378-1119 (97) 00633-1. PMID 9479038.
- ^ Scheuer K .; Marasb A .; Gattazb W.F .; Cairnsc N .; Förstlb H .; Müller W.E. (1996). „Kortikální vlastnosti NMDA receptoru a tekutost membrány se u Alzheimerovy choroby mění“. Demence. 7 (4): 210–214. doi:10.1159/000106881. PMID 8835885.
- ^ Wang R .; Gao Y .; Lai L. (2000). „LigBuilder: Víceúčelový program pro konstrukční návrh léků“. Journal of Molecular Modeling. 6 (7–8): 498–516. doi:10,1007 / s0089400060498.
- ^ Schneider G .; Fechner U. (2005). "Počítačový design novinek molekul podobných lékům". Recenze přírody Objev drog. 4 (8): 649–663. doi:10.1038 / nrd1799. PMID 16056391.
- ^ Jorgensen W.L. (2004). "Mnoho rolí výpočtu při objevování drog". Věda. 303 (5665): 1813–1818. doi:10.1126 / science.1096361. PMID 15031495. S2CID 1307935.
externí odkazy
- Databáze IUPHAR GPCR
- Buňky + povrch + receptory v americké národní lékařské knihovně Lékařské předměty (Pletivo)

