Sirotový receptor alfa související s RAR - RAR-related orphan receptor alpha
Sirotový receptor alfa související s RAR (RORα), také známý jako NR1F1 (podrodina jaderného receptoru 1, skupina F, člen 1) je a jaderný receptor že u lidí je kódován RORA gen.[5] RORα se podílí na transkripční regulaci některých zapojených genů cirkadiánní rytmus.[6] U myší je RORα nezbytný pro vývoj mozečku[7][8] přímou regulací genů exprimovaných v Purkyňových buňkách.[9] Hraje také zásadní roli ve vývoji vrozených lymfoidních buněk typu 2 (ILC2) a mutantní zvířata mají nedostatek ILC2.[10][11] Navíc, i když jsou přítomny v normálním počtu, buňky ILC3 a Th17 z myší s deficitem RORa jsou defektní z hlediska produkce cytokinů.[12]
Objev
První tři lidské izoformy RORα byly zpočátku naklonovaný a charakterizovány jako jaderné receptory v roce 1994 Giguèrem a kolegy, kdy byla poprvé studována jejich struktura a funkce.[13]
Na počátku dvacátých let různé studie prokázaly, že RORα zobrazuje rytmické vzorce exprese v cirkadiánním cyklu v játra, ledviny, sítnice, a plíce.[14] Zajímavé bylo, že v této době bylo zjištěno, že hojnost RORα je u savců cirkadiánní suprachiasmatické jádro.[15] RORα je pro normální stav nezbytný cirkadiánní rytmy v myši,[16] demonstrovat svůj význam v chronobiologie.
Struktura
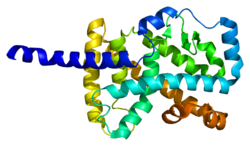
Protein kódovaný tímto genem je členem podrodiny NR1 nukleárních hormonálních receptorů.[16] U lidí 4 izoformy byly identifikovány RORα, které jsou generovány alternativou sestřih a promotér použití a vykazují odlišnou expresi specifickou pro tkáň. The protein struktura RORα se skládá ze čtyř kanonických funkčních skupin: an N-terminál (A / B) doména, a DNA -vazba doména obsahující dva zinkové prsty, pantová doména a C-terminál ligand -vázací doména. V rámci rodiny ROR je doména vázající DNA vysoce konzervovaná a doména vázající ligand je konzervována pouze mírně.[14] Různé izoformy RORα mají různé vazebné specificity a síly transkripční aktivita.[5]
Regulace cirkadiánního rytmu
Jádro savčí cirkadiánní hodiny jsou negativní zpětná vazba smyčka, která se skládá z Per1 / Per2, Cry1 / Cry2, Bmal1, a Hodiny.[15] Tato zpětnovazební smyčka je stabilizována další smyčkou zahrnující transkripční regulaci Bmal1.[17] Transaktivace z Bmal1 je regulován prostřednictvím upstream ROR / REV-ERB Prvek odpovědi (RRE) v Bmal1 promotor, kterému RORα a REV-ERBα svázat.[17] Tato stabilizační regulační smyčka je sama o sobě indukována Bmal1 / Clock heterodimer, který indukuje transkripci RORα a REV-ERBα.[15] RORα, který aktivuje transkripci Bmal1a REV-ERBα, který potlačuje transkripci Bmal1, soutěžit o vazbu na RRE.[17] Tato zpětnovazební smyčka regulující výraz Bmal1 Předpokládá se, že stabilizuje mechanismus hodin jádra a pomáhá jej tlumit proti změnám v životní prostředí.[17]
Mechanismus
Specifická asociace s prvky ROR (RORE) v regulačních oblastech je nezbytná pro funkci RORα jako transkripčního aktivátoru.[18] RORα toho dosahuje specifickou vazbou na konsensuální základní motiv v RORE, RGGTCA. Tato interakce je možná spojením prvního zinkového prstu RORα s motivem jádra v hlavní drážce, P-boxu, a spojením jeho C-terminálního prodloužení s oblastí bohatou na AT v 5 'oblasti RORE.[16]
Homologie
RORα, RORβ, a RORγ jsou transkripční aktivátory rozpoznávající prvky ROR-odezvy.[19] ROR-alfa je exprimován v různých typech buněk a podílí se na regulaci několika aspektů vývoje, zánětlivé odpovědi a lymfocytů rozvoj.[20] Izoformy RORa (RORa1 až RORa3) vznikají alternativním zpracováním RNA, přičemž RORa2 a RORa3 sdílejí amino-koncovou oblast odlišnou od RORa1.[5] Na rozdíl od RORα je RORβ exprimován v Centrální nervový systém (CNS) tkáně zapojené do zpracování senzorických informací a do generování cirkadiánní rytmy zatímco RORγ je v lymfatická uzlina organogeneze a thymopoeisis.[20]
DNA vázající domény DHR3 osiřelého receptoru v Drosophila ukazuje obzvláště blízko homologie v rámci amino a karboxy regiony sousedící s druhou oblastí zinkových prstů v RORα, což naznačuje, že tato skupina zbytky je důležitý pro funkčnost proteinů.[5]
PDP1 a VRI v Drosophila regulují cirkadiánní rytmy soutěžící o stejné vazebné místo, VP box, podobně jako ROR a REV-ERB se kompetitivně vážou na RRE.[17] PDP1 a VRI tvoří a zpětnovazební smyčka a jsou funkční homology ROR a REV-ERB u savců.[17]
Přímé ortology tohoto genu byly identifikovány u myší a lidí.
Člověk cytochrom c pseudogen HC2 a RORα sdílejí překrývající se genomovou organizaci s HC2 pseudogenem umístěným v transkripční jednotce RORα2. Nukleotidové a odvozené aminokyselinové sekvence pseudogenu zpracovaného cytochromem c jsou na smysl vlákno, zatímco ty z RORa2 amino-terminálního exonu jsou na antisense vláknu.[5]
Interakce
- DNA: RORα se váže na P-box RORE.[16]
- Společné aktivátory:
- Ubikvitinace: RORα je zaměřen na proteazom ubikvitinací. A spolurepresor „Hairless“ stabilizuje RORα tím, že jej chrání před tímto procesem, který také potlačuje RORα.[21]
- Sumoylace: UBE21 / UBC9: Ubiquitin-konjugující enzym I interaguje s ROR, ale jeho účinek dosud není znám.[16]
- Fosforylace:
- Fosforylace RORal, která inhibuje jeho transkripční aktivitu, je vyvolána Protein kináza C..[14]
- ERK2: Mimobuněčný signálně regulovaná kináza-2 také fosforyluje RORa.[22]
- ATXN1: ATXN1 a RORα tvoří součást proteinového komplexu v Purkyňovy buňky.[16]
- FOXP3: FOXP3 přímo potlačuje transkripční aktivitu ROR.[16]
- NME1: Ukázalo se, že ROR specificky interaguje s NME1.[23]
- NM23-2: NM23-2 je nukleosiddifosfát kináza podílí se na organogenezi a diferenciaci.[6]
- NM23-1: NM23-1 je produkt nádoru supresor metastáz kandidátský gen.[6]
Jako drogový cíl
Protože RORα a REV-ERBα jsou jaderné receptory, které sdílejí stejné cílové geny a podílejí se na procesech, které regulují metabolismus, rozvoj, imunita a cirkadiánní rytmus, ukazují potenciál jako drogové cíle. Syntetické ligandy mají řadu potenciálních terapeutických použití a lze je použít k léčbě nemocí, jako jsou cukrovka, ateroskleróza, autoimunita, a rakovina. Bylo zjištěno, že T0901317 a SR1001, dva syntetické ligandy, jsou RORa a RORγ inverzní agonisté které potlačují zpravodaj aktivita a bylo prokázáno, že oddalují nástup a klinickou závažnost roztroušená skleróza a další Čt17 buněčně zprostředkovaná autoimunitní onemocnění. SR1078 byl objeven jako agonista RORα a RORγ, který zvyšuje expresi G6PC a FGF21 a poskytuje terapeutický potenciál k léčbě obezita a cukrovka stejně jako rakovina prsa, vaječníky, a prostata. SR3335 byl také objeven jako inverzní agonista RORα.[13]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000069667 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000032238 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d E Giguère V, Tini M, Flock G, Ong E, Evans RM, Otulakowski G (březen 1994). „Amino-koncové domény specifické pro izoformu diktují DNA-vazebné vlastnosti ROR alfa, nové rodiny jaderných receptorů osiřelých hormonů“. Geny a vývoj. 8 (5): 538–53. doi:10,1101 / gad.8.5.538. PMID 7926749.
- ^ A b C „Entrez Gene: RORA RAR related orphan receptor A“.
- ^ Sidman RL, Lane PW, Dickie MM (srpen 1962). „Staggerer, nová mutace myši ovlivňující mozeček“. Věda. 137 (3530): 610–2. Bibcode:1962Sci ... 137..610S. doi:10.1126 / science.137.3530.610. PMID 13912552. S2CID 30733570.
- ^ Hamilton BA, Frankel WN, Kerrebrock AW, Hawkins TL, FitzHugh W, Kusumi K, Russell LB, Mueller KL, van Berkel V, Birren BW, Kruglyak L, Lander ES (únor 1996). "Narušení jaderného hormonálního receptoru RORalfa u potácejících se myší". Příroda. 379 (6567): 736–9. Bibcode:1996 Natur.379..736H. doi:10.1038 / 379736a0. PMID 8602221. S2CID 4318427.
- ^ Gold DA, Baek SH, Schork NJ, Rose DW, Larsen DD, Sachs BD, Rosenfeld MG, Hamilton BA (prosinec 2003). „RORalpha koordinuje vzájemnou signalizaci ve vývoji mozečku pomocí sonických ježků a drah závislých na vápníku“. Neuron. 40 (6): 1119–31. doi:10.1016 / s0896-6273 (03) 00769-4. PMC 2717708. PMID 14687547.
- ^ Halim TY, MacLaren A, rumunský MT, Gold MJ, McNagny KM, Takei F (září 2012). „Sirotčí jaderný receptor související s kyselinou retinovou je nutný pro přirozený vývoj pomocných buněk a alergický zánět“. Imunita. 37 (3): 463–74. doi:10.1016 / j.immuni.2012.06.012. PMID 22981535.
- ^ Gold MJ, Antignano F, Halim TY, Hirota JA, Blanchet MR, Zaph C, Takei F, McNagny KM (duben 2014). „Vrozené lymfoidní buňky skupiny 2 usnadňují senzibilizaci na lokální, ale nikoli systémovou expozici alergenům indukujícím TH2“. The Journal of Allergy and Clinical Immunology. 133 (4): 1142–8. doi:10.1016 / j.jaci.2014.02.033. PMID 24679471.
- ^ Lo BC, Gold MJ, Hughes MR, Antignano F, Valdez Y, Zaph C, Harder KW, McNagny KM (2. září 2016). „Sirotčí jaderný receptor RORα a vrozené lymfoidní buňky 3. skupiny řídí fibrózu u myšího modelu Crohnovy choroby“. Vědecká imunologie. 1 (3): eaaf8864. doi:10.1126 / sciimmunol.aaf8864. PMC 5489332. PMID 28670633.
- ^ A b Kojetin DJ, Burris TP (březen 2014). „Jaderné receptory REV-ERB a ROR jako lékové cíle“. Recenze přírody. Objev drog. 13 (3): 197–216. doi:10.1038 / nrd4100. PMC 4865262. PMID 24577401.
- ^ A b C d E Jetten AM, Kurebayashi S, Ueda E (2001). „Podrodina jaderných osiřelých receptorů ROR: kritické regulátory mnoha biologických procesů“. Pokrok ve výzkumu nukleových kyselin a molekulární biologie. 69: 205–47. doi:10.1016 / S0079-6603 (01) 69048-2. ISBN 9780125400695. PMID 11550795.
- ^ A b C Ko CH, Takahashi JS (říjen 2006). „Molekulární složky cirkadiánních hodin savců“. Lidská molekulární genetika. 15 specifikace č. 2 (2): R271-7. doi:10,1093 / hmg / ddl207. PMID 16987893.
- ^ A b C d E F Emery P, Reppert SM (srpen 2004). "Rytmický Ror". Neuron. 43 (4): 443–6. doi:10.1016 / j.neuron.2004.08.009. PMID 15312644.
- ^ Laitinen S, Staels B (2003). „Potenciální role ROR-alfa v kardiovaskulární endokrinologii“. Signalizace jaderného receptoru. 1: e011. doi:10.1621 / nrs.01011. PMC 1402228. PMID 16604183.
- ^ Zhao X, Cho H, Yu RT, Atkins AR, Downes M, Evans RM (květen 2014). „Jaderné receptory kolují nepřetržitě“. Zprávy EMBO. 15 (5): 518–28. doi:10.1002 / embr.201338271. PMC 4210094. PMID 24737872.
- ^ A b Du J, Huang C, Zhou B, Ziegler SF (duben 2008). "Isoformově specifická inhibice transkripční aktivace zprostředkované ROR alfa lidským FOXP3". Journal of Immunology. 180 (7): 4785–92. doi:10,4049 / jimmunol.180.7.4785. PMID 18354202.
- ^ Xiong G, Wang C, Evers BM, Zhou BP, Xu R (duben 2012). „RORα potlačuje invazi nádoru prsu indukcí exprese SEMA3F“. Výzkum rakoviny. 72 (7): 1728–39. doi:10.1158 / 0008-5472.CAN-11-2762. PMC 3319846. PMID 22350413.
- ^ Paravicini G, Steinmayr M, André E, Becker-André M (říjen 1996). „Kandidát potlačující metastázy nukleotid difosfátkináza NM23 specificky interaguje s členy podrodiny jaderných osiřelých receptorů ROR / RZR“. Komunikace pro biochemický a biofyzikální výzkum. 227 (1): 82–7. doi:10.1006 / bbrc.1996.1471. PMID 8858107.
Další čtení
- Giguère V, Beatty B, Squire J, Copeland NG, Jenkins NA (srpen 1995). „Sirotčí jaderný receptor ROR alfa (RORA) se mapuje na konzervovanou oblast homologie na lidském chromozomu 15q21-q22 a myším chromozomu 9“. Genomika. 28 (3): 596–8. doi:10.1006 / geno.1995.1197. PMID 7490103.
- Steinhilber D, Brungs M, Werz O, Wiesenberg I, Danielsson C, Kahlen JP, Nayeri S, Schräder M, Carlberg C (březen 1995). „Jaderný receptor pro melatonin potlačuje expresi genu 5-lipoxygenázy v lidských B lymfocytech“. The Journal of Biological Chemistry. 270 (13): 7037–40. doi:10.1074 / jbc.270.13.7037. PMID 7706239.
- Forman BM, Chen J, Blumberg B, Kliewer SA, Henshaw R, Ong ES, Evans RM (září 1994). „Cross-talk between ROR alpha 1 and the Rev-erb family of orphan nuclear receptors“. Molekulární endokrinologie. 8 (9): 1253–61. doi:10.1210 / me.8.9.1253. PMID 7838158.
- Becker-André M, André E, DeLamarter JF (srpen 1993). "Identifikace nukleárních receptorových mRNA pomocí RT-PCR amplifikace konzervovaných sekvencí motivů zinkových prstů". Komunikace pro biochemický a biofyzikální výzkum. 194 (3): 1371–9. doi:10.1006 / bbrc.1993.1976. PMID 7916608.
- Carlberg C, Hooft van Huijsduijnen R, Staple JK, DeLamarter JF, Becker-André M (červen 1994). „RZRs, new family of retinoid-related orphan receptors that function as both monomers and homodimers“. Molekulární endokrinologie. 8 (6): 757–70. doi:10.1210 / me.8.6.757. PMID 7935491.
- Paravicini G, Steinmayr M, André E, Becker-André M (říjen 1996). „Kandidát potlačující metastázy nukleotid difosfátkináza NM23 specificky interaguje s členy podrodiny jaderných osiřelých receptorů ROR / RZR“. Komunikace pro biochemický a biofyzikální výzkum. 227 (1): 82–7. doi:10.1006 / bbrc.1996.1471. PMID 8858107.
- Lau P, Bailey P, Dowhan DH, Muscat GE (leden 1999). „Exogenní exprese dominantního negativního vektoru RORalpha1 ve svalových buňkách narušuje diferenciaci: RORalpha1 přímo interaguje s p300 a myoD“. Výzkum nukleových kyselin. 27 (2): 411–20. doi:10.1093 / nar / 27.2.411. PMC 148194. PMID 9862959.
- Atkins GB, Hu X, Guenther MG, Rachez C, Freedman LP, Lazar MA (září 1999). "Koaktivátory pro osiřelý jaderný receptor RORalpha". Molekulární endokrinologie. 13 (9): 1550–7. doi:10.1210 / mě. 13.9.1550. PMID 10478845.
- Meyer T, Kneissel M, Mariani J, Fournier B (srpen 2000). „In vitro a in vivo důkazy o funkci RORalfa pro osiřelý jaderný receptor v kostním metabolismu“. Sborník Národní akademie věd Spojených států amerických. 97 (16): 9197–202. Bibcode:2000PNAS ... 97,9197 mil. doi:10.1073 / pnas.150246097. PMC 16845. PMID 10900268.
- Gawlas K, Stunnenberg HG (prosinec 2000). „Diferenciální vazebné a transkripční chování dvou vysoce příbuzných osiřelých receptorů, ROR alfa (4) a ROR beta (1)“. Biochimica et Biophysica Acta. 1494 (3): 236–41. doi:10.1016 / s0167-4781 (00) 00237-2. PMID 11121580.
- Delerive P, Chin WW, Suen CS (září 2002). "Identifikace Reverb (alfa) jako nového cílového genu ROR (alfa)". The Journal of Biological Chemistry. 277 (38): 35013–8. doi:10,1074 / jbc.M202979200. PMID 12114512.
- Moretti RM, Montagnani Marelli M, Motta M, Limonta P (2003). „Role osiřelého jaderného receptoru ROR alfa při kontrole metastatického chování androgen-nezávislých buněk rakoviny prostaty“. Zprávy o onkologii. 9 (5): 1139–43. doi:10,3892 / nebo 9.5.1139. PMID 12168086.
- Raspè E, Mautino G, Duval C, Fontaine C, Duez H, Barbier O, Monte D, Fruchart J, Fruchart JC, Staels B (prosinec 2002). „Transkripční regulace exprese lidského genu Rev-erbalpha sirotkovým receptorem alfa-sirupu souvisejícím s kyselinou retinovou“. The Journal of Biological Chemistry. 277 (51): 49275–81. doi:10,1074 / jbc.M206215200. PMID 12377782.
- Kallen J, Schlaeppi JM, Bitsch F, Delhon I, Fournier B (duben 2004). „Krystalová struktura lidské vazebné domény RORalpha Ligand v komplexu s síranem cholesterolu při 2,2 A“. The Journal of Biological Chemistry. 279 (14): 14033–8. doi:10,1074 / jbc.M400302200. PMID 14722075.
- Migita H, Satozawa N, Lin JH, Morser J, Kawai K (leden 2004). „RORalpha1 a RORalpha4 potlačují expresi VCAM-1 a ICAM-1 indukovanou TNF-alfa v lidských endoteliálních buňkách“. FEBS Dopisy. 557 (1–3): 269–74. doi:10.1016 / S0014-5793 (03) 01502-3. PMID 14741380. S2CID 24388280.
- Miki N, Ikuta M, Matsui T (duben 2004). „Hypoxií indukovaná aktivace genu alfa4 receptoru pro vzácná onemocnění související s receptorem kyseliny retinové interakcí mezi hypoxií indukovatelným faktorem-1 a Sp1“. The Journal of Biological Chemistry. 279 (15): 15025–31. doi:10,1074 / jbc.M313186200. PMID 14742449.
- Migita H, Morser J, Kawai K (březen 2004). „Rev-erbalpha zvyšuje hladinu NF-kappaB reagujících genů v buňkách hladkého svalstva cév“. FEBS Dopisy. 561 (1–3): 69–74. doi:10.1016 / S0014-5793 (04) 00118-8. PMID 15013753. S2CID 84456190.
externí odkazy
- sirotek + jaderný + receptor + ROR-gama v americké národní lékařské knihovně Lékařské předměty (Pletivo)