Spektroskopie nukleární magnetické rezonance proteinů - Nuclear magnetic resonance spectroscopy of proteins
Spektroskopie nukleární magnetické rezonance proteinů (obvykle zkráceno proteinová NMR) je pole strukturní biologie ve kterém NMR spektroskopie se používá k získání informací o struktuře a dynamice bílkoviny, a také nukleové kyseliny a jejich komplexy. Pole bylo průkopníkem Richard R. Ernst a Kurt Wüthrich na ETH,[1] a tím Ad Bax, Marius Clore, Angela Gronenborn na NIH,[2], a Gerhard Wagner na Harvardská Univerzita, mezi ostatními. Stanovení struktury pomocí NMR spektroskopie obvykle sestává z několika fází, z nichž každá používá samostatnou sadu vysoce specializovaných technik. Připraví se vzorek, provede se měření, použijí se interpretační přístupy a vypočte se a ověří struktura.
NMR zahrnuje kvantově mechanické vlastnosti centrálního jádra ("jádro ") atomu. Tyto vlastnosti závisí na místním molekulárním prostředí a jejich měření poskytuje mapu toho, jak jsou atomy chemicky spojeny, jak blízko jsou v prostoru a jak rychle se navzájem pohybují. Tyto vlastnosti jsou v zásadě stejné jako u známých zobrazování magnetickou rezonancí (MRI), ale molekulární aplikace používají poněkud odlišný přístup, vhodný pro změnu měřítka z milimetrů (zajímavých pro radiology) na nanometry (vázané atomy jsou obvykle zlomkem nanometru od sebe), což je faktor milionu. Tato změna měřítka vyžaduje pro dlouhodobé měření mnohem vyšší citlivost detekce a stability. Na rozdíl od MRI strukturní biologické studie negenerují přímo obraz, ale spoléhají se na složité počítačové výpočty pro generování trojrozměrných molekulárních modelů.
V současné době se většina vzorků zkoumá v roztoku ve vodě, ale vyvíjejí se metody také pro práci s pevnými vzorky. Sběr dat závisí na umístění vzorku do silného magnetu, odesílání vysokofrekvenčních signálů skrz vzorek a měření absorpce těchto signálů. V závislosti na prostředí atomů v proteinu budou jádra jednotlivých atomů absorbovat různé frekvence rádiových signálů. Kromě toho mohou být absorpční signály různých jader rušeny sousedními jádry. Tato informace může být použita k určení vzdálenosti mezi jádry. Tyto vzdálenosti lze zase použít k určení celkové struktury proteinu.
Typická studie může zahrnovat to, jak dva proteiny interagují navzájem, pravděpodobně s cílem vyvinout malé molekuly, které lze použít ke zkoumání normální biologie interakce ("chemická biologie „) nebo poskytnout možné vodiče pro farmaceutické použití (vývoj léků ). Interagující pár proteinů mohl být často identifikován studiemi lidské genetiky, což naznačuje, že interakce může být narušena nepříznivými mutacemi, nebo mohou hrát klíčovou roli v normální biologii „modelového“ organismu, jako je ovocná muška, kvasnice , červ C. elegans nebo myši. K přípravě vzorku se obvykle používají metody molekulární biologie k vytváření množství pomocí bakteriální fermentace. To také umožňuje změnu izotopové složení molekuly, což je žádoucí, protože izotopy se chovají odlišně a poskytují metody pro identifikaci překrývajících se NMR signálů.
příprava vzorků

Proteinová nukleární magnetická rezonance se provádí na vodných vzorcích vysoce očištěno protein. Obvykle se vzorek skládá z 300 až 600 mikrolitrů s koncentrací proteinu v rozmezí 0,1 - 3 milimolární. Zdroj proteinu může být buď přírodní, nebo produkovaný v a produkční systém použitím rekombinantní DNA techniky genetické inženýrství. Rekombinačně vyjádřený bílkoviny se obvykle snáze produkují v dostatečném množství a tato metoda umožňuje izotopový Značení možný.
Vyčištěný protein je obvykle rozpuštěn v a pufrovací roztok a upraví se na požadované podmínky rozpouštědla. Vzorek NMR se připraví ve tenkostěnném skle trubka.
Sběr dat
Proteinová NMR využívá vícerozměrné experimenty s nukleární magnetickou rezonancí k získání informací o proteinu. V ideálním případě každé odlišné jádro v molekule zažívá odlišné elektronické prostředí, a proto má odlišné chemický posun podle kterého jej lze rozpoznat. Ve velkých molekulách, jako jsou proteiny, však může být počet rezonancí obvykle několik tisíc a jednorozměrné spektrum má nevyhnutelně náhodné přesahy. Proto se provádějí vícerozměrné experimenty, které korelují frekvence odlišných jader. Další dimenze snižují pravděpodobnost překrytí a mají větší informační obsah, protože korelují signály z jader v určité části molekuly. Magnetizace se přenáší do vzorku pomocí elektromagnetických pulzů (rádiová frekvence ) energie a mezi jádry pomocí zpoždění; proces je popsán tzv pulzní sekvence. Impulsní sekvence umožňují experimentátorovi vyšetřit a vybrat konkrétní typy spojení mezi jádry. Pole experimentů nukleární magnetické rezonance používané na proteinech spadá do dvou hlavních kategorií - jedné, kde je magnetizace přenášena chemickými vazbami, a jedné, kde je přenos prováděn prostorem, bez ohledu na strukturu vazby. První kategorie slouží k přiřazení různých chemické směny do konkrétního jádra a druhá se primárně používá ke generování omezení vzdálenosti použitých při výpočtu struktury a při přiřazení neznačeného proteinu.
V závislosti na koncentraci vzorku, na magnetickém poli spektrometru a na typu experimentu může jeden multidimenzionální experiment s nukleární magnetickou rezonancí na vzorku proteinu trvat hodiny nebo dokonce několik dní, než se získá vhodný poměr signálu k šumu průměrováním signálu a umožnit dostatečný vývoj přenosu magnetizace v různých dimenzích experimentu. Za jiných podmínek budou experimenty s vyšší dimenzí trvat déle než experimenty s nižší dimenzí.
Typicky je prvním experimentem, který se měří s izotopem značeným proteinem, 2D heteronukleární jednoduchá kvantová korelace (HSQC) spektrum, kde „heteronukleární“ označuje jiná jádra než 1H. Teoreticky má heteronukleární jednoduchá kvantová korelace jeden vrchol pro každý H vázaný na heteronukleus. V 15N-HSQC tedy s a 15N značený protein, se očekává jeden signál pro každý atom dusíku v zadní kosti, s výjimkou prolin, který nemá žádný amid-vodík kvůli cyklické povaze svého hlavního řetězce. K dalším signálům 15N-HSQC přispívá každý zbytek vazbou dusík-vodík ve svém postranním řetězci (W, N, Q, R, H, K). 15N-HSQC se často označuje jako otisk prstu proteinu, protože každý protein má jedinečný vzor signálních pozic. Analýza 15N-HSQC umožňuje vědcům vyhodnotit, zda je přítomen očekávaný počet vrcholů, a identifikovat tak možné problémy způsobené konformace nebo heterogenita vzorku. Relativně rychlý heteronukleární experiment s jednou kvantovou korelací pomáhá určit proveditelnost následných delších, dražších a komplikovanějších experimentů. Není možné přiřadit píky konkrétním atomům pouze z heteronukleární jediné kvantové korelace.
Přiřazení rezonance
Abychom mohli analyzovat data nukleární magnetické rezonance, je důležité získat přiřazení rezonance pro protein, tj. Zjistit, které chemický posun odpovídá kterému atomu. Toho je obvykle dosaženo postupná chůze pomocí informací získaných z několika různých typů NMR experimentů. Přesný postup závisí na tom, zda protein je izotopově značeno nebo ne, protože mnoho experimentů s přiřazením závisí na uhlíku-13 a dusíku-15.
Homonukleární nukleární magnetická rezonance
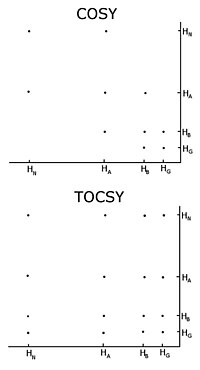
U neznačeného proteinu je obvyklým postupem záznam sady dvourozměrných homonukleárních nukleárních magnetických rezonančních experimentů korelační spektroskopie (COZY), z nichž několik typů zahrnuje konvenční korelační spektroskopii, celková korelace spektroskopie (TOCSY) a jaderný Overhauserův efekt spektroskopie (NOESY).[3][4] Dvourozměrný experiment nukleární magnetické rezonance vytváří dvourozměrné spektrum. Jednotkami obou os jsou chemické posuny. COZY a TOCSY přenášejí magnetizaci chemickými vazbami mezi sousedními protony. Konvenční experiment s korelační spektroskopií je schopen přenášet pouze magnetizaci mezi protony na sousední atomy, zatímco v experimentu s celkovou korelační spektroskopií jsou protony schopné přenášet magnetizaci, takže se přenáší mezi všemi protony, které jsou spojeny sousedními atomy. V konvenční korelační spektroskopii tedy alfa proton přenáší magnetizaci na beta protony, beta protony se přenáší na alfa a gama protony, pokud jsou přítomny, pak se gama proton přenáší na beta a delta protony a proces pokračuje . V celkové korelační spektroskopii jsou alfa a všechny ostatní protony schopné přenést magnetizaci na beta, gama, delta, epsilon, pokud jsou spojeny souvislým řetězcem protonů. Kontinuální řetězec protonů je postranní řetězec jednotlivce aminokyseliny. Tyto dva experimenty se tedy používají k vytvoření takzvaných spinových systémů, tedy sestavení seznamu rezonancí chemického posunu peptidového protonu, alfa protonů a všech protonů z každého zbytek Postranní řetězec. Které chemické posuny odpovídají kterým jádrům ve spinovém systému, je určeno konvenčními korelačními spektroskopickými spojitostmi a skutečností, že různé typy protonů mají charakteristické chemické posuny. Pro připojení různých spinsystémů v postupném pořadí je nutné použít experiment s nukleární Overhauserovou efektovou spektroskopií. Vzhledem k tomu, že tento experiment přenáší magnetizaci prostorem, ukáže křížové projevy pro všechny protony, které jsou v prostoru blízko, bez ohledu na to, zda jsou ve stejném spinovém systému nebo ne. Sousední zbytky jsou ze své podstaty blízké v prostoru, takže přiřazení lze provádět pomocí vrcholů v NOESY s jinými spinovými systémy.
Jedním důležitým problémem používání homonukleární nukleární magnetické rezonance je překrývání mezi vrcholy. K tomu dochází, když různé protony mají stejné nebo velmi podobné chemické posuny. Tento problém se zvětšuje, jak se protein zvětšuje, takže homonukleární nukleární magnetická rezonance je obvykle omezena na malé proteiny nebo peptidy.
Nitrogen-15 nukleární magnetická rezonance
Nejčastěji prováděným 15N experimentem je 1H-15N HSQC. Experiment je vysoce citlivý, a proto jej lze provést relativně rychle. Často se používá ke kontrole vhodnosti proteinu pro stanovení struktury pomocí NMR, jakož i pro optimalizaci podmínek vzorku. Je to jeden ze standardního souboru experimentů používaných pro stanovení struktury roztoku proteinu. HSQC lze dále rozšířit na trojrozměrné a čtyřrozměrné NMR experimenty, jako je například 15N-TOCSY-HSQC a 15N-NOESY-HSQC.[5]

Uhlík-13 a dusík-15 nukleární magnetická rezonance
Když je protein označen uhlíkem-13 a dusíkem-15, je možné zaznamenávat experimenty s trojitou rezonancí které přenášejí magnetizaci přes peptidovou vazbu, a tak spojují různé spinové systémy prostřednictvím vazeb.[6][7] To se obvykle provádí pomocí některých z následujících experimentů, HNCO, HN (CA) CO, HNCA,[8] HN (CO) CA., HNCACB a CBCA (CO) NH. Všech šest experimentů sestává z a 1H-15N rovina (podobná spektru HSQC) expandovala s uhlíkovou dimenzí. V HN (CA) CO každý HN rovina obsahuje vrcholy z karbonylového uhlíku ze zbytku a také předchozí v pořadí. HNCO obsahuje chemický posun karbonylového uhlíku pouze z předchozího zbytku, ale je mnohem citlivější než HN (CA) CO. Tyto experimenty umožňují každý 1H-15Vrchol N, který má být spojen s předchozím karbonylovým uhlíkem, a postupné přiřazení lze poté provést porovnáním posunů vlastních a předchozích uhlíků každého systému rotace. HNCA a HN (CO) CA fungují podobně, jen s alfa uhlíky (C.α) spíše než karbonyly a HNCACB a CBCA (CO) NH obsahují jak alfa uhlík, tak beta uhlík (Cβ). K vyřešení překrytí uhlíkové dimenze je obvykle zapotřebí několik z těchto experimentů. Tento postup je obvykle méně nejednoznačný než metoda založená na NOESY, protože je založena na přenosu vazby. V metodách založených na NOESY se objeví další píky odpovídající atomům, které jsou blízko ve vesmíru, ale které nepatří k sekvenčním zbytkům, což matoucí proces přiřazení. Po počátečním přiřazení sekvenční rezonance je obvykle možné rozšířit přiřazení z Cα a C.β ke zbytku postranního řetězce pomocí experimentů, jako je HCCH-TOCSY, což je v podstatě TOCSY experiment vyřešený v další uhlíkové dimenzi.
Generace zdrženlivosti
Aby bylo možné provádět strukturní výpočty, je třeba vygenerovat řadu experimentálně určených omezení. Ty spadají do různých kategorií; nejpoužívanější jsou omezení vzdálenosti a úhlová omezení.
Omezení vzdálenosti
Crosspeak v a NOESY experiment znamená prostorovou blízkost mezi dvěma dotyčnými jádry. Každý pík lze tedy převést na maximální vzdálenost mezi jádry, obvykle mezi 1,8 a 6 angstromy. Intenzita vrcholu NOESY je úměrná vzdálenosti k mínus 6. síle, takže vzdálenost se určuje podle intenzity vrcholu. Vztah intenzita-vzdálenost není přesný, proto se obvykle používá rozsah vzdálenosti.
Je velmi důležité přiřadit NOESY píky správným jádrům na základě chemických posunů. Pokud se tento úkol provádí ručně, je obvykle velmi pracný, protože proteiny mají obvykle tisíce vrcholů NOESY. Některé počítačové programy, například PASD[9][10]/XPLOR-NIH,[11][12] UNIO,[13] CYANA[14], ÁRIE[15]/CNS[16]a AUDANA[17]/PONDEROSA-C / S[18] na platformě Integrativní NMR[19] proveďte tento úkol automaticky na ručně předem zpracovaných seznamech poloh špiček a objemů špiček spolu s výpočtem struktury. Přímý přístup k nezpracovaným údajům NOESY bez těžkopádné potřeby iterativně rafinovaných seznamů špiček zatím poskytuje pouze PASD[10] algoritmus implementovaný v XPLOR-NIH[11], přístup ATNOS / CANDID implementovaný v softwarovém balíčku UNIO[13]a PONDEROSA-C / S, a tak skutečně zaručuje objektivní a efektivní NOESY spektrální analýzu.
Chcete-li získat co nejpřesnější přiřazení, je velkou výhodou přístup k experimentům NOESY s uhlíkem-13 a dusíkem-15, protože pomáhají vyřešit překrývání protonové dimenze. To vede k rychlejším a spolehlivějším přiřazením a následně k lepším strukturám.
Úhlová omezení
Kromě omezení vzdálenosti, omezení torzních úhlů chemických vazeb, obvykle úhly psi a phi, lze generovat. Jedním z přístupů je použití Karplusova rovnice, vygenerovat úhlová omezení z vazebné konstanty. Jiný přístup používá chemické posuny ke generování úhlových omezení. Obě metody využívají skutečnost, že geometrie kolem alfa uhlíku ovlivňuje vazebné konstanty a chemické posuny, takže vzhledem k vazebním konstantám nebo chemickým posunům lze kvalifikovaně odhadnout torzní úhly.
Orientační omezení

Molekuly analytu ve vzorku lze částečně uspořádat vzhledem k vnějšímu magnetickému poli spektrometru manipulací s podmínkami vzorku. Mezi běžné techniky patří přidání bakteriofágy nebo bicelles na vzorek, nebo příprava vzorku v roztaženém stavu polyakrylamidový gel. Tím se vytvoří místní prostředí, které upřednostňuje určitou orientaci nesférických molekul. Normálně v NMR roztoku jsou dipolární vazby mezi jádry zprůměrovány kvůli rychlému převrácení molekuly. Mírné přelidnění jedné orientace znamená, že a zbytková dipolární vazba zbývá pozorovat. Dipolární vazba se běžně používá v NMR v pevné fázi a poskytuje informace o relativní orientaci vazebných vektorů vzhledem k jedinému globálnímu referenčnímu rámci. Orientace N-H vektoru se typicky zkoumá v experimentu podobném HSQC. Zpočátku byly zbytkové dipolární vazby použity pro zjemnění dříve určených struktur, ale byly také provedeny pokusy o stanovení struktury de novo.[20]
Výměna vodík-deuterium
NMR spektroskopie je specifická pro jádro. Může tedy rozlišovat mezi vodíkem a deuteriem. Amidové protony v proteinu se snadno vyměňují s rozpouštědlem, a pokud rozpouštědlo obsahuje jiný izotop, obvykle deuterium reakce může být monitorována NMR spektroskopií. Jak rychle dané amidové výměny odráží jeho dostupnost rozpouštědla. Amidové směnné kurzy tedy mohou poskytnout informace o tom, které části proteinu jsou pohřbeny, vodíkově vázány atd. Běžnou aplikací je srovnání výměny volné formy s komplexem. Amidy, které se stanou chráněnými v komplexu, se předpokládají v interakčním rozhraní.
Strukturální výpočet
Experimentálně určená omezení lze použít jako vstup pro proces výpočtu struktury. Výzkumníci využívající počítačové programy jako např XPLOR-NIH,[11] CYANA nebo GeNMR pokusit se uspokojit co nejvíce omezení, jak je to možné, kromě obecných vlastností proteinů, jako jsou délky vazeb a úhly. Algoritmy převádějí omezení a obecné vlastnosti bílkovin na energetické výrazy a poté se snaží tuto energii minimalizovat. Výsledkem tohoto procesu je soubor struktur, které, pokud budou data dostatečná k tomu, aby diktují určitý záhyb, budou konvergovat.
Ověření struktury
Je důležité si uvědomit, že soubor získaných struktur je „experimentálním modelem“, tj. Reprezentací určitého druhu experimentálních dat. Uznat tuto skutečnost je opravdu důležité, protože to znamená, že model může být dobrým nebo špatným vyjádřením těchto experimentálních dat.[21] Obecně bude kvalita modelu záviset jak na kvantitě, tak na kvalitě experimentálních dat použitých k jeho generování a na správné interpretaci těchto dat.
Je důležité si uvědomit, že každý experiment má související chyby. Náhodné chyby ovlivní reprodukovatelnost a přesnost výsledných struktur. Pokud jsou chyby systematické, přesnost ovlivněna. Přesnost udává stupeň reprodukovatelnosti měření a je často vyjádřena jako rozptyl souboru měřených dat za stejných podmínek. Přesnost však ukazuje, do jaké míry se měření blíží své „skutečné“ hodnotě.
V ideálním případě bude model bílkoviny přesnější, čím více odpovídá skutečné molekule, která představuje, a bude přesnější, protože existuje menší nejistota ohledně poloh jejich atomů. V praxi neexistuje žádná „standardní molekula“, proti níž by bylo možné porovnávat modely proteinů, takže přesnost modelu je dána mírou shody mezi modelem a souborem experimentálních údajů. Historicky byly struktury určené NMR obecně nižší kvality než struktury stanovené rentgenovou difrakcí. To je částečně způsobeno nižším množstvím informací obsažených v datech získaných pomocí NMR. Kvůli této skutečnosti se stalo běžnou praxí stanovit kvalitu souborů NMR porovnáním s jedinečnou konformací stanovenou rentgenovou difrakcí pro stejný protein. Röntgenová difrakční struktura však nemusí existovat, a protože proteiny v roztoku jsou flexibilní molekuly, může protein představovaný jedinou strukturou vést k podcenění vnitřní variace atomových pozic proteinu. Sada konformací, určená NMR nebo rentgenovou krystalografií, může být lepší reprezentací experimentálních dat proteinu než jedinečná konformace.[22]
Užitečnost modelu bude dána, alespoň zčásti, stupněm přesnosti a přesnosti modelu. Přesný model s relativně špatnou přesností by mohl být užitečný ke studiu evolučních vztahů mezi strukturami sady proteinů, zatímco racionální návrh léku vyžaduje přesné i přesné modely. Model, který není přesný, bez ohledu na stupeň přesnosti, s nímž byl získán, nebude příliš užitečný.[21][23]
Protože proteinové struktury jsou experimentální modely, které mohou obsahovat chyby, je velmi důležité být schopen tyto chyby detekovat. Proces zaměřený na detekci chyb je znám jako validace. Existuje několik metod pro validaci struktur, některé jsou statistické PROCHECK a CO KDYŽ zatímco jiné jsou založeny na fyzikálních principech jako CheShift nebo směs statistických a fyzikálních principů PSVS.
Dynamika
Kromě struktur nukleární magnetická rezonance může poskytnout informace o dynamice různých částí systému protein. To obvykle zahrnuje měření relaxačních časů, jako je T1 a T2 k určení parametrů objednávky, korelačních časů a chemických směnných kurzů. NMR relaxace je důsledkem lokálního kolísání magnetické pole uvnitř molekuly. Místní fluktuující magnetická pole jsou generována molekulárními pohyby. Tímto způsobem mohou měření relaxačních časů poskytovat informace o pohybech v molekule na atomové úrovni. V NMR studiích proteinové dynamiky se dusík-15 izotop je upřednostňovaným jádrem ke studiu, protože jeho relaxační časy jsou relativně jednoduché vzhledem k molekulárním pohybům. To však vyžaduje izotopové značení proteinu. T1 a T2 relaxační časy lze měřit pomocí různých typů HSQC experimenty na základě. Typy pohybů, které lze detekovat, jsou pohyby, které se vyskytují v časovém měřítku od přibližně 10 pikosekund do přibližně 10 nanosekund. Kromě toho lze také studovat pomalejší pohyby, které probíhají v časovém měřítku od přibližně 10 mikrosekund do 100 milisekund. Jelikož se však atomy dusíku nacházejí hlavně v páteři proteinu, výsledky odrážejí hlavně pohyby páteře, která je nejpevnější částí molekuly proteinu. Výsledky získané z dusík-15 relaxační měření nemusí být reprezentativní pro celý protein. Proto techniky využívající relaxační měření uhlík-13 a deuterium Nedávno byly vyvinuty, které umožňují systematické studium pohybů postranních řetězců aminokyselin v proteinech. Náročný a speciální případ studie týkající se dynamiky a flexibility peptidů a proteinů plné délky představují neuspořádané struktury. V dnešní době je uznávaným konceptem, že proteiny mohou vykazovat pružnější chování známé jako porucha nebo nedostatek struktury; je však možné popsat soubor struktur místo statického obrazu představujícího plně funkční stav proteinu. V této oblasti je zastoupeno mnoho pokroků, zejména pokud jde o nové pulzní sekvence, technologické zdokonalení a pečlivé školení výzkumných pracovníků v této oblasti.
NMR spektroskopie na velkých proteinech
Spektroskopie nukleární magnetické rezonance se tradičně omezuje na relativně malé proteiny nebo proteinové domény. To je částečně způsobeno problémy s řešením překrývajících se vrcholů ve větších proteinech, ale to bylo zmírněno zavedením izotopového značení a vícerozměrných experimentů. Dalším závažnějším problémem je skutečnost, že u velkých proteinů se magnetizace uvolňuje rychleji, což znamená, že je méně času na detekci signálu. To zase způsobí, že vrcholy se stanou širšími a slabšími a nakonec zmizí. Ke zmírnění relaxace byly zavedeny dvě techniky: příčná relaxační optimalizovaná spektroskopie (TROSY)[24] a deuterace[25] bílkovin. Použitím těchto technik bylo možné studovat proteiny v komplexu s 900 kDa garde GroES -GroEL.[26]
Automatizace procesu
Stanovení struktury pomocí NMR je tradičně časově náročný proces, který vyžaduje interaktivní analýzu dat vysoce vyškoleným vědcem. Existuje značný zájem o automatizaci procesu za účelem zvýšení propustnosti určování struktury a zpřístupnění proteinové NMR neodborníkům (viz strukturní genomika ). Mezi dva časově nejnáročnější procesy patří přiřazení rezonance specifické pro sekvenci (přiřazení páteře a postranního řetězce) a úkoly přiřazení NOE. Bylo publikováno několik různých počítačových programů, které se automatizovaným způsobem zaměřují na jednotlivé části celkového procesu určování struktury NMR. Největšího pokroku bylo dosaženo u úkolu automatizovaného přiřazování NOE. Doposud byl navržen pouze přístup FLYA a UNIO k provedení celého procesu stanovení struktury proteinové NMR automatizovaným způsobem bez jakéhokoli lidského zásahu.[13][14] V poslední době se moduly v NMRFAM-SPARKY jako APES (dvoupísmenný kód: ae), I-PINE / PINE-SPARKY (dvoupísmenný kód: ep; Webový server I-PINE ) a PONDEROSA (dvoupísmenný kód: c3, nahoru; Webový server PONDEROSA ) jsou integrovány tak, že nabízí plnou automatizaci s možností vizuálního ověření v každém kroku.[27] Bylo také vyvinuto úsilí o standardizaci protokolu výpočtu struktury, aby byl rychlejší a přístupnější automatizaci.[28]
Viz také
- NMR spektroskopie
- Jaderná magnetická rezonance
- Spektroskopie nukleární magnetické rezonance sacharidů
- Spektroskopie nukleárních magnetických rezonancí nukleových kyselin
- Krystalizace bílkovin
- Dynamika proteinů
- Relaxace (NMR)
- Rentgenová krystalografie
Reference
- ^ Wüthrich K (listopad 2001). "Cesta k NMR strukturám proteinů". Přírodní strukturní a molekulární biologie. 8 (11): 923–5. doi:10.1038 / nsb1101-923. PMID 11685234. S2CID 26153265.
- ^ Clore, G. Marius (2011). „Adventures in Biomolecular NMR“ (PDF). Harris, Robin K; Wasylishen, Roderick L (eds.). Encyklopedie magnetické rezonance. John Wiley & Sons. doi:10.1002/9780470034590. hdl:11693/53364. ISBN 9780470034590.
- ^ Wüthrich K (prosinec 1990). "Stanovení struktury proteinů v roztoku pomocí NMR spektroskopie". J. Biol. Chem. 265 (36): 22059–62. PMID 2266107.
- ^ Clore GM, Gronenborn AM (1989). "Stanovení trojrozměrných struktur proteinů a nukleových kyselin v roztoku". CRC kritické recenze v biochemii a molekulární biologii. 24 (5): 479–564. doi:10.3109/10409238909086962. PMID 2676353.
- ^ Clore GM, Gronenborn AM (1991). "Struktury větších proteinů v roztoku: trojrozměrná a čtyřrozměrná heteronukleární NMR spektroskopie". Věda. 252 (5011): 1390–1399. doi:10.1126 / science.2047852. OSTI 83376. PMID 2047852.
- ^ Clore GM, Gronenborn AM (1991). "Aplikace trojrozměrné a čtyřrozměrné heteronukleární NMR spektroskopie pro stanovení proteinové struktury". Pokrok ve spektroskopii nukleární magnetické rezonance. 23 (1): 43–92. doi:10.1016 / 0079-6565 (91) 80002-J.
- ^ Bax A, Grzesiek S (1993). "Metodický pokrok v proteinové NMR". Účty chemického výzkumu. 26 (4): 131–138. doi:10.1021 / ar00028a001.
- ^ Bax A, Ikura M (květen 1991). „Efektivní 3D NMR technika pro korelaci protonových a 15N hlavních amidových rezonancí s alfa-uhlíkem předchozího zbytku v jednotně obohacených proteinech 15N / 13C“. J. Biomol. NMR. 1 (1): 99–104. doi:10.1007 / BF01874573. PMID 1668719. S2CID 20037190.
- ^ Kuszewski J, Schwieters CD, Garrett DS, Byrd RA, Tjandra N, Clore GM (2004). „Zcela automatizované, vysoce tolerantní stanovení makromolekulární struktury z multidimenzionálních vylepšení spektra jaderných Overhauser a přiřazení chemických posunů“. Journal of the American Chemical Society. 126 (20): 6258–6273. doi:10.1021 / ja049786h. PMID 15149223.
- ^ A b Kuszewski J, Thottungal RA, Clore GM, CD Schwieters (2008). „Automatické stanovení makromolekulární struktury odolné vůči chybám z multidimenzionálních vylepšení spekter nukleárních Overhauserů a přiřazení chemických posunů: vylepšená robustnost a výkonnost algoritmu PASD“. Journal of Biomolecular NMR. 41 (4): 221–239. doi:10.1007 / s10858-008-9255-1. PMC 2575051. PMID 18668206.
- ^ A b C Schwieters CD; Kuszewski JJ; Tjandra N; Clore GM (leden 2003). „Balíček pro stanovení molekulární struktury Xplor-NIH NMR“. J. Magn. Reson. 160 (1): 65–73. Bibcode:2003JMagR.160 ... 65S. doi:10.1016 / S1090-7807 (02) 00014-9. PMID 12565051.
- ^ Schwieters, CD; Kuszewski, JJ; Clore, GM (2006). "Použití Xplor-NIH pro stanovení molekulární struktury NMR". Pokrok ve spektroskopii nukleární magnetické rezonance. 48 (1): 47–62. doi:10.1016 / j.pnmrs.2005.10.001.
- ^ A b C Herrmann T (2010). "Výpočet struktury proteinů a automatická omezení NOE". Encyklopedie magnetické rezonance. doi:10.1002 / 9780470034590.emrstm1151. ISBN 978-0470034590.
- ^ A b Güntert P (2004). Msgstr "Automatizovaný výpočet struktury NMR s CYANOU". Techniky proteinové NMR. Methods Mol. Biol. 278. str. 353–78. CiteSeerX 10.1.1.332.4843. doi:10.1385/1-59259-809-9:353. ISBN 978-1-59259-809-0. PMID 15318003.
- ^ Rieping W; Habeck M; Bardiaux B; Bernard A; Malliavin TE; Nilges M (únor 2007). "ARIA2: automatické přiřazení NOE a integrace dat při výpočtu struktury NMR". Bioinformatika. 23 (3): 381–2. doi:10.1093 / bioinformatika / btl589. PMID 17121777.
- ^ Brünger, AT; Adams, PD; Clore, GM; DeLano, WL; Gros, P; Grosse-Kunstleve, RW; Jiang, JS; Kuszewski, J; Nilges, M; Pannu, NS; Číst, RJ; Rýže, LM; Simonson, T; Warren, GL (1. září 1998). „Krystalografie a NMR systém: Nová softwarová sada pro stanovení makromolekulární struktury“. Acta Crystallographica oddíl D. 54 (Pt 5): 905–21. doi:10,1107 / s0907444998003254. PMID 9757107.
- ^ Lee W, Petit CM, Cornilescu G, Stark JL, Markley JL (červen 2016). „Algoritmus AUDANA pro automatické stanovení 3D struktury proteinů z dat NMR NOE“. J. Biomol. NMR. 65 (2): 51–7. doi:10.1007 / s10858-016-0036-r. ISSN 0925-2738. PMC 4921114. PMID 27169728.
- ^ Lee, Woonghee; Stark, Jaime L .; Markley, John L. (01.11.2014). „PONDEROSA-C / S: softwarový balíček typu klient – server pro automatické určování 3D struktury proteinů“. Journal of Biomolecular NMR. 60 (2–3): 73–75. doi:10.1007 / s10858-014-9855-x. ISSN 0925-2738. PMC 4207954. PMID 25190042.
- ^ Lee, Woonghee; Cornilescu, Gabriel; Dashti, Hesam; Eghbalnia, Hamid R .; Tonelli, Marco; Westler, William M .; Butcher, Samuel E .; Henzler-Wildman, Katherine A .; Markley, John L. (2016-04-01). „Integrativní NMR pro biomolekulární výzkum“. Journal of Biomolecular NMR. 64 (4): 307–332. doi:10.1007 / s10858-016-0029-x. ISSN 0925-2738. PMC 4861749. PMID 27023095.
- ^ de Alba E; Tjandra N (2004). Zbytkové dipolární vazby při určování proteinové struktury. Methods Mol. Biol. 278. str. 89–106. doi:10.1385/1-59259-809-9:089. ISBN 978-1-59259-809-0. PMID 15317993.
- ^ A b Laskowski, R. A. (2003). "Strukturální zajištění kvality". Strukturální bioinformatika. Metody biochemické analýzy. 44. str. 273–303. doi:14.1002 / 0471721204.ch14. ISBN 9780471202004. PMID 12647391.
- ^ Arnautova, Y. A .; Vila, J. A .; Martin, O. A .; Scheraga, H. A. (2009). „Co se můžeme naučit výpočtem chemických posunů 13Calpha pro modely rentgenových proteinů?“. Acta Crystallographica oddíl D. 65 (7): 697–703. doi:10.1107 / S0907444909012086. PMC 2703576. PMID 19564690.
- ^ Spronk, C. A .; Nabuurs, S. B .; Krieger, E .; Vriend, G .; Vuister, G. W. (2004). "Ověření proteinových struktur odvozených NMR spektroskopií". Pokrok ve spektroskopii nukleární magnetické rezonance. 45 (3–4): 315–337. doi:10.1016 / j.pnmrs.2004.08.003.
- ^ Pervushin K; Riek R; Širší G; Wüthrich K (listopad 1997). „Oslabená relaxace T2 vzájemným zrušením vazby dipól-dipól a anizotropie chemického posunu naznačuje cestu k NMR strukturám velmi velkých biologických makromolekul v roztoku“. Proc. Natl. Acad. Sci. USA. 94 (23): 12366–71. Bibcode:1997PNAS ... 9412366P. doi:10.1073 / pnas.94.23.12366. PMC 24947. PMID 9356455.
- ^ Markus MA; Dayie KT; Matsudaira P; Wagner G (říjen 1994). „Vliv deuterace na rychlost relaxace amidového protonu v proteinech. Heteronukleární NMR experimenty na villinu 14T“. J Magn Reson B. 105 (2): 192–5. Bibcode:1994JMRB..105..192M. doi:10.1006 / jmrb.1994.1122. PMID 7952934.
- ^ Fiaux J; Bertelsen EB; Horwich AL; Wüthrich K (červenec 2002). "NMR analýza 900K GroEL GroES komplexu". Příroda. 418 (6894): 207–11. doi:10.1038 / nature00860. PMID 12110894. S2CID 2451574.
- ^ Lee, Woonghee; Tonelli, Marco; Markley, John L. (2015-04-15). „NMRFAM-SPARKY: vylepšený software pro biomolekulární NMR spektroskopii“. Bioinformatika. 31 (8): 1325–1327. doi:10.1093 / bioinformatika / btu830. ISSN 1367-4803. PMC 4393527. PMID 25505092.
- ^ Liu G, Shen Y; Atreya HS; et al. (Červenec 2005). „Protokol sběru a analýzy NMR dat pro stanovení struktury proteinu s vysokou propustností“. Proc. Natl. Acad. Sci. USA. 102 (30): 10487–92. Bibcode:2005PNAS..10210487L. doi:10.1073 / pnas.0504338102. PMC 1180791. PMID 16027363.
Další čtení
- T. Kevin Hitchens; Gordon S. Rule (2005). Základy proteinové NMR spektroskopie (zaměření na strukturní biologii). Berlín: Springer. ISBN 978-1-4020-3499-2.
- Quincy Teng (2005). Strukturní biologie: praktické aplikace NMR. Berlín: Springer. Bibcode:2005stbi.book ..... T. ISBN 978-0-387-24367-2.
- Mark Rance; Cavanagh, John; Wayne J. Fairbrother; Arthur W. Hunt III; Skelton, NNicholas J. (2007). Proteinová NMR spektroskopie: principy a praxe (2. vyd.). Boston: Academic Press. ISBN 978-0-12-164491-8.
- Kurt Wüthrich (1986). NMR proteinů a nukleových kyselin. New York: Wiley. ISBN 978-0-471-82893-8.
externí odkazy
| Prostředky knihovny o Spektroskopie nukleární magnetické rezonance proteinů |
- Strategie založená na NOESY pro přiřazení páteřních a postranních řetězových rezonancí velkých proteinů bez deuterace (protokol)
- odpočinout si Software pro analýzu dynamiky NMR
- Web ProSA Webová služba pro rozpoznávání chyb v experimentálně nebo teoreticky určených proteinových strukturách
- Stanovení struktury proteinů z řídkých experimentálních dat - úvodní prezentace
- Proteinová NMR Experimenty s proteinovými NMR