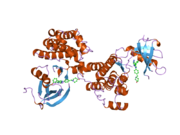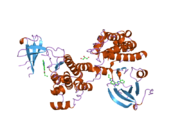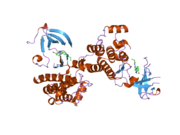Protoonkogenní tyrosin-protein kináza Src - Proto-oncogene tyrosine-protein kinase Src
Protoonkogenní tyrosin-protein kináza Src, také známý jako proto-onkogen c-Srcnebo jednoduše c-Src (buněčný Src; vyslovuje se „sarc“, jak je zkratka sarkom ), je nereceptorová tyrosinkináza protein, který je u lidí kódován SRC gen. Patří do rodiny Kinázy rodiny Src a je podobný v-Src (virový Src) gen Virus Rousova sarkomu. Zahrnuje SH2 doména, an SH3 doména a a tyrosinkináza doména. Dva varianty přepisu pro tento gen byly nalezeny kódující stejný protein.[5]
c-Src fosforyláty charakteristický tyrosin zbytky v jiných tyrosinkinázy. Hraje roli v regulaci embryonálního vývoje a buněčného růstu. Předpokládá se, že zvýšená hladina aktivity c-Src je spojena s progresí rakoviny podporou dalších signálů.[6] Mutace v c-Src by mohly být zapojeny do maligní progrese rakovina tlustého střeva. c-Src by neměla být zaměňována s CSK (C-koncová Src kináza), an enzym že fosforyluje c-Src na svém C-konec a poskytuje negativní regulaci enzymatické aktivity Src.
c-Src původně objevili američtí vědci J. Michael Bishop a Harold E. Varmus, za které byli oceněni v roce 1989 Nobelova cena za fyziologii nebo medicínu.[7]
Objev
V roce 1979 J. Michael Bishop a Harold E. Varmus objevili, že normální kuřata mají gen, který je strukturně blízce příbuzný v-Src.[8] Byl nazýván normální buněčný gen c-src (mobilní-src).[9] Tento objev změnil současné myšlení o rakovině z modelu, kde je rakovina způsobena cizí látkou (virový gen), na model, kde gen, který je normálně přítomný v buňce, může způsobit rakovinu. Předpokládá se, že v jednom okamžiku virus předků omylem začlenil virus c-Src gen svého buněčného hostitele. Nakonec tento normální gen zmutovaný do abnormálně fungujícího onkogenu uvnitř Virus Rousova sarkomu. Jakmile je onkogen transfektován zpět do kuřete, může to vést k rakovině.
Struktura
Součástí rodiny Src kináz je 9 členů: c-Src, Ano, Fyn, Fgr, Yrk, Lyn, Blk, Sakra, a Lck.[10] Exprese těchto členů rodiny Src není stejná ve všech tkáních a typech buněk. Src, Fyn a Yes jsou všudypřítomně exprimovány ve všech buněčných typech, zatímco ostatní se obecně nacházejí v hematopoetických buňkách.[11][12][13][14]
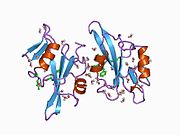
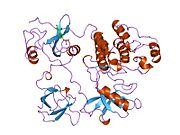
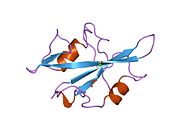
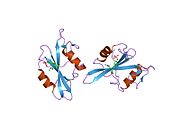
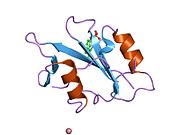
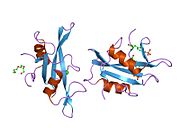
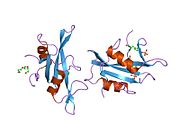
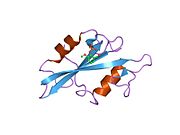
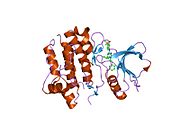
c-Src se skládá ze 6 funkčních oblastí: Src homologie 4 doména (doména SH4), jedinečná oblast, SH3 doména, SH2 doména, katalytická doména a krátký regulační konec.[15] Když je Src neaktivní, fosforylovaná tyrosinová skupina v poloze 527 interaguje s doménou SH2, což pomáhá doméně SH3 interagovat s flexibilní linker doménu a tím udržuje neaktivní jednotku pevně svázanou. Aktivace c-Src způsobí defosforylaci tyrosinu 527. To indukuje dálkový dosah allostery přes dynamika proteinové domény, což způsobí destabilizaci struktury, což má za následek otevření domén SH3, SH2 a kinázy a autofosforylaci zbytku tyrosinu 416.[16][17][18]
Autofosforylace Y416 stejně jako fosforylace vybraných substrátů Src je zvýšena dimerizací c-Src.[19] Dimerizace c-Src je zprostředkována interakcí myristoylované N-koncové oblasti jednoho partnera a kinázové domény jiného partnera.[19] Na interakci se podílí jak N-terminálně připojená kyselina myristová, tak peptidové sekvence jedinečné oblasti.[19] Vzhledem k všestrannosti, která je inherentní v této vnitřně neuspořádané oblasti, její multisite fosforylaci a její divergenci v rodině, jedinečná doména pravděpodobně funguje jako centrální signální uzel, který dohlíží na většinu enzymatických aktivit a jedinečných funkcí kináz rodiny Src.[19]
c-Src může být aktivován mnoha transmembránovými proteiny, které zahrnují: receptory adheze, receptorové tyrosinkinázy, Receptory spojené s G-proteinem a cytokinové receptory. Většina studií se zabývala receptorovými tyrosinkinázami a jejich příklady jsou receptor destičkového růstového faktoru (PDGFR) dráha a receptor epidermálního růstového faktoru (EGFR).
Src obsahuje nejméně tři flexibilní proteinové domény, který ve spojení s myristoylace, může zprostředkovat připojení k membránám a určit subcelulární lokalizaci.[20]
Funkce
Tento protoonkogen může hrát roli v regulaci embryonálního vývoje a buněčného růstu.
Když je src aktivován, podporuje přežití, angiogeneze, proliferace a invazní cesty. Reguluje také angiogenní faktory a vaskulární permeabilitu po fokální mozkové ischemii-reperfúzi,[21][22] a reguluje aktivitu metaloproteinázy matice 9 po intracerebrálním krvácení.[23]
Role v rakovině
Aktivace dráhy c-Src byla pozorována u přibližně 50% nádorů z tlustého střeva, jater, plic, prsu a slinivky břišní.[24] Protože aktivace c-Src vede k podpoře přežití, angiogeneze, proliferace a invazních drah, je pozorován aberantní růst nádorů u rakoviny. Běžným mechanismem je, že existují genetické mutace, které vedou ke zvýšené aktivitě nebo nadměrné expresi c-Src vedoucí k neustálé aktivaci c-Src.
Rakovina tlustého střeva
Aktivita c-Src byla nejlépe charakterizována u rakoviny tlustého střeva. Vědci prokázali, že exprese Src je u premaligních polypů 5 až 8krát vyšší než u normální sliznice.[25][26][27] Bylo také prokázáno, že zvýšené hladiny c-Src korelují s pokročilými stadii nádoru, velikostí nádoru a metastatickým potenciálem nádorů.[28][29]
Rakovina prsu
EGFR aktivuje c-Src, zatímco EGF také zvyšuje aktivitu c-Src. Nadměrná exprese c-Src navíc zvyšuje reakci procesů zprostředkovaných EGFR. EGFR i c-Src tedy zesilují vzájemné účinky. Zvýšené hladiny exprese c-Src byly nalezeny v lidských tkáních rakoviny prsu ve srovnání s normálními tkáněmi.[30][31][32]
Nadměrná exprese lidského epidermálního růstového faktoru 2 (HER2), také známá jako erbB2, souvisí s horší prognózou rakoviny prsu.[33][34] C-Src tedy hraje klíčovou roli v progresi rakoviny prsu u nádorů.
Rakovina prostaty
Členové kináz rodiny Src Src, Lyn a Fgr jsou vysoce exprimováni v maligních buňkách prostaty ve srovnání s normálními buňkami prostaty.[35] Když jsou primární buňky prostaty ošetřeny KRX-123, který je inhibitorem Lyn, buňky in vitro byly sníženy v proliferačním, migračním a invazivním potenciálu.[36] Použití inhibitoru tyrosinkinázy je tedy možným způsobem, jak snížit progresi rakoviny prostaty.
Jako drogový cíl
Pro terapeutické použití byla vyvinuta řada inhibitorů tyrosinkinázy, které cílí na tyrosinkinázu c-Src (stejně jako příbuzné tyrosinkinázy).[37] Jeden pozoruhodný příklad je dasatinib který byl schválen pro léčbu chronická myeloidní leukémie (CML) a akutní lymfocytární leukémie (ALL) s pozitivitou na chromozomy Philadelphia (PH +).[38] Dasatinib je také v klinických studiích pro použití u nehodgkinského lymfomu, metastatického karcinomu prsu a karcinomu prostaty. Mezi další léky inhibující tyrosinkinázu, které jsou v klinických studiích patří bosutinib,[39] bafetinib, AZD-0530, XLl-999, KX01 a XL228.[6]
Interakce
Ukázalo se, že Src (gen) interaguje s následujícími signálními cestami:
Přežití
Angiogeneze
Proliferace
Pohyblivost
Další obrázky
 Přehled drah přenosu signálu zapojených do apoptóza. |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000197122 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000027646 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ "Entrez Gene: SRC v-src sarkom (Schmidt-Ruppin A-2) virální homolog viru (ptačí)".
- ^ A b Wheeler DL, Iida M, Dunn EF (červenec 2009). „Role Src ve solidních nádorech“. Onkolog. 14 (7): 667–78. doi:10.1634 / theoncologist.2009-0009. PMC 3303596. PMID 19581523.
- ^ „Nobelova cena za fyziologii nebo medicínu 1989: J. Michael Bishop, Harold E. Varmus“. Nobelprize.org. 09.10.1989.
za objev „buněčného původu retrovirových onkogenů“
- ^ Stehelin D, Fujita DJ, Padgett T, Varmus HE, Bishop JM (1977). "Detekce a stanovení počtu transformačně-defektních kmenů viru ptačího sarkomu s molekulární hybridizací". Virologie. 76 (2): 675–84. doi:10.1016/0042-6822(77)90250-1. PMID 190771.
- ^ Oppermann H, Levinson AD, Varmus HE, Levintow L, Bishop JM (duben 1979). „Neinfikované buňky obratlovců obsahují protein, který úzce souvisí s produktem genu transformujícího virus ptačího sarkomu (src)“. Proc. Natl. Acad. Sci. USA. 76 (4): 1804–8. Bibcode:1979PNAS ... 76.1804O. doi:10.1073 / pnas.76.4.1804. PMC 383480. PMID 221907.
- ^ Thomas SM, Brugge JS (1997). "Buněčné funkce regulované kinázami rodiny Src". Annu. Rev. Cell Dev. Biol. 13: 513–609. doi:10.1146 / annurev.cellbio.13.1.513. PMID 9442882.
- ^ Cance WG, Craven RJ, Bergman M, Xu L, Alitalo K, Liu ET (prosinec 1994). „Rak, nová nukleární tyrosinkináza exprimovaná v epiteliálních buňkách“. Růst buněk se liší. 5 (12): 1347–55. PMID 7696183.
- ^ Lee J, Wang Z, Luoh SM, Wood WI, Scadden DT (leden 1994). „Klonování FRK, nového lidského intracelulárního genu kódujícího tyrosinkinázu podobného SRC“. Gen. 138 (1–2): 247–51. doi:10.1016/0378-1119(94)90817-6. PMID 7510261.
- ^ Oberg-Welsh C, Welsh M (leden 1995). "Klonování BSK, myšího homologu FRK se specifickým vzorem distribuce v tkáních". Gen. 152 (2): 239–42. doi:10.1016/0378-1119(94)00718-8. PMID 7835707.
- ^ Thuveson M, Albrecht D, Zürcher G, Andres AC, Ziemiecki A (duben 1995). „iyk, nová intracelulární proteinová tyrosinkináza odlišně exprimovaná v myší mléčné žláze a střevě“. Biochem. Biophys. Res. Commun. 209 (2): 582–9. doi:10.1006 / bbrc.1995.1540. PMID 7733928.
- ^ Arbesú M, Maffei M, Cordeiro TN, Teixeira JM, Pérez Y, Bernadó P, Roche S, Pons M (březen 2017). „Unikátní doména vytváří fuzzy intramolekulární komplex v kinázách rodiny Src“. Struktura. 25 (4): 630–640.e4. doi:10.1016 / j.str.2017.02.011. PMID 28319009.
- ^ Cooper JA, Gould KL, Cartwright CA, Hunter T (březen 1986). „Tyr527 je fosforylován v pp60c-src: důsledky pro regulaci“. Věda. 231 (4744): 1431–4. Bibcode:1986Sci ... 231.1431C. doi:10.1126 / science.2420005. PMID 2420005.
- ^ Okada M, Nakagawa H (prosinec 1989). "Proteinová tyrosinkináza zapojená do regulace funkce pp60c-src". J. Biol. Chem. 264 (35): 20886–93. PMID 2480346.
- ^ Nada S, Okada M, MacAuley A, Cooper JA, Nakagawa H (květen 1991). „Klonování komplementární DNA pro protein-tyrosinkinázu, která specificky fosforyluje negativní regulační místo p60c-src“. Příroda. 351 (6321): 69–72. Bibcode:1991Natur.351 ... 69N. doi:10.1038 / 351069a0. PMID 1709258. S2CID 4363527.
- ^ A b C d Spassov DS, Ruiz-Saenz A, Piple A, Moasser MM (říjen 2018). „Funkce dimerizace v jiskrově narušené N-koncové oblasti Src“. Cell Rep. 25 (2): 6449–463. doi:10.1016 / j.celrep.2018.09.035. PMC 6226010. PMID 30304684.
- ^ Kaplan JM, Varmus HE, biskup JM (březen 1990). „Protein src obsahuje více domén pro specifické připojení k membránám“. Molekulární a buněčná biologie. 10 (3): 1000–9. doi:10.1128 / mcb.10.3.1000. PMC 360952. PMID 1689455.
- ^ Zan L, Wu H, Jiang J, Zhao S, Song Y, Teng G, Li H, Jia Y, Zhou M, Zhang X, Qi J, Wang J (2011). „Časový profil Src, SSeCKS a angiogenních faktorů po fokální mozkové ischemii: korelace s angiogenezí a mozkovým edémem“. Neurochem. Int. 58 (8): 872–9. doi:10.1016 / j.neuint.2011.02.014. PMC 3100427. PMID 21334414.
- ^ Zan L, Zhang X, Xi Y, Wu H, Song Y, Teng G, Li H, Qi J, Wang J (2013). "Src reguluje angiogenní faktory a vaskulární permeabilitu po fokální mozkové ischemii-reperfúzi". Neurovědy. 262 (3): 118–128. doi:10.1016 / j.neuroscience.2013.12.060. PMC 3943922. PMID 24412374.
- ^ Zhao X, Wu T, Chang CF a kol. (2015). „Toxická role prostaglandinového E2 receptoru EP1 po intracerebrálním krvácení u myší“. Brain Behav. Immun. 46: 293–310. doi:10.1016 / j.bbi.2015.02.011. PMC 4422065. PMID 25697396.
- ^ Dehm SM, Bonham K (duben 2004). "Exprese genu SRC u lidské rakoviny: role transkripční aktivace". Biochem. Cell Biol. 82 (2): 263–74. doi:10.1139 / o03-077. PMID 15060621.
- ^ Bolen JB, Rosen N, Izrael MA (listopad 1985). „Zvýšená aktivita tyrosylkinázy pp60c-src v lidských neuroblastomech je spojena s amino-terminální tyrosinovou fosforylací produktu genu src“. Proc. Natl. Acad. Sci. USA. 82 (21): 7275–9. Bibcode:1985PNAS ... 82.7275B. doi:10.1073 / pnas.82.21.7275. PMC 390832. PMID 2414774.
- ^ Cartwright CA, Kamps MP, Meisler AI, Pipas JM, Eckhart W (červen 1989). "aktivace pp60c-src v lidském karcinomu tlustého střeva". J. Clin. Investovat. 83 (6): 2025–33. doi:10.1172 / JCI114113. PMC 303927. PMID 2498394.
- ^ Talamonti MS, Roh MS, Curley SA, Gallick GE (leden 1993). „Zvýšení aktivity a hladiny pp60c-src v progresivních stádiích lidského kolorektálního karcinomu“. J. Clin. Investovat. 91 (1): 53–60. doi:10.1172 / JCI116200. PMC 329994. PMID 7678609.
- ^ Aligayer H, Boyd DD, Heiss MM, Abdalla EK, Curley SA, Gallick GE (leden 2002). "Aktivace Src kinázy v primárním kolorektálním karcinomu: indikátor špatné klinické prognózy". Rakovina. 94 (2): 344–51. doi:10.1002 / cncr.10221. PMID 11900220. S2CID 2103781.
- ^ Cartwright CA, Meisler AI, Eckhart W (leden 1990). „Aktivace proteinové kinázy pp60c-src je časná událost v karcinogenezi tlustého střeva“. Proc. Natl. Acad. Sci. USA. 87 (2): 558–62. Bibcode:1990PNAS ... 87..558C. doi:10.1073 / pnas.87.2.558. PMC 53304. PMID 2105487.
- ^ Ottenhoff-Kalff AE, Rijksen G, van Beurden EA, Hennipman A, Michels AA, Staal GE (září 1992). „Charakterizace proteinových tyrosin kináz z lidské rakoviny prsu: účast onkogenního produktu c-src“. Cancer Res. 52 (17): 4773–8. PMID 1380891.
- ^ Biscardi JS, Belsches AP, Parsons SJ (duben 1998). „Charakterizace interakcí receptoru lidského epidermálního růstového faktoru a c-Src v buňkách lidského nádoru prsu“. Mol. Karcinogen. 21 (4): 261–72. doi:10.1002 / (SICI) 1098-2744 (199804) 21: 4 <261 :: AID-MC5> 3.0.CO; 2-N. PMID 9585256.
- ^ Verbeek BS, Vroom TM, Adriaansen-Slot SS, Ottenhoff-Kalff AE, Geertzema JG, Hennipman A, Rijksen G (prosinec 1996). "Exprese proteinu c-Src je u lidské rakoviny prsu zvýšena. Imunohistochemická a biochemická analýza". J. Pathol. 180 (4): 383–8. doi:10.1002 / (SICI) 1096-9896 (199612) 180: 4 <383 :: AID-PATH686> 3.0.CO; 2-N. PMID 9014858.
- ^ Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL (leden 1987). "Lidský karcinom prsu: korelace relapsu a přežití s amplifikací HER-2 / neu onkogenu". Věda. 235 (4785): 177–82. Bibcode:1987Sci ... 235..177S. doi:10.1126 / science.3798106. PMID 3798106.
- ^ Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, Levin WJ, Stuart SG, Udove J, Ullrich A (květen 1989). "Studie HER-2 / neu protoonkogenu u lidské rakoviny prsu a vaječníků". Věda. 244 (4905): 707–12. Bibcode:1989Sci ... 244..707S. doi:10.1126 / science.2470152. PMID 2470152.
- ^ Nam S, Kim D, Cheng JQ, Zhang S, Lee JH, Buettner R, Mirosevich J, Lee FY, Jove R (říjen 2005). „Působení inhibitoru kinázy rodiny Src, dasatinib (BMS-354825), na lidské buňky rakoviny prostaty“. Cancer Res. 65 (20): 9185–9. doi:10.1158 / 0008-5472.CAN-05-1731. PMID 16230377.
- ^ Chang YM, Bai L, Yang I (2002). "Průzkum aktivity Src a růstu a migrace související s Src v liniích rakoviny prostaty". Proc Am Assoc Cancer Res. 62: 2505a.
- ^ Musumeci F, Schenone S, Brullo C, Botta M (duben 2012). "Aktualizace duálních inhibitorů Src / Abl". Future Med Chem. 4 (6): 799–822. doi:10.4155 / fmc.12.29. PMID 22530642.
- ^ Breccia M, Salaroli A, Molica M, Alimena G (2013). "Systematický přehled dasatinibu u chronické myeloidní leukémie". OncoTargets Ther. 6: 257–65. doi:10.2147 / OTT.S35360. PMC 3615898. PMID 23569389.
- ^ Amsberg GK, Koschmieder S (2013). „Profil bosutinibu a jeho klinický potenciál v léčbě chronické myeloidní leukémie“. OncoTargets Ther. 6: 99–106. doi:10.2147 / OTT.S19901. PMC 3594007. PMID 23493838.
externí odkazy
- src + gen v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- src-rodina + kinázy v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Proteopedia SRC - interaktivní 3D model struktury SRC
- Geneview Vega
- Src Informace s odkazy v Brána pro migraci buněk
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P12931 (Proto-onkogen tyrosin-protein kináza Src) na PDBe-KB.