Wee1 - Wee1
| Wee1 | |||||||
|---|---|---|---|---|---|---|---|
 Krystalová struktura lidského Wee1 | |||||||
| Identifikátory | |||||||
| Symbol | Inhibitor mitózy proteinová kináza Wee1 | ||||||
| Alt. symboly | wee1 proteinová kináza s dvojitou specificitou Wee1 | ||||||
| Gen NCBI | 2539123 | ||||||
| UniProt | P07527 | ||||||
| Další údaje | |||||||
| EC číslo | 2.7.11.1 | ||||||
| |||||||
Wee1 je nukleární kináza patřící k Ser / Thr rodina proteinových kináz ve štěpných kvasinkách Schizosaccharomyces pombe (S. pombe). Wee1 má molekulová hmotnost z 96kDa a je klíčovým regulátorem buněčný cyklus postup. Ovlivňuje velikost buněk inhibicí vstupu do mitóza prostřednictvím inhibice Cdk1. Wee1 má homology v mnoha jiných organismech, včetně savců.
Úvod
Nařízení z velikost buňky je zásadní pro zajištění funkčnosti buňky. Kromě faktorů prostředí, jako jsou živiny, růstové faktory a funkční zátěž, je velikost buněk také kontrolována kontrolním bodem velikosti buněk.
Wee1 je součástí tohoto kontrolního bodu. Je to kináza stanovení časového bodu vstupu do mitózy, a tím ovlivnění velikosti dceřiných buněk. Ztráta funkce Wee1 způsobí produkci menší než normální dceřiné buňky, protože k dělení buněk dochází předčasně.
Jeho název je odvozen od skotský dialekt slovo wee, což znamená malý - jeho objevitel Paul Nurse v době objevení pracoval na univerzitě v Edinburghu ve Skotsku.[1][2]
Funkce
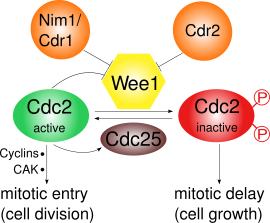
Wee1 inhibuje Cdk1 fosforylací na dvou různých místech, Tyr15 a Thr14.[3] Cdk1 je zásadní pro průchod různých kontrolních bodů buněčného cyklu závislý na cyklinu. Existují nejméně tři kontrolní body, pro které je důležitá inhibice Cdk1 pomocí Wee1:
- Kontrolní bod G2 / M: Wee1 fosforyluje aminokyseliny Tyr15 a Thr14 Cdk1, což udržuje nízkou kinázovou aktivitu Cdk1 a brání vstupu do mitóza; v S. pombe může dojít k dalšímu buněčnému růstu. Bylo prokázáno, že Wee1 zprostředkovaná inaktivace Cdk1 je ultracitlivý v důsledku konkurence substrátu.[4] Během mitotického vstupu je aktivita Wee1 snížena několika regulátory a tím je zvýšena aktivita Cdk1. v S. pombe, Pom1, protein kináza, se lokalizuje na buněčné póly. To aktivuje cestu, ve které Cdr2 inhibuje Wee1 prostřednictvím Cdr1. Samotný Cdk1 negativně reguluje Wee1 fosforylací, což vede ke smyčce pozitivní zpětné vazby. Samotná snížená aktivita Wee1 není pro mitotický vstup dostatečná: Syntéza cykliny a také je vyžadována aktivační fosforylace Cdk aktivující kinázou (CAK).[5]
- Kontrolní bod velikosti buňky: Existují důkazy o existenci kontrolního bodu velikosti buňky, který brání malým buňkám ve vstupu do mitózy. Wee1 hraje roli v tomto kontrolním bodě tím, že koordinuje velikost buněk a postup buněčného cyklu.[6]
- Kontrolní bod poškození DNA: Tento kontrolní bod také řídí přechod G2 / M. v S. pombe tento kontrolní bod zpožďuje vstup mitózy do buněk s poškozením DNA (například vyvolaným gama záření ). Prodloužení fáze G2 závisí na Wee1; wee1 mutanti po prodloužení gama záření nemají prodlouženou fázi G2.[7]
Rovněž byla popsána epigenetická funkce kinázy Wee1. Ukázalo se, že Wee1 fosforyluje histon H2B na zbytku tyrosinu 37, který reguluje globální expresi histonů.[8][9]
Homologové
| lidský homolog WEE1 (S. pombe) | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | WEE1 | ||||||
| Gen NCBI | 7465 | ||||||
| HGNC | 12761 | ||||||
| OMIM | 193525 | ||||||
| RefSeq | NM_003390 | ||||||
| UniProt | P30291 | ||||||
| Další údaje | |||||||
| Místo | Chr. 11 p15.3-15.1 | ||||||
| |||||||
| lidský WEE1 homolog 2 (S. pombe) | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | WEE2 | ||||||
| Gen NCBI | 494551 | ||||||
| HGNC | 19684 | ||||||
| RefSeq | NM_001105558 | ||||||
| UniProt | P0C1S8 | ||||||
| Další údaje | |||||||
| Místo | Chr. 7 q32-q32 | ||||||
| |||||||
WEE1 gen má dva známé homology u lidí, WEE1 (také známý jako WEE1A) a WEE2 (WEE1B). Odpovídající proteiny jsou Protein kináza podobná Wee1 a Wee1-like protein kinase 2 které působí na lidský homolog Cdk1 Cdk1.
Homolog Wee1 v nadějných kvasnicích Saccharomyces cerevisiae se nazývá Swe1.
Nařízení
v S. pombe„Wee1 je fosforylován
Cdk1 a cyklin B tvoří faktor podporující zrání (MPF), který podporuje vstup do mitózy. Je inaktivován fosforylací přes Wee1 a aktivován fosfatázou Cdc25C. Cdc25C je zase aktivován Polo kináza a deaktivován Chk1.[6] Tak dovnitř S. pombe Regulace Wee1 je hlavně pod kontrolou fosforylace přes polaritu kinázy, Pom1 Cesta včetně Cdr2 a Cdr1.[10][11][12][13]
Při přechodu G2 / M je Cdk1 aktivován Cdc25 prostřednictvím defosforylace Tyr15. Současně je Wee1 inaktivován prostřednictvím fosforylace na svém místě C-terminál katalytická doména pomocí Nim1 / Cdr1.[12] Aktivní MPF bude také propagovat svou vlastní aktivitu aktivací Cdc25 a deaktivací Wee1, vytvořením smyčka pozitivní zpětné vazby, ačkoli to ještě není podrobně pochopeno.[6]
Vyšší eukaryota regulují Wee1 prostřednictvím fosforylace a degradace
Ve vyšších eukaryoty „Inaktivace Wee1 nastává jak fosforylací, tak degradace.[14] Proteinový komplex[poznámka 1] SCFβ-TrCP1 / 2 je E3 ubikvitin ligáza který funguje v Wee1A ubikvitinace. The M-fáze kinázy Kináza podobná pólu (Plk1) a Cdc2 fosforylují dva serinové zbytky ve Wee1A, které jsou rozpoznávány SCFβ-TrCP1 / 2.[15]
S. cerevisiae homolog Swe1
v S. cerevisiae, cyklin-dependentní kináza Cdc28 (Cdk1 homolog) je fosforylován pomocí Swe1 (Wee1 homolog) a defosforylován Mih1 (Cdc25 homolog). Homolog Nim1 / Cdr1 v S. cerevisiae, Hsl1, společně s příbuznými kinázami Gin4 a Kcc4 lokalizují Swe1 do bud-krk. Kinázy sdružující pupenový krk Cla4 a Cdc5 (polokinázový homolog) fosforylují Swe1 v různých stádiích buněčného cyklu. Swe1 je také fosforylován Clb2-Cdc28, který slouží jako uznání pro další fosforylaci pomocí Cdc5.
The S. cerevisiae protein Swe1 je také regulován degradací. Swe1 je hyperfosforylován Clb2-Cdc28 a Cdc5, což může být signálem pro ubikvitinaci a degradaci SCF Komplex E3 ubikvitin ligázy jako u vyšších eukaryot.[16]
Role v rakovině
Reguluje také faktor MPF podporující mitózu Poškození DNA indukovaný apoptóza. Negativní regulace MPF pomocí WEE1 způsobuje aberantní mitózu a tím odolnost vůči apoptóze indukované poškozením DNA. Kruppelův faktor 2 (KLF2) negativně reguluje lidský WEE1, čímž zvyšuje citlivost na apoptózu indukovanou poškozením DNA v rakovinných buňkách.[17]
Mutantní fenotyp
Wee1 funguje jako v závislosti na dávce inhibitor mitózy.[18] Množství proteinu Wee1 tedy koreluje s velikostí buněk:
Štěpné droždí mutant wee1, také zvaný wee1−, se dělí na výrazně menší velikost buněk než buňky divokého typu. Protože Wee1 inhibuje vstup do mitózy, jeho absence povede k rozdělení v předčasném stádiu a subnormální velikosti buněk. Naopak, když se zvýší exprese Wee1, mitóza se zpozdí a buňky se rozdělí do velké velikosti, než se rozdělí.
Viz také
Poznámky
- ^ Protein obsahující p-transducinovou repetici 1/2 (β-TrCP1 / 2) proteinový komplex SKP1 / Cul1 / F-box obsahující protein F-box
Reference
- ^ Sestra P (prosinec 2004). „Wee beasties“. Příroda. 432 (7017): 557. doi:10.1038 / 432557a. PMID 15577889. S2CID 29840746.
- ^ Sestra P, Thuriaux P (listopad 1980). "Regulační geny kontrolující mitózu ve štěpných kvasinkách Schizosaccharomyces pombe". Genetika. 96 (3): 627–37. PMC 1214365. PMID 7262540.
- ^ Den Haese GJ, Walworth N, Carr AM, Gould KL (1995). „Proteinová kináza Wee1 reguluje fosforylaci T14 štěpných kvasinek Cdc2“. Mol Biol Cell. 6 (4): 371–85. doi:10,1091 / mbc.6.4.371. PMC 301198. PMID 7626804.
- ^ Kim, SY; Ferrell JE, Jr. (23. března 2007). "Konkurence substrátu jako zdroj ultracitlivosti při inaktivaci Wee1". Buňka. 128 (6): 1133–45. doi:10.1016 / j.cell.2007.01.039. PMID 17382882. S2CID 14138576.
- ^ Coleman TR, Dunphy WG (1994). "Regulační faktory Cdc2". Současný názor na buněčnou biologii. 6 (6): 877–82. doi:10.1016/0955-0674(94)90060-4. PMID 7880537.
- ^ A b C Kellogg DR (2003). „Mechanismy závislé na Wee1 potřebné pro koordinaci buněčného růstu a dělení buněk“. J Cell Sci. 116 (24): 4883–90. doi:10,1242 / jcs.00908. PMID 14625382.
- ^ Rowley R, Hudson J, Young PG (1992). „Proteinová kináza wee1 je vyžadována pro mitotické zpoždění vyvolané zářením“. Příroda. 356 (6367): 353–5. doi:10.1038 / 356353a0. PMID 1549179. S2CID 4280074.
- ^ Mahajan K, Fang B, Koomen JM, Mahajan NP (2012). „Fosforylace H2B Tyr37 potlačuje expresi replikačně závislých jádrových histonových genů“. Přírodní strukturní a molekulární biologie. 19 (9): 930–7. doi:10.1038 / nsmb.2356. PMC 4533924. PMID 22885324.
- ^ Mahajan K, Mahajan NP (2013). „WEE1 tyrosinkináza, nový epigenetický modifikátor“. Trendy Genet. 29 (7): 394–402. doi:10.1016 / j.tig.2013.02.003. PMC 3700603. PMID 23537585.
- ^ Boddy MN, Furnari B, Mondesert O, Russell P (květen 1998). "Kontrolní bod replikace vynucený kinázami Cds1 a Chk1". Věda. 280 (5365): 909–12. doi:10.1126 / science.280.5365.909. PMID 9572736.
- ^ Wu L, Russell P (červen 1993). „Nim1 kináza podporuje mitózu deaktivací tyrosinkinázy Wee1“. Příroda. 363 (6431): 738–41. doi:10.1038 / 363738a0. PMID 8515818. S2CID 4320080.
- ^ A b Coleman TR, Tang Z, Dunphy WG (březen 1993). „Negativní regulace proteinové kinázy wee1 přímým působením mitotického induktoru nim1 / cdr1“. Buňka. 72 (6): 919–29. doi:10.1016 / 0092-8674 (93) 90580-J. PMID 7681363. S2CID 42256641.
- ^ Tang Z, Coleman TR, Dunphy WG (září 1993). „Dva odlišné mechanismy pro negativní regulaci proteinové kinázy Wee1“. EMBO J.. 12 (9): 3427–36. doi:10.1002 / j.1460-2075.1993.tb06017.x. PMC 413619. PMID 7504624.
- ^ Watanabe N, Broome M, Hunter T (květen 1995). "Regulace lidské WEE1Hu CDK tyrosin 15-kinázy během buněčného cyklu". EMBO J.. 14 (9): 1878–91. doi:10.1002 / j.1460-2075.1995.tb07180.x. PMC 398287. PMID 7743995.
- ^ Watanabe N, Arai H, Nishihara Y a kol. (Březen 2004). „M-fázové kinázy indukují fosfo-dependentní ubikvitinaci somatické Wee1 pomocí SCFbeta-TrCP“. Proc. Natl. Acad. Sci. USA. 101 (13): 4419–24. doi:10.1073 / pnas.0307700101. PMC 384762. PMID 15070733.
- ^ Lee KS, Asano S, Park JE, Sakchaisri K, Erikson RL (říjen 2005). „Monitorování buněčného cyklu regulací Swe1 / Wee1 v nadějných kvasinkách závislou na multikináze“. Buněčný cyklus. 4 (10): 1346–9. doi:10,4161 / cc.4.10.2049. PMID 16123596.
- ^ Wang F, Zhu Y, Huang Y a kol. (Červen 2005). „Transkripční represe WEE1 faktorem 2 podobným Kruppelovi se podílí na apoptóze způsobené poškozením DNA“. Onkogen. 24 (24): 3875–85. doi:10.1038 / sj.onc.1208546. PMID 15735666.
- ^ Russell P, sestra P (květen 1987). „Negativní regulace mitózy wee1 +, genem kódujícím homolog proteinové kinázy“. Buňka. 49 (4): 559–67. doi:10.1016/0092-8674(87)90458-2. PMID 3032459. S2CID 42801276.
