DNA - DNA - Wikipedia


Deoxyribonukleová kyselina (/diːˈɒksɪˌraɪboʊnjuːˌkliːɪk,-ˌkleɪ-/ (![]() poslouchat);[1] DNA) je molekula složený ze dvou polynukleotid řetězy, které se kolem sebe vinou a tvoří dvojitá spirála nesoucí genetický pokyny pro vývoj, fungování, růst a reprodukce ze všech známých organismy a mnoho viry. DNA a ribonukleová kyselina (RNA) jsou nukleové kyseliny. Vedle bílkoviny, lipidy a komplexní sacharidy (polysacharidy ), nukleové kyseliny jsou jedním ze čtyř hlavních typů makromolekuly které jsou nezbytné pro všechny známé formy život.
poslouchat);[1] DNA) je molekula složený ze dvou polynukleotid řetězy, které se kolem sebe vinou a tvoří dvojitá spirála nesoucí genetický pokyny pro vývoj, fungování, růst a reprodukce ze všech známých organismy a mnoho viry. DNA a ribonukleová kyselina (RNA) jsou nukleové kyseliny. Vedle bílkoviny, lipidy a komplexní sacharidy (polysacharidy ), nukleové kyseliny jsou jedním ze čtyř hlavních typů makromolekuly které jsou nezbytné pro všechny známé formy život.
Tyto dva řetězce DNA jsou známé jako polynukleotidy protože se skládají z jednodušších monomerní volané jednotky nukleotidy.[2][3] Každý nukleotid se skládá z jednoho ze čtyř obsahující dusík nukleové báze (cytosin [C], guanin [G], adenin [A] nebo tymin [T]), a cukr volala deoxyribóza a fosfátová skupina. Nukleotidy jsou navzájem spojeny v řetězci pomocí kovalentní vazby (známá jako fosfo-diesterová vazba) mezi cukrem jednoho nukleotidu a fosfátem dalšího, což vede ke střídání páteř cukr-fosfát. Dusíkaté báze dvou samostatných polynukleotidových řetězců jsou spojeny dohromady, podle párování bází pravidla (A s T a C s G), s Vodíkové vazby k výrobě dvouvláknové DNA. Doplňkové dusíkaté báze se dělí do dvou skupin, pyrimidiny a puriny. V DNA jsou pyrimidiny tymin a cytosin; puriny jsou adenin a guanin.
Obě vlákna dvouvláknové DNA uchovávají stejné biologické informace. Tato informace je replikováno a když se tyto dva prameny oddělí. Velká část DNA (více než 98% pro člověka) je nekódování, což znamená, že tyto oddíly neslouží jako vzory pro proteinové sekvence. Tyto dva řetězce DNA probíhají v opačných směrech a jsou tak antiparalelní. Ke každému cukru je připojen jeden ze čtyř typů nukleových bází (neformálně, základny). To je sekvence z těchto čtyř nukleobází podél páteře, která kóduje genetickou informaci. RNA řetězce se vytvářejí pomocí řetězců DNA jako šablony v procesu zvaném transkripce, kde jsou DNA báze vyměňovány za jejich odpovídající báze, s výjimkou případu tyminu (T), za který je substituována RNA uracil (U).[4] Pod genetický kód, tyto řetězce RNA specifikují sekvenci aminokyseliny v proteinech v procesu zvaném překlad.
V eukaryotických buňkách je DNA organizována do dlouhých struktur zvaných chromozomy. Před typické buněčné dělení, tyto chromozomy jsou duplikovány v procesu replikace DNA, poskytující kompletní sadu chromozomů pro každou dceřinnou buňku. Eukaryotické organismy (zvířata, rostliny, houby a protistů ) ukládají většinu své DNA uvnitř buněčné jádro tak jako nukleární DNA, a někteří v mitochondrie tak jako mitochondriální DNA nebo v chloroplasty tak jako chloroplastová DNA.[5] V porovnání, prokaryoty (bakterie a archaea ) ukládají jejich DNA pouze v cytoplazma, v kruhové chromozomy. V eukaryotických chromozomech chromatin proteiny, jako např histony, kompaktní a organizovat DNA. Tyto zhutňovací struktury řídí interakce mezi DNA a jinými proteiny a pomáhají řídit, které části DNA jsou transkribovány.
Vlastnosti

DNA je dlouhá polymer vyrobené z opakujících se volaných jednotek nukleotidy, z nichž každý je obvykle symbolizován jedním písmenem: A, T, C nebo G.[6][7] Struktura DNA je podél své délky dynamická a je schopna se stočit do těsných smyček a jiných tvarů.[8] U všech druhů se skládá ze dvou spirálových řetězců, které jsou navzájem spojeny Vodíkové vazby. Oba řetězy jsou stočeny kolem stejné osy a mají stejnou rozteč 34angstromy (Å) (3.4nanometry ). Dvojice řetězců má poloměr 10 angstromů (1,0 nanometru).[9] Podle jiné studie, měřeno v jiném roztoku, měřil řetězec DNA 22 až 26 angstromů široký (2,2 až 2,6 nanometrů) a jedna nukleotidová jednotka měřila 3,3 Å (0,33 nm).[10] Přestože je každý jednotlivý nukleotid velmi malý, může být polymer DNA velmi velký a může obsahovat stovky milionů nukleotidů, například v chromozom 1. Chromozom 1 je největší člověk chromozóm s přibližně 220 miliony základní páry, a při narovnání by byl dlouhý 85 mm.[11]
DNA obvykle neexistuje jako jedno vlákno, ale jako dvojice řetězců, které jsou pevně drženy pohromadě.[9][12] Tyto dva dlouhé prameny se vinou kolem sebe ve tvaru a dvojitá spirála. Nukleotid obsahuje jak segment z páteř molekuly (která drží řetěz pohromadě) a a nukleobáze (který interaguje s druhým vláknem DNA ve šroubovici). Nukleobáze spojená s cukrem se nazývá a nukleosid a báze vázaná na cukr a na jednu nebo více fosfátových skupin se nazývá a nukleotid. A biopolymer obsahující více vázaných nukleotidů (jako v DNA) se nazývá a polynukleotid.[13]
Páteř řetězce DNA je vyrobena ze střídání fosfát a cukr skupiny.[14] Cukr v DNA je 2-deoxyribóza, což je pentóza (Pět-uhlík ) cukr. Cukry jsou spojeny dohromady fosfátovými skupinami, které se tvoří fosfodiesterové vazby mezi třetím a pátým uhlíkem atomy sousedních cukrových prstenů. Tito jsou známí jako 3'-konec (tři hlavní konec) a 5'-konec (pět hlavních konců) uhlíky, primární symbol se používá k rozlišení těchto atomů uhlíku od atomů báze, ke které deoxyribóza tvoří glykosidová vazba. Proto jakýkoli řetězec DNA má obvykle jeden konec, na kterém je fosfátová skupina připojená k 5 'uhlíku ribózy (5' fosforyl), a druhý konec, na kterém je volná hydroxylová skupina připojená k 3 'uhlíku ribóza (3 'hydroxylová skupina). Orientace 3 'a 5' uhlíku podél páteře cukr-fosfát se uděluje směrovost (někdy nazývaná polarita) ke každému řetězci DNA. V dvojitá šroubovice nukleové kyseliny, směr nukleotidů v jednom řetězci je opačný k jejich směru v druhém řetězci: řetězce jsou antiparalelní. O asymetrických koncích řetězců DNA se říká, že mají směrovost pěti hlavních konců (5 ') a tří hlavních konců (3'), přičemž 5 'konec má koncovou fosfátovou skupinu a 3' konec koncovou hydroxylovou skupinu. Jeden zásadní rozdíl mezi DNA a DNA RNA je cukr, přičemž 2-deoxyribóza v DNA je nahrazena alternativním pentózovým cukrem ribóza v RNA.[12]
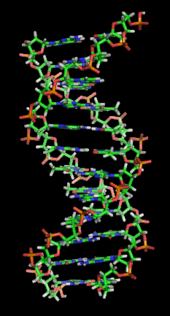
Dvojitá šroubovice DNA je stabilizována primárně dvěma silami: Vodíkové vazby mezi nukleotidy a stohování základny interakce mezi aromatický nukleové báze.[16] Čtyři báze nalezené v DNA jsou adenin (A), cytosin (C), guanin (G) a tymin (T). Tyto čtyři báze jsou připojeny k fosfátu cukru za vzniku úplného nukleotidu, jak je znázorněno na obrázku adenosinmonofosfát. Adeninové páry s tyminem a guaninové páry s cytosinem, tvořící A-T a G-C základní páry.[17][18]
Klasifikace nukleobází
Nukleové báze se dělí na dva typy: puriny, A a G, které jsou kondenzované pětičlenné a šestičlenné heterocyklické sloučeniny a pyrimidiny, šestičlenné kruhy C a T.[12] Pátá pyrimidinová nukleová báze, uracil (U), obvykle nahrazuje thymin v RNA a liší se od thyminu nedostatkem a methylová skupina na jeho prstenu. Kromě RNA a DNA je mnoho umělých analogy nukleových kyselin byly vytvořeny pro studium vlastností nukleových kyselin nebo pro použití v biotechnologiích.[19]
Nekánonické základny
Modifikované báze se vyskytují v DNA. První z nich byl uznán 5-methylcytosin, který byl nalezen v genom z Mycobacterium tuberculosis v roce 1925.[20] Důvod přítomnosti těchto nekanonických bází v bakteriálních virech (bakteriofágy ) je vyhnout se restrikční enzymy přítomný v bakteriích. Tento enzymový systém funguje alespoň částečně jako molekulární imunitní systém chránící bakterie před infekcí viry.[21] Modifikace bází, cytosin a adenin, běžnější a modifikovanější báze DNA, hrají zásadní roli v epigenetický kontrola genové exprese u rostlin a zvířat.[22]
Výpis nekanonických bází nalezených v DNA
Je známo, že se v DNA vyskytuje řada nekanonických bází.[23] Většinou se jedná o modifikace kanonických bází plus uracil.
- Upraveno Adenosin
- N6-karbamoyl-methyladenin
- N6-methyadenin
- Upraveno Guanine
- 7-deazaguanin
- 7-methylguanin
- Upraveno Cytosin
- N4-methylcytosin
- 5-karboxylcytosin
- 5-Formylcytosin
- 5-Glykosylhydroxymethylcytosin
- 5-Hydroxycytosin
- 5-methylcytosin
- Upraveno Thymidin
- a-Glutamythymidin
- α-putrescinylthymin
- Uracil a úpravy
- Základna J
- Uracil
- 5-dihydroxypentauracil
- 5-Hydroxymethyldeoxyuracil
- Ostatní
- Deoxyarcheosin
- 2,6-diaminopurin

Drážky
Dvojitá spirálovitá vlákna tvoří páteř DNA. Další dvojitá šroubovice může být nalezena při sledování mezer nebo drážek mezi prameny. Tyto dutiny sousedí s páry bází a mohou poskytovat a vazebné místo. Protože prameny nejsou vzájemně symetricky umístěné, jsou drážky nerovnoměrně velké. Jedna drážka, hlavní drážka, je 22angstromy (Å) široký a druhý, vedlejší drážka, je široký 12 Å.[24] Šířka hlavní drážky znamená, že okraje základen jsou přístupnější v hlavní drážce než v menší drážce. Výsledkem je, že bílkoviny jako transkripční faktory které se mohou vázat na specifické sekvence ve dvouvláknové DNA, obvykle navazují kontakt se stranami bází vystavenými v hlavní drážce.[25] Tato situace se liší v neobvyklých konformacích DNA v buňce (viz. níže), ale hlavní a vedlejší drážky jsou vždy pojmenovány tak, aby odrážely rozdíly ve velikosti, které by byly vidět, kdyby byla DNA zkroucena zpět do běžné formy B.
Základní párování
V dvojité šroubovici DNA se každý typ nukleobáze na jednom řetězci váže pouze s jedním typem nukleobáze na druhém řetězci. Tomu se říká komplementární párování bází. Puriny se tvoří Vodíkové vazby na pyrimidiny, s adeninovou vazbou pouze na thymin ve dvou vodíkových vazbách a cytosinovou vazbou pouze na guanin ve třech vodíkových vazbách. Toto uspořádání dvou nukleotidů vázajících se společně přes dvojitou šroubovici se nazývá pár bází Watson-Crick. DNA s vysokou Obsah GC je stabilnější než DNA s nízkým obsahem GC. Hoogsteenův pár bází je vzácná variace párování bází.[26] Protože vodíkové vazby nejsou kovalentní, lze je relativně snadno rozbít a znovu připojit. Dva řetězce DNA ve dvojité šroubovici lze tedy od sebe oddělit jako zip, buď mechanickou silou, nebo vysokou silou teplota.[27] V důsledku této komplementarity párů bází jsou všechny informace ve dvouvláknové sekvenci spirály DNA duplikovány na každém vlákně, což je při replikaci DNA životně důležité. Tato reverzibilní a specifická interakce mezi komplementárními bazickými páry je rozhodující pro všechny funkce DNA v organismech.[7]
 |
 |
Jak již bylo uvedeno výše, většina molekul DNA jsou ve skutečnosti dvě polymerní vlákna, která jsou spolu spirálovitě spojena nekovalentními vazbami; tento dvouvláknový (dsDNA) Struktura je udržována do značné míry díky interakcím intrastrand base stacking, které jsou nejsilnější pro G, C stacky. Tyto dva řetězce se mohou rozpadnout - proces známý jako tavení - za vzniku dvou jednořetězcové DNA (ssDNA) molekuly. Tání probíhá při vysoké teplotě, nízkém obsahu soli a vysoké teplotě pH (nízké pH také roztaví DNA, ale protože DNA je nestabilní kvůli odkyselení kyselinou, nízké pH se používá zřídka).
Stabilita formy dsDNA závisí nejen na obsahu GC (% párů bází G, C), ale také na sekvenci (protože stohování je specifické pro sekvenci) a také na délce (delší molekuly jsou stabilnější). Stabilitu lze měřit různými způsoby; běžným způsobem je „teplota tání“, což je teplota, při které se 50% molekul ds převádí na molekuly ss; teplota tání závisí na iontové síle a koncentraci DNA. Ve výsledku určuje sílu asociace mezi dvěma řetězci DNA jak procento párů bází GC, tak celková délka dvojité šroubovice DNA. Dlouhé helixy DNA s vysokým obsahem GC mají silněji interagující vlákna, zatímco krátké helixy s vysokým obsahem AT mají slabší interagující vlákna.[28] V biologii jsou části DNA dvojité šroubovice, které je třeba snadno oddělit, například TATAAT Krabice Pribnow v některých promotéři, mívají vysoký obsah AT, což usnadňuje roztahování pramenů.[29]
V laboratoři lze sílu této interakce měřit zjištěním teploty nutné k rozbití poloviny jejich vodíkových vazeb teplota tání (také zvaný Tm hodnota). Když se všechny páry bází v dvojité šroubovici DNA roztaví, vlákna se oddělí a existují v roztoku jako dvě zcela nezávislé molekuly. Tyto jednovláknové molekuly DNA nemají jediný společný tvar, ale některé konformace jsou stabilnější než jiné.[30]
Smysl a antisense
A Sekvence DNA se nazývá "smyslová" sekvence, pokud je stejná jako sekvence a messenger RNA kopie, která je přeložena do proteinu.[31] Sekvence na opačném řetězci se nazývá "antisense" sekvence. Sekvence sense i antisense mohou existovat na různých částech stejného řetězce DNA (tj. Obě řetězce mohou obsahovat sekvence sense i antisense). U prokaryot i eukaryot se produkují antisense RNA sekvence, ale funkce těchto RNA nejsou zcela jasné.[32] Jedním z návrhů je, že se na regulaci podílejí antisense RNA genová exprese prostřednictvím párování bází RNA-RNA.[33]
Několik sekvencí DNA u prokaryot a eukaryot a dalších v plazmidy a viry, stírají rozdíl mezi smyslovými a antisense vlákny tím, že mají překrývající se geny.[34] V těchto případech některé sekvence DNA mají dvojí povinnost, kódují jeden protein při čtení podél jednoho řetězce a druhý protein při čtení v opačném směru podél druhého řetězce. v bakterie, toto překrytí může být zapojeno do regulace genové transkripce,[35] zatímco u virů překrývající se geny zvyšují množství informací, které lze kódovat v malém virovém genomu.[36]
Supercoiling
DNA může být zkroucena jako lano v procesu zvaném DNA supercoiling. S DNA v „uvolněném“ stavu vlákno obvykle obíhá kolem osy dvojité šroubovice každých 10,4 párů bází, ale pokud je DNA zkroucená, jsou vlákna pevněji nebo volněji navinuta.[37] Pokud je DNA zkroucená ve směru šroubovice, jedná se o pozitivní nadšroubovici a báze jsou drženy těsněji u sebe. Pokud jsou zkrouceny v opačném směru, jedná se o negativní nadšroubovici a základny se snáze rozpadají. V přírodě má většina DNA mírné negativní převíjení, které zavádí enzymy volala topoizomerázy.[38] Tyto enzymy jsou také potřebné k uvolnění zkroucení namáhání zavedeného do řetězců DNA během procesů, jako je transkripce a replikace DNA.[39]

Alternativní struktury DNA
DNA existuje v mnoha možných konformace které zahrnují A-DNA, B-DNA a Z-DNA formy, i když ve funkčních organismech byly přímo pozorovány pouze B-DNA a Z-DNA.[14] Konformace, kterou si DNA osvojí, závisí na úrovni hydratace, sekvenci DNA, množství a směru nadzávitnice, chemických modifikacích bází, typu a koncentraci kovu ionty a přítomnost polyaminy v řešení.[40]
První publikované zprávy o A-DNA Rentgenové difrakční vzory —A také B-DNA — používaly analýzy založené na Patterson se transformuje který poskytoval pouze omezené množství strukturních informací pro orientovaná vlákna DNA.[41][42] Alternativní analýzu poté navrhl Wilkins et al., v roce 1953, pro in vivo B-DNA rentgenové difrakční-rozptylové vzory vysoce hydratovaných DNA vláken, pokud jde o druhé mocniny Besselovy funkce.[43] Ve stejném deníku James Watson a Francis Crick představili své molekulární modelování analýza rentgenových difraktogramů DNA, která naznačuje, že struktura byla dvojitá šroubovice.[9]
Ačkoliv Forma B-DNA je nejčastější za podmínek nalezených v buňkách,[44] není to dobře definovaná konformace, ale rodina souvisejících konformací DNA[45] které se vyskytují při vysokých úrovních hydratace přítomných v buňkách. Jejich odpovídající rentgenové difrakční a rozptylové vzorce jsou charakteristické pro molekulární parakrystaly s významným stupněm poruchy.[46][47]
Ve srovnání s B-DNA je forma A-DNA širší pravák spirála, s mělkou, širokou malou drážkou a užší, hlubší hlavní drážkou. Forma A se vyskytuje za nefyziologických podmínek v částečně dehydratovaných vzorcích DNA, zatímco v buňce může být produkována v hybridních párování řetězců DNA a RNA a v komplexech enzym-DNA.[48][49] Segmenty DNA, kde byly báze chemicky upraveny pomocí methylace může podstoupit větší změnu konformace a přijmout Z forma. Zde se prameny otáčejí kolem spirálovité osy v levotočivé spirále, což je opak běžné formy B.[50] Tyto neobvyklé struktury lze rozpoznat pomocí specifických proteinů vázajících Z-DNA a mohou se podílet na regulaci transkripce.[51] Studie z roku 2020 dospěla k závěru, že DNA se díky ionizaci od roku 2006 stala pravou rukou kosmické paprsky.[52]
Alternativní chemie DNA
Po mnoho let, exobiologové navrhli existenci a stínová biosféra, postulovaná mikrobiální biosféra Země, která využívá radikálně odlišné biochemické a molekulární procesy než v současnosti známý život. Jedním z návrhů byla existence životních forem, které používají arsen místo fosforu v DNA. Zpráva o možnosti v roce 2010 v roce 2010 bakterie GFAJ-1 bylo oznámeno,[53][54] ačkoli výzkum byl sporný,[54][55] a důkazy naznačují, že bakterie aktivně brání začlenění arsenu do páteře DNA a dalších biomolekul.[56]
Quadruplexové struktury
Na koncích lineárních chromozomů se nazývají specializované oblasti DNA telomery. Hlavní funkcí těchto oblastí je umožnit buňce replikovat konce chromozomu pomocí enzymu telomeráza, protože enzymy, které normálně replikují DNA, nemohou kopírovat extrémní 3 'konce chromozomů.[57] Tyto specializované chromozomové čepičky také pomáhají chránit konce DNA a zastavit Oprava DNA systémy v buňce zacházet s nimi jako s poškozením, které je třeba opravit.[58] v lidské buňky, telomery jsou obvykle délky jednovláknové DNA obsahující několik tisíc opakování jednoduché sekvence TTAGGG.[59]
Tyto sekvence bohaté na guanin mohou stabilizovat konce chromozomů vytvořením struktur skládaných sad čtyř bazických jednotek, spíše než obvyklých párů bází nalezených v jiných molekulách DNA. Zde jsou čtyři guaninové základny, známé jako a guanin tetrad, vytvořte rovnou desku. Tyto ploché čtyři základní jednotky se potom skládají na sebe a vytvářejí stabilní G-quadruplex struktura.[61] Tyto struktury jsou stabilizovány vodíkovou vazbou mezi okraji bází a chelace kovového iontu ve středu každé čtyři základní jednotky.[62] Mohou být také vytvořeny další struktury, přičemž centrální sada čtyř bází pochází buď z jednoho pramene složeného kolem základen, nebo z několika různých paralelních pramenů, z nichž každý přispívá jednou základnou k centrální struktuře.
Kromě těchto skládaných struktur tvoří telomery také velké smyčkové struktury zvané telomérové smyčky nebo T-smyčky. Zde se jednořetězcová DNA kroutí v dlouhém kruhu stabilizovaném proteiny vázajícími telomery.[63] Na samém konci T-smyčky je jednořetězcová telomerová DNA držena na oblasti dvouřetězcové DNA telomérním řetězcem, který narušuje dvojité šroubovité DNA a párování bází s jedním ze dvou řetězců. Tento trojvláknové struktura se nazývá posunovací smyčka nebo D-smyčka.[61]
 |  |
| Jedna větev | Více větví |
Rozvětvená DNA
V DNA třepení nastává, když na konci jinak komplementárního dvouřetězce DNA existují nekomplementární oblasti. Může se však vyskytnout rozvětvená DNA, pokud je zavedeno třetí vlákno DNA a obsahuje sousední oblasti schopné hybridizovat s roztřepenými oblastmi již existujícího dvouřetězce. Ačkoli nejjednodušší příklad rozvětvené DNA zahrnuje pouze tři řetězce DNA, jsou také možné komplexy zahrnující další řetězce a více větví.[64] Větvená DNA může být použita v nanotechnologie pro konstrukci geometrických tvarů viz část používá v technologii níže.
Umělé základy
Bylo syntetizováno několik umělých nukleových bází a úspěšně začleněno do pojmenovaného osmibázového analogu DNA DNA Hachimoji. Tyto umělé báze, které jsou označovány jako S, B, P a Z, jsou schopné se navzájem předvídatelně spojovat (S – B a P – Z), udržovat strukturu dvojité šroubovice DNA a přepisovat na RNA. Jejich existence naznačuje, že na čtyřech přírodních nukleobázích, které se vyvinuly na Zemi, není nic zvláštního.[65][66]
Chemické úpravy a pozměněné balení DNA
 |  |  |
| cytosin | 5-methylcytosin | tymin |
Základní úpravy a balení DNA
Exprese genů je ovlivněna tím, jak je DNA zabalena do chromozomů, ve struktuře zvané chromatin. Při balení mohou být zahrnuty základní modifikace, přičemž oblasti, které mají nízkou nebo žádnou genovou expresi, obvykle obsahují vysoké hladiny methylace z cytosin základny. Balení DNA a jeho vliv na genovou expresi může také nastat kovalentní modifikací histon proteinové jádro, kolem kterého je DNA obalena ve struktuře chromatinu nebo remodelací prováděnou komplexy remodelace chromatinu (viz Přestavba chromatinu ). Dále existuje přeslech mezi methylací DNA a modifikací histonu, takže mohou koordinovaně ovlivňovat chromatinovou a genovou expresi.[67]
Například methylace cytosinu produkuje 5-methylcytosin, což je důležité pro X-inaktivace chromozomů.[68] Průměrná úroveň methylace se u různých organismů - červa liší Caenorhabditis elegans chybí methylace cytosinu, zatímco obratlovců mají vyšší hladiny, přičemž až 1% jejich DNA obsahuje 5-methylcytosin.[69] Přes význam 5-methylcytosinu může deaminovat opustit thyminovou bázi, takže jsou zvláště náchylné methylované cytosiny mutace.[70] Mezi další modifikace bází patří methylace adeninu v bakteriích, přítomnost 5-hydroxymethylcytosin v mozek,[71] a glykosylace uracilu k výrobě "J-báze" v kinetoplastidy.[72][73]
Poškození

DNA může být poškozena mnoha druhy mutageny, které mění Sekvence DNA. Mutageny zahrnují oxidační činidla, alkylační činidla a také vysokoenergetické elektromagnetická radiace jako ultrafialový světlo a Rentgenové záření. Typ poškození DNA závisí na typu mutagenu. Například UV světlo může produkcí poškodit DNA dimery tyminu, což jsou příčné vazby mezi pyrimidinovými bázemi.[75] Na druhou stranu, oxidanty jako volné radikály nebo peroxid vodíku způsobují více forem poškození, včetně modifikací bází, zejména guanosinu, a dvouvláknových zlomů.[76] Typická lidská buňka obsahuje asi 150 000 bází, které utrpěly oxidační poškození.[77] Z těchto oxidačních lézí jsou nejnebezpečnější dvouřetězcové zlomy, protože je obtížné je opravit a mohou být produkovány bodové mutace, vložení, vypuštění ze sekvence DNA a chromozomální translokace.[78] Tyto mutace mohou způsobit rakovina. Kvůli inherentním limitům v mechanismech opravy DNA, kdyby lidé žili dost dlouho, všichni by nakonec měli rakovinu.[79][80] Poškození DNA, která jsou přirozeně se vyskytující v důsledku normálních buněčných procesů, které produkují reaktivní formy kyslíku, se často vyskytují také hydrolytické aktivity buněčné vody atd. Ačkoli je většina z těchto poškození opravena, v jakékoli buňce může i přes působení opravných procesů nějaké poškození DNA zůstat. Tyto zbývající poškození DNA se s věkem hromadí v postmitotických tkáních savců. Tato akumulace se jeví jako důležitá základní příčina stárnutí.[81][82][83]
Mnoho mutagenů se vejde do prostoru mezi dvěma sousedními páry bází, tomu se říká interkalace. Většina interkalátorů je aromatický a rovinné molekuly; příklady zahrnují ethidiumbromid, akridiny, daunomycin, a doxorubicin. Aby se interkalátor vešel mezi páry bází, musí se báze oddělit a narušit řetězce DNA odvinutím dvojité šroubovice. To inhibuje transkripci i replikaci DNA, což způsobuje toxicitu a mutace.[84] Ve výsledku mohou být DNA interkalátory karcinogeny, a v případě thalidomidu, a teratogen.[85] Ostatní, jako např benzo [A] pyrendiol dioxid a aflatoxin tvoří DNA adukty, které indukují chyby v replikaci.[86] Nicméně, vzhledem k jejich schopnosti inhibovat transkripci a replikaci DNA, se také používají jiné podobné toxiny chemoterapie inhibovat rychle rostoucí rakovina buňky.[87]
Biologické funkce

DNA se obvykle vyskytuje jako lineární chromozomy v eukaryoty, a kruhové chromozomy v prokaryoty. Sada chromozomů v buňce tvoří její genom; the lidský genom má přibližně 3 miliardy párů bází DNA uspořádaných do 46 chromozomů.[88] Informace přenášené DNA jsou uchovávány v sekvence kusů DNA volal geny. Přenos genetické informace v genech se dosahuje doplňkovým párováním bází. Například při transkripci, když buňka využívá informace v genu, je sekvence DNA kopírována do komplementární sekvence RNA prostřednictvím přitažlivosti mezi DNA a správnými nukleotidy RNA. Tato kopie RNA se obvykle použije k vytvoření shody proteinová sekvence v procesu zvaném překlad, což závisí na stejné interakci mezi RNA nukleotidy. Alternativně může buňka jednoduše kopírovat svou genetickou informaci v procesu zvaném replikace DNA. Podrobnosti o těchto funkcích jsou uvedeny v jiných článcích; zde se zaměřujeme na interakce mezi DNA a jinými molekulami, které zprostředkovávají funkci genomu.
Geny a genomy
Genomická DNA je pevně a řádně zabalena do procesu zvaného Kondenzace DNA, aby se vešly malé dostupné objemy buňky. U eukaryot se DNA nachází v buněčné jádro, s malými částkami v mitochondrie a chloroplasty. U prokaryot je DNA držena v těle nepravidelného tvaru v cytoplazmě zvané nukleoid.[89] Genetická informace v genomu je držena v genech a úplná sada této informace v organismu se nazývá jeho genotyp. Gen je jednotka dědičnost a je to oblast DNA, která ovlivňuje konkrétní charakteristiku organismu. Geny obsahují otevřený čtecí rámec které lze přepsat, a regulační sekvence jako promotéři a zesilovače, které řídí transkripci otevřeného čtecího rámce.
V mnoha druh, jen malý zlomek z celkové sekvence genom kóduje protein. Například pouze asi 1,5% lidského genomu sestává z proteinového kódování exony, s více než 50% lidské DNA sestávající z nekódování opakující se sekvence.[90] Důvody přítomnosti tolik nekódující DNA v eukaryotických genomech a mimořádné rozdíly v velikost genomu nebo Hodnota C., mezi druhy, představují dlouhodobou hádanku známou jako „Záhada s hodnotou C. ".[91] Některé sekvence DNA, které nekódují protein, však mohou stále kódovat funkční nekódující RNA molekuly, které se účastní regulace genové exprese.[92]

Některé nekódující sekvence DNA hrají v chromozomech strukturní roli. Telomeres a centromery obvykle obsahují několik genů, ale jsou důležité pro funkci a stabilitu chromozomů.[58][94] Bohatá forma nekódující DNA u lidí je pseudogeny, což jsou kopie genů, které byly deaktivovány mutací.[95] Tyto sekvence jsou obvykle pouze molekulární fosilie, i když mohou příležitostně sloužit jako syrové genetický materiál pro vytváření nových genů procesem genová duplikace a divergence.[96]
Přepis a překlad
Gen je sekvence DNA, která obsahuje genetickou informaci a může ovlivňovat fenotyp organismu. V genu sekvence bází podél řetězce DNA definuje a messenger RNA sekvence, která pak definuje jednu nebo více proteinových sekvencí. Vztah mezi nukleotidovými sekvencemi genů a aminokyselina sekvence proteinů je určena pravidly překlad, souhrnně označované jako genetický kód. Genetický kód se skládá z volaných třípísmenných „slov“ kodony vytvořené ze sekvence tří nukleotidů (např. ACT, CAG, TTT).
V transkripci jsou kodony genu kopírovány do messengerové RNA pomocí RNA polymeráza. Tato kopie RNA je poté dekódována a ribozom který čte sekvenci RNA párováním bází s messengerovou RNA přenos RNA, který nese aminokyseliny. Jelikož existují 4 báze ve 3písmenných kombinacích, existuje 64 možných kodonů (43 kombinace). Ty kódují dvacet standardní aminokyseliny, což dává většině aminokyselin více než jeden možný kodon. Existují také tři kodony „stop“ nebo „nesmysly“, které znamenají konec kódující oblasti; to jsou kodony TAA, TGA a TAG.
Replikace
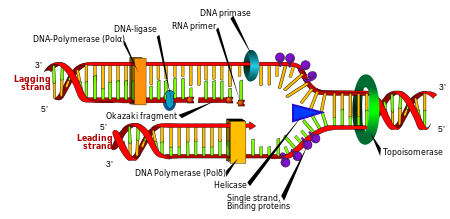
Buněčné dělení je nezbytný pro růst organismu, ale když se buňka rozdělí, musí replikovat DNA ve svém genomu, aby obě dceřiné buňky měly stejnou genetickou informaci jako jejich rodiče. Dvouvláknová struktura DNA poskytuje jednoduchý mechanismus replikace DNA. Zde jsou dva prameny odděleny a poté každý pramen komplementární DNA sekvence je znovu vytvořena pomocí enzym volala DNA polymeráza. Tento enzym vytváří komplementární vlákno hledáním správné báze prostřednictvím komplementárního párování bází a jeho vazbou na původní vlákno. Protože DNA polymerázy mohou prodloužit řetězec DNA pouze ve směru 5 'až 3', používají se různé mechanismy ke kopírování antiparalelních řetězců dvojité šroubovice.[97] Tímto způsobem základna na starém řetězci určuje, která báze se objeví na novém řetězci, a buňka končí s dokonalou kopií své DNA.
Extracelulární nukleové kyseliny
Nahá extracelulární DNA (eDNA), většina z ní uvolněná buněčnou smrtí, je v prostředí téměř všudypřítomná. Jeho koncentrace v půdě může být až 2 μg / l a jeho koncentrace v přírodním vodním prostředí může být až 88 μg / l.[98] Pro eDNA byly navrženy různé možné funkce: může být součástí horizontální přenos genů;[99] může poskytovat živiny;[100] a může působit jako pufr pro nábor nebo titraci iontů nebo antibiotik.[101] Extracelulární DNA působí jako funkční extracelulární matricová složka v biofilmy několika bakteriálních druhů. Může působit jako rozpoznávací faktor k regulaci připojení a šíření specifických typů buněk v biofilmu;[102] může přispívat k tvorbě biofilmu;[103] a může přispět k fyzické síle biofilmu a odolnosti proti biologickému stresu.[104]
Bezbuněčná fetální DNA se nachází v krvi matky a lze jej sekvenovat, aby se zjistilo velké množství informací o vyvíjejícím se plodu.[105]
Pod jménem environmentální DNA eDNA zaznamenala zvýšené použití v přírodních vědách jako nástroj průzkumu pro ekologie, sledování pohybů a přítomnosti druhů ve vodě, vzduchu nebo na zemi a hodnocení biodiverzity oblasti.[106][107]
Interakce s bílkovinami
Všechny funkce DNA závisí na interakcích s bílkovinami. Tyto proteinové interakce mohou být nespecifické nebo se protein může specificky vázat na jednu sekvenci DNA. Enzymy se mohou také vázat na DNA a z nich jsou obzvláště důležité polymerázy, které kopírují sekvenci bází DNA při transkripci a replikaci DNA.
Proteiny vázající DNA

Strukturní proteiny, které vážou DNA, jsou dobře známými příklady nespecifických interakcí DNA-protein. V chromozomech je DNA držena v komplexech se strukturálními proteiny. Tyto proteiny organizují DNA do kompaktní struktury zvané chromatin. U eukaryot zahrnuje tato struktura vazbu DNA na komplex malých bazických proteinů nazývaných histony, zatímco u prokaryot je zapojeno více typů proteinů.[108][109] Histony tvoří diskovitý komplex zvaný a nukleosom, který obsahuje dva úplné závity dvouvláknové DNA omotané kolem jeho povrchu. Tyto nespecifické interakce se tvoří prostřednictvím bazických zbytků v histonech a vytvářejí se iontové vazby na kyselý cukr-fosfátový páteř DNA, a jsou tedy do značné míry nezávislé na základní sekvenci.[110] Chemické modifikace těchto bazických aminokyselinových zbytků zahrnují methylace, fosforylace, a acetylace.[111] Tyto chemické změny mění sílu interakce mezi DNA a histony, čímž činí DNA více či méně přístupnou transkripční faktory a změna rychlosti transkripce.[112] Mezi další nespecifické proteiny vázající DNA v chromatinu patří proteiny skupiny s vysokou mobilitou, které se vážou na ohnutou nebo zkreslenou DNA.[113] Tyto proteiny jsou důležité při ohýbání polí nukleosomů a jejich uspořádání do větších struktur, které tvoří chromozomy.[114]
Výraznou skupinou proteinů vázajících DNA jsou proteiny vázající DNA, které se specificky vážou na jednořetězcovou DNA. U lidí replikace protein A je nejrozumnějším členem této rodiny a používá se v procesech, kde se odděluje dvojitá šroubovice, včetně replikace DNA, rekombinace a opravy DNA.[115] Zdá se, že tyto vazebné proteiny stabilizují jednovláknovou DNA a chrání ji před tvorbou kmenové smyčky nebo být degradován nukleázy.

Naproti tomu se vyvinuly další proteiny, které se vážou na konkrétní sekvence DNA. Nejintenzivněji studované z nich jsou různé transkripční faktory, což jsou proteiny, které regulují transkripci. Každý transkripční faktor se váže na jednu konkrétní sadu sekvencí DNA a aktivuje nebo inhibuje transkripci genů, které mají tyto sekvence blízko svých promotorů. Transkripční faktory to dělají dvěma způsoby. Za prvé, mohou vázat RNA polymerázu odpovědnou za transkripci, a to buď přímo, nebo prostřednictvím jiných mediátorových proteinů; to lokalizuje polymerázu na promotoru a umožní jí zahájit transkripci.[117] Alternativně se mohou vázat transkripční faktory enzymy které modifikují histony na promotoru. Tím se změní přístupnost templátu DNA k polymeráze.[118]
Protože se tyto cíle DNA mohou vyskytovat v celém genomu organismu, mohou změny aktivity jednoho typu transkripčního faktoru ovlivnit tisíce genů.[119] V důsledku toho jsou tyto proteiny často terčem signální transdukce procesy, které řídí reakce na změny prostředí nebo buněčná diferenciace a rozvoj. Specifičnost interakcí těchto transkripčních faktorů s DNA pochází z proteinů vytvářejících více kontaktů s okraji DNA bází, což jim umožňuje „číst“ sekvenci DNA. Většina z těchto interakcí bází se provádí v hlavní drážce, kde jsou základny nejvíce přístupné.[25]

Enzymy modifikující DNA
Nukleázy a ligázy
Nukleázy jsou enzymy které štěpily řetězce DNA katalyzováním hydrolýza z fosfodiesterové vazby. Nucleases that hydrolyse nucleotides from the ends of DNA strands are called exonukleázy, zatímco endonukleázy cut within strands. The most frequently used nucleases in molekulární biologie jsou restrikční endonukleázy, which cut DNA at specific sequences. For instance, the EcoRV enzyme shown to the left recognizes the 6-base sequence 5′-GATATC-3′ and makes a cut at the horizontal line. In nature, these enzymes protect bakterie proti fág infection by digesting the phage DNA when it enters the bacterial cell, acting as part of the systém modifikace omezení.[121] In technology, these sequence-specific nucleases are used in molekulární klonování a DNA otisky prstů.
Enzymes called DNA ligázy can rejoin cut or broken DNA strands.[122] Ligases are particularly important in zaostávající vlákno DNA replication, as they join together the short segments of DNA produced at the replikační vidlice into a complete copy of the DNA template. Používají se také v Oprava DNA a genetická rekombinace.[122]
Topoisomerases and helicases
Topoizomerázy are enzymes with both nuclease and ligase activity. These proteins change the amount of supercoiling in DNA. Some of these enzymes work by cutting the DNA helix and allowing one section to rotate, thereby reducing its level of supercoiling; the enzyme then seals the DNA break.[38] Other types of these enzymes are capable of cutting one DNA helix and then passing a second strand of DNA through this break, before rejoining the helix.[123] Topoisomerases are required for many processes involving DNA, such as DNA replication and transcription.[39]
Helikázy are proteins that are a type of molekulární motor. They use the chemical energy in nukleosid trifosfáty, převážně adenosintrifosfát (ATP), to break hydrogen bonds between bases and unwind the DNA double helix into single strands.[124] These enzymes are essential for most processes where enzymes need to access the DNA bases.
Polymerázy
Polymerázy jsou enzymy that synthesize polynucleotide chains from nukleosid trifosfáty. The sequence of their products is created based on existing polynucleotide chains—which are called šablony. These enzymes function by repeatedly adding a nucleotide to the 3′ hydroxyl group at the end of the growing polynucleotide chain. As a consequence, all polymerases work in a 5′ to 3′ direction.[125] V Aktivní stránky of these enzymes, the incoming nucleoside triphosphate base-pairs to the template: this allows polymerases to accurately synthesize the complementary strand of their template. Polymerases are classified according to the type of template that they use.
In DNA replication, DNA-dependent DNA polymerázy make copies of DNA polynucleotide chains. To preserve biological information, it is essential that the sequence of bases in each copy are precisely complementary to the sequence of bases in the template strand. Many DNA polymerases have a korektura aktivita. Here, the polymerase recognizes the occasional mistakes in the synthesis reaction by the lack of base pairing between the mismatched nucleotides. If a mismatch is detected, a 3′ to 5′ exonukleáza activity is activated and the incorrect base removed.[126] In most organisms, DNA polymerases function in a large complex called the replisome that contains multiple accessory subunits, such as the DNA svorka nebo helikázy.[127]
RNA-dependent DNA polymerases are a specialized class of polymerases that copy the sequence of an RNA strand into DNA. Obsahují reverzní transkriptáza, což je virový enzyme involved in the infection of cells by retroviry, a telomeráza, which is required for the replication of telomeres.[57][128] For example, HIV reverse transcriptase is an enzyme for AIDS virus replication.[128] Telomerase is an unusual polymerase because it contains its own RNA template as part of its structure. Syntetizuje telomery at the ends of chromosomes. Telomeres prevent fusion of the ends of neighboring chromosomes and protect chromosome ends from damage.[58]
Transcription is carried out by a DNA-dependent RNA polymeráza that copies the sequence of a DNA strand into RNA. To begin transcribing a gene, the RNA polymerase binds to a sequence of DNA called a promoter and separates the DNA strands. It then copies the gene sequence into a messenger RNA transcript until it reaches a region of DNA called the terminátor, where it halts and detaches from the DNA. As with human DNA-dependent DNA polymerases, RNA polymeráza II, the enzyme that transcribes most of the genes in the human genome, operates as part of a large proteinový komplex with multiple regulatory and accessory subunits.[129]
Genetická rekombinace
 |
 |

A DNA helix usually does not interact with other segments of DNA, and in human cells, the different chromosomes even occupy separate areas in the nucleus called "chromozomová území ".[131] This physical separation of different chromosomes is important for the ability of DNA to function as a stable repository for information, as one of the few times chromosomes interact is in chromozomální crossover který se vyskytuje během sexuální reprodukce, když genetická rekombinace dojde. Chromosomal crossover is when two DNA helices break, swap a section and then rejoin.
Recombination allows chromosomes to exchange genetic information and produces new combinations of genes, which increases the efficiency of přírodní výběr and can be important in the rapid evolution of new proteins.[132] Genetic recombination can also be involved in DNA repair, particularly in the cell's response to double-strand breaks.[133]
The most common form of chromosomal crossover is homologní rekombinace, where the two chromosomes involved share very similar sequences. Non-homologous recombination can be damaging to cells, as it can produce chromozomální translokace a genetické abnormality. The recombination reaction is catalyzed by enzymes known as rekombinázy, jako RAD51.[134] The first step in recombination is a double-stranded break caused by either an endonukleáza or damage to the DNA.[135] A series of steps catalyzed in part by the recombinase then leads to joining of the two helices by at least one Křižovatka Holliday, in which a segment of a single strand in each helix is annealed to the complementary strand in the other helix. The Holliday junction is a tetrahedral junction structure that can be moved along the pair of chromosomes, swapping one strand for another. The recombination reaction is then halted by cleavage of the junction and re-ligation of the released DNA.[136] Only strands of like polarity exchange DNA during recombination. There are two types of cleavage: east-west cleavage and north–south cleavage. The north–south cleavage nicks both strands of DNA, while the east–west cleavage has one strand of DNA intact. The formation of a Holliday junction during recombination makes it possible for genetic diversity, genes to exchange on chromosomes, and expression of wild-type viral genomes.
Vývoj
DNA contains the genetic information that allows all forms of life to function, grow and reproduce. However, it is unclear how long in the 4-billion-year historie života DNA has performed this function, as it has been proposed that the earliest forms of life may have used RNA as their genetic material.[137][138] RNA may have acted as the central part of early buněčný metabolismus as it can both transmit genetic information and carry out katalýza jako část ribozymy.[139] Tento starodávný Svět RNA where nucleic acid would have been used for both catalysis and genetics may have influenced the vývoj of the current genetic code based on four nucleotide bases. This would occur, since the number of different bases in such an organism is a trade-off between a small number of bases increasing replication accuracy and a large number of bases increasing the catalytic efficiency of ribozymes.[140] However, there is no direct evidence of ancient genetic systems, as recovery of DNA from most fossils is impossible because DNA survives in the environment for less than one million years, and slowly degrades into short fragments in solution.[141] Claims for older DNA have been made, most notably a report of the isolation of a viable bacterium from a salt crystal 250 million years old,[142] but these claims are controversial.[143][144]
Building blocks of DNA (adenin, guanin a související organické molekuly ) may have been formed extraterrestrially in vesmír.[145][146][147] Complex DNA and RNA organické sloučeniny z život, počítaje v to uracil, cytosin, a tymin, have also been formed in the laboratory under conditions mimicking those found in vesmír, using starting chemicals, such as pyrimidin, nalezen v meteority. Pyrimidin, podobně polycyklické aromatické uhlovodíky (PAHs), nejvíce na uhlík bohatá chemická látka nalezená v vesmír, mohly být vytvořeny v červené obry or in interstellar kosmický prach and gas clouds.[148]
Uses in technology
Genetické inženýrství
Methods have been developed to purify DNA from organisms, such as phenol-chloroform extraction, and to manipulate it in the laboratory, such as omezení trávení a polymerázová řetězová reakce. Moderní biologie a biochemie make intensive use of these techniques in recombinant DNA technology. Rekombinantní DNA is a man-made DNA sequence that has been assembled from other DNA sequences. Oni mohou být transformovaný into organisms in the form of plazmidy or in the appropriate format, by using a virový vektor.[149] The geneticky modifikovaný organisms produced can be used to produce products such as recombinant bílkoviny, použito v lékařský výzkum,[150] or be grown in zemědělství.[151][152]
Profilování DNA
Forenzní vědci can use DNA in krev, sperma, kůže, sliny nebo vlasy nalezeno na a místo činu to identify a matching DNA of an individual, such as a perpetrator.[153] This process is formally termed Profilování DNA, také zvaný DNA otisky prstů. In DNA profiling, the lengths of variable sections of repetitive DNA, such as krátké tandemové opakování a minisatelity, are compared between people. This method is usually an extremely reliable technique for identifying a matching DNA.[154] However, identification can be complicated if the scene is contaminated with DNA from several people.[155] DNA profiling was developed in 1984 by British geneticist Sir Alec Jeffreys,[156] and first used in forensic science to convict Colin Pitchfork in the 1988 Enderby murders případ.[157]
The development of forensic science and the ability to now obtain genetic matching on minute samples of blood, skin, saliva, or hair has led to re-examining many cases. Evidence can now be uncovered that was scientifically impossible at the time of the original examination. Combined with the removal of the dvojité ohrožení law in some places, this can allow cases to be reopened where prior trials have failed to produce sufficient evidence to convince a jury. People charged with serious crimes may be required to provide a sample of DNA for matching purposes. The most obvious defense to DNA matches obtained forensically is to claim that cross-contamination of evidence has occurred. This has resulted in meticulous strict handling procedures with new cases of serious crime.
DNA profiling is also used successfully to positively identify victims of mass casualty incidents,[158] bodies or body parts in serious accidents, and individual victims in mass war graves, via matching to family members.
DNA profiling is also used in Testování otcovství DNA to determine if someone is the biological parent or grandparent of a child with the probability of parentage is typically 99.99% when the alleged parent is biologically related to the child. Normální Sekvenování DNA methods happen after birth, but there are new methods to test paternity while a mother is still pregnant.[159]
DNA enzymes or catalytic DNA
Deoxyribozymy, also called DNAzymes or catalytic DNA, were first discovered in 1994.[160] They are mostly single stranded DNA sequences isolated from a large pool of random DNA sequences through a combinatorial approach called in vitro selection or systematic evolution of ligands by exponential enrichment (SELEX). DNAzymes catalyze variety of chemical reactions including RNA-DNA cleavage, RNA-DNA ligation, amino acids phosphorylation-dephosphorylation, carbon-carbon bond formation, etc. DNAzymes can enhance catalytic rate of chemical reactions up to 100,000,000,000-fold over the uncatalyzed reaction.[161] The most extensively studied class of DNAzymes is RNA-cleaving types which have been used to detect different metal ions and designing therapeutic agents. Several metal-specific DNAzymes have been reported including the GR-5 DNAzyme (lead-specific),[160] the CA1-3 DNAzymes (copper-specific),[162] the 39E DNAzyme (uranyl-specific) and the NaA43 DNAzyme (sodium-specific).[163] The NaA43 DNAzyme, which is reported to be more than 10,000-fold selective for sodium over other metal ions, was used to make a real-time sodium sensor in cells.
Bioinformatika
Bioinformatika involves the development of techniques to store, data mine, search and manipulate biological data, including DNA sekvence nukleové kyseliny data. These have led to widely applied advances in počítačová věda, zvláště string searching algorithms, strojové učení, a teorie databáze.[164] String searching or matching algorithms, which find an occurrence of a sequence of letters inside a larger sequence of letters, were developed to search for specific sequences of nucleotides.[165] The DNA sequence may be zarovnaný with other DNA sequences to identify homologní sekvence and locate the specific mutace that make them distinct. These techniques, especially vícenásobné zarovnání sekvence, are used in studying fylogenetické relationships and protein function.[166] Data sets representing entire genomes' worth of DNA sequences, such as those produced by the Projekt lidského genomu, are difficult to use without the annotations that identify the locations of genes and regulatory elements on each chromosome. Regions of DNA sequence that have the characteristic patterns associated with protein- or RNA-coding genes can be identified by nález genů algorithms, which allow researchers to predict the presence of particular genové produkty and their possible functions in an organism even before they have been isolated experimentally.[167] Entire genomes may also be compared, which can shed light on the evolutionary history of particular organism and permit the examination of complex evolutionary events.
DNA nanotechnologie

DNA nanotechnology uses the unique molekulární rozpoznávání properties of DNA and other nucleic acids to create self-assembling branched DNA complexes with useful properties.[168] DNA is thus used as a structural material rather than as a carrier of biological information. This has led to the creation of two-dimensional periodic lattices (both tile-based and using the DNA origami method) and three-dimensional structures in the shapes of mnohostěn.[169] Nanomechanická zařízení a algorithmic self-assembly have also been demonstrated,[170] and these DNA structures have been used to template the arrangement of other molecules such as zlaté nanočástice a streptavidin bílkoviny.[171]
Historie a antropologie
Because DNA collects mutations over time, which are then inherited, it contains historical information, and, by comparing DNA sequences, geneticists can infer the evolutionary history of organisms, their fylogeneze.[172] This field of phylogenetics is a powerful tool in evoluční biologie. If DNA sequences within a species are compared, population geneticists can learn the history of particular populations. This can be used in studies ranging from ecological genetics na antropologie.
Ukládání informací
DNA as a paměťové zařízení for information has enormous potential since it has much higher storage density compared to electronic devices. However, high costs, extremely slow read and write times (latence paměti ), and insufficient spolehlivost has prevented its practical use.[173][174]
Dějiny

DNA was first isolated by the Swiss physician Friedrich Miescher who, in 1869, discovered a microscopic substance in the hnis of discarded surgical bandages. As it resided in the nuclei of cells, he called it "nuclein".[175][176] V roce 1878 Albrecht Kossel isolated the non-protein component of "nuclein", nucleic acid, and later isolated its five primary nukleové báze.[177][178]
V roce 1909 Phoebus Levene identified the base, sugar, and phosphate nucleotide unit of the RNA (then named "yeast nucleic acid").[179][180][181] In 1929, Levene identified deoxyribose sugar in "thymus nucleic acid" (DNA).[182] Levene suggested that DNA consisted of a string of four nucleotide units linked together through the phosphate groups ("tetranucleotide hypothesis"). Levene thought the chain was short and the bases repeated in a fixed order.In 1927, Nikolai Koltsov proposed that inherited traits would be inherited via a "giant hereditary molecule" made up of "two mirror strands that would replicate in a semi-conservative fashion using each strand as a template".[183][184] V roce 1928 Frederick Griffith v jeho experiment objevil to rysy of the "smooth" form of Pneumokok could be transferred to the "rough" form of the same bacteria by mixing killed "smooth" bacteria with the live "rough" form.[185][186] This system provided the first clear suggestion that DNA carries genetic information.
In 1933, while studying virgin mořský ježek vejce, Jean Brachet suggested that DNA is found in the buněčné jádro a to RNA is present exclusively in the cytoplazma. At the time, "yeast nucleic acid" (RNA) was thought to occur only in plants, while "thymus nucleic acid" (DNA) only in animals. The latter was thought to be a tetramer, with the function of buffering cellular pH.[187][188]
V roce 1937 William Astbury produced the first X-ray diffraction patterns that showed that DNA had a regular structure.[189]
V roce 1943 Oswald Avery, along with co-workers Colin MacLeod a Maclyn McCarty, identified DNA as the transformační princip, supporting Griffith's suggestion (Experiment Avery – MacLeod – McCarty ).[190] DNA's role in dědičnost was confirmed in 1952 when Alfred Hershey a Martha Chase v Hershey – Chaseův experiment showed that DNA is the genetický materiál z enterobacteria phage T2.[191]

Koncem roku 1951, Francis Crick started working with James Watson na Cavendishova laboratoř v rámci Univerzita v Cambridge. V únoru 1953 Linus Pauling a Robert Corey proposed a model for nucleic acids containing three intertwined chains, with the phosphates near the axis, and the bases on the outside.[192] V květnu 1952 Raymond Gosling a graduate student working under the supervision of Rosalind Franklin vzal Rentgenová difrakce image, labeled as "Fotografie 51 ",[193] at high hydration levels of DNA. This photo was given to Watson and Crick by Maurice Wilkins and was critical to their obtaining the correct structure of DNA. Franklin told Crick and Watson that the backbones had to be on the outside. Before then, Linus Pauling, and Watson and Crick, had erroneous models with the chains inside and the bases pointing outwards. Her identification of the vesmírná skupina for DNA crystals revealed to Crick that the two DNA strands were antiparalelní.[194]
In February 1953, Watson and Crick completed their model, which is now accepted as the first correct model of the double-helix of DNA. On 28 February 1953 Crick interrupted patrons' lunchtime at Orel hospoda in Cambridge to announce that he and Watson had "discovered the secret of life".[195]
In the 25 April 1953 issue of the journal Příroda, were published a series of five articles giving the Watson and Crick double-helix structure DNA, and evidence supporting it.[196] The structure was reported in a letter titled "MOLECULAR STRUCTURE OF NUCLEIC ACIDS A Structure for Deoxyribose Nucleic Acid", in which they said, "It has not escaped our notice that the specific pairing we have postulated immediately suggests a possible copying mechanism for the genetic material."[9] Followed by a letter from Franklin and Gosling, which was the first publication of their own X-ray diffraction data, and of their original analysis method.[42][197] Then followed a letter by Wilkins, and two of his colleagues, which contained an analysis of in vivo B-DNA X-ray patterns, and supported the presence in vivo of the Watson and Crick structure.[43]
In 1962, after Franklin's death, Watson, Crick, and Wilkins jointly received the Nobelova cena za fyziologii nebo medicínu.[198] Nobel Prizes are awarded only to living recipients. A debate continues about who should receive credit for the discovery.[199]
In an influential presentation in 1957, Crick laid out the centrální dogma molekulární biologie, which foretold the relationship between DNA, RNA, and proteins, and articulated the "adaptor hypothesis".[200] Final confirmation of the replication mechanism that was implied by the double-helical structure followed in 1958 through the Meselson – Stahlův experiment.[201] Further work by Crick and co-workers showed that the genetic code was based on non-overlapping triplets of bases, called kodony, umožňující Har Gobind Khorana, Robert W. Holley, a Marshall Warren Nirenberg to decipher the genetic code.[202] These findings represent the birth of molekulární biologie.[203]
Viz také
- Autosome – Any chromosome other than a sex chromosome
- Porovnání simulačního softwaru nukleových kyselin
- Krystalografie – scientific study of crystal structure
- Chemická knihovna kódovaná DNA
- DNA microarray
- Genetická porucha – Health problem caused by one or more abnormalities in the genome
- Genetická genealogie – The use of DNA testing in combination with traditional genealogical methods to infer relationships between individuals and find ancestors
- Haplotyp – Group of genes from one parent
- Redukční dělení buněk – Type of cell division in sexually-reproducing organisms used to produce gametes
- Nucleic acid notation – Universal notation using the Roman characters A, C, G, and T to call the four DNA nucleotides
- Sekvence nukleové kyseliny – Succession of nucleotides in a nucleic acid
- Pangenesis – former theory that inheritance was based on particles from all parts of the body
- Fosforamidit
- Ribozomální DNA
- Southern blot
- Techniky rozptylu rentgenového záření
- Xeno nukleová kyselina
Reference
- ^ "deoxyribonucleic acid". Slovník Merriam-Webster.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Molekulární biologie buňky (6. vydání). Girlanda. p. Chapter 4: DNA, Chromosomes and Genomes. ISBN 978-0-8153-4432-2. Archivováno z původního dne 14. července 2014.
- ^ Purcell A. "DNA". Basic Biology. Archivováno z původního dne 5. ledna 2017.
- ^ "Uracil". Genome.gov. Citováno 21. listopadu 2019.
- ^ Russell P (2001). iGenetika. New York: Benjamin Cummings. ISBN 0-8053-4553-1.
- ^ Saenger W (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 0-387-90762-9.
- ^ A b Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Peter W (2002). Molekulární biologie buňky (Čtvrté vydání). New York a London: Garland Science. ISBN 0-8153-3218-1. OCLC 145080076. Archivováno from the original on 1 November 2016.
- ^ Irobalieva RN, Fogg JM, Catanese DJ, Catanese DJ, Sutthibutpong T, Chen M, Barker AK, Ludtke SJ, Harris SA, Schmid MF, Chiu W, Zechiedrich L (October 2015). "Structural diversity of supercoiled DNA". Příroda komunikace. 6: 8440. Bibcode:2015NatCo...6.8440I. doi:10.1038/ncomms9440. ISSN 2041-1723. PMC 4608029. PMID 26455586.
- ^ A b C d Watson JD, Crick FH (duben 1953). "Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid" (PDF). Příroda. 171 (4356): 737–38. Bibcode:1953Natur.171..737W. doi:10.1038 / 171737a0. ISSN 0028-0836. PMID 13054692. S2CID 4253007. Archivováno (PDF) from the original on 4 February 2007.
- ^ Mandelkern M, Elias JG, Eden D, Crothers DM (October 1981). "The dimensions of DNA in solution". Journal of Molecular Biology. 152 (1): 153–61. doi:10.1016/0022-2836(81)90099-1. ISSN 0022-2836. PMID 7338906.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, et al. (Květen 2006). „Sekvence DNA a biologická anotace lidského chromozomu 1“. Příroda. 441 (7091): 315–21. Bibcode:2006 Natur.441..315G. doi:10.1038 / nature04727. PMID 16710414.
- ^ A b C Berg J, Tymoczko J, Stryer L (2002). Biochemie. W.H. Freeman a společnost. ISBN 0-7167-4955-6.
- ^ IUPAC-IUB Commission on Biochemical Nomenclature (CBN) (December 1970). "Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents. Recommendations 1970". The Biochemical Journal. 120 (3): 449–54. doi:10.1042/bj1200449. ISSN 0306-3283. PMC 1179624. PMID 5499957. Archivovány od originál dne 5. února 2007.
- ^ A b Ghosh A, Bansal M (April 2003). "A glossary of DNA structures from A to Z". Acta Crystallographica oddíl D. 59 (Pt 4): 620–26. doi:10.1107/S0907444903003251. ISSN 0907-4449. PMID 12657780.
- ^ Vytvořeno z PDB 1D65
- ^ Yakovchuk P, Protozanova E, MD Frank-Kamenetskii (2006). „Přikládání bází a párování bází k tepelné stabilitě dvojité šroubovice DNA“. Výzkum nukleových kyselin. 34 (2): 564–74. doi:10.1093 / nar / gkj454. ISSN 0305-1048. PMC 1360284. PMID 16449200.
- ^ Tropp BE (2012). Molekulární biologie (4. vydání). Sudbury, Mass.: Jones and Barlett Learning. ISBN 978-0-7637-8663-2.
- ^ Carr S (1953). "Watson-Crick Structure of DNA". Memorial University of Newfoundland. Archivováno from the original on 19 July 2016. Citováno 13. července 2016.
- ^ Verma S, Eckstein F (1998). "Modified oligonucleotides: synthesis and strategy for users". Roční přehled biochemie. 67: 99–134. doi:10.1146/annurev.biochem.67.1.99. ISSN 0066-4154. PMID 9759484.
- ^ Johnson TB, Coghill RD (1925). "Pyrimidines. CIII. The discovery of 5-methylcytosine in tuberculinic acid, the nucleic acid of the tubercle bacillus". Journal of the American Chemical Society. 47: 2838–44. doi:10.1021 / ja01688a030. ISSN 0002-7863.
- ^ Weigele P, Raleigh EA (October 2016). "Biosynthesis and Function of Modified Bases in Bacteria and Their Viruses". Chemické recenze. 116 (20): 12655–12687. doi:10.1021/acs.chemrev.6b00114. ISSN 0009-2665. PMID 27319741.
- ^ Kumar S, Chinnusamy V, Mohapatra T (2018). "Epigenetics of Modified DNA Bases: 5-Methylcytosine and Beyond". Frontiers in Genetics. 9: 640. doi:10.3389/fgene.2018.00640. ISSN 1664-8021. PMC 6305559. PMID 30619465.
- ^ Carell T, Kurz MQ, Müller M, Rossa M, Spada F (April 2018). "Non-canonical Bases in the Genome: The Regulatory Information Layer in DNA". Angewandte Chemie. 57 (16): 4296–4312. doi:10.1002/anie.201708228. PMID 28941008.
- ^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson RE (October 1980). "Crystal structure analysis of a complete turn of B-DNA". Příroda. 287 (5784): 755–58. Bibcode:1980Natur.287..755W. doi:10.1038/287755a0. PMID 7432492. S2CID 4315465.
- ^ A b Pabo CO, Sauer RT (1984). "Protein-DNA recognition". Roční přehled biochemie. 53: 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ^ Nikolova EN, Zhou H, Gottardo FL, Alvey HS, Kimsey IJ, Al-Hashimi HM (2013). "A historical account of Hoogsteen base-pairs in duplex DNA". Biopolymery. 99 (12): 955–68. doi:10.1002/bip.22334. PMC 3844552. PMID 23818176.
- ^ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub HE (April 2000). "Mechanical stability of single DNA molecules". Biofyzikální deník. 78 (4): 1997–2007. Bibcode:2000BpJ....78.1997C. doi:10.1016/S0006-3495(00)76747-6. PMC 1300792. PMID 10733978.
- ^ Chalikian TV, Völker J, Plum GE, Breslauer KJ (July 1999). "A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques". Sborník Národní akademie věd Spojených států amerických. 96 (14): 7853–58. Bibcode:1999PNAS...96.7853C. doi:10.1073/pnas.96.14.7853. PMC 22151. PMID 10393911.
- ^ deHaseth PL, Helmann JD (June 1995). "Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA". Molekulární mikrobiologie. 16 (5): 817–24. doi:10.1111/j.1365-2958.1995.tb02309.x. PMID 7476180. S2CID 24479358.
- ^ Isaksson J, Acharya S, Barman J, Cheruku P, Chattopadhyaya J (December 2004). "Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern" (PDF). Biochemie. 43 (51): 15996–6010. doi:10.1021/bi048221v. PMID 15609994. Archivováno (PDF) z původního dne 10. června 2007.
- ^ Designation of the two strands of DNA Archivováno 24. Dubna 2008 v Wayback Machine JCBN/NC-IUB Newsletter 1989. Retrieved 7 May 2008
- ^ Hüttenhofer A, Schattner P, Polacek N (May 2005). "Non-coding RNAs: hope or hype?". Trendy v genetice. 21 (5): 289–97. doi:10.1016/j.tig.2005.03.007. PMID 15851066.
- ^ Munroe SH (November 2004). "Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns". Journal of Cellular Biochemistry. 93 (4): 664–71. doi:10.1002/jcb.20252. PMID 15389973. S2CID 23748148.
- ^ Makalowska I, Lin CF, Makalowski W (February 2005). "Overlapping genes in vertebrate genomes". Výpočetní biologie a chemie. 29 (1): 1–12. doi:10.1016/j.compbiolchem.2004.12.006. PMID 15680581.
- ^ Johnson ZI, Chisholm SW (November 2004). "Properties of overlapping genes are conserved across microbial genomes". Výzkum genomu. 14 (11): 2268–72. doi:10.1101/gr.2433104. PMC 525685. PMID 15520290.
- ^ Lamb RA, Horvath CM (August 1991). "Diversity of coding strategies in influenza viruses". Trendy v genetice. 7 (8): 261–66. doi:10.1016/0168-9525(91)90326-L. PMC 7173306. PMID 1771674.
- ^ Benham CJ, Mielke SP (2005). "DNA mechanics" (PDF). Roční přehled biomedicínského inženýrství. 7: 21–53. doi:10.1146/annurev.bioeng.6.062403.132016. PMID 16004565. S2CID 1427671.
- ^ A b Champoux JJ (2001). „DNA topoizomerázy: struktura, funkce a mechanismus“ (PDF). Roční přehled biochemie. 70: 369–413. doi:10.1146/annurev.biochem.70.1.369. PMID 11395412. S2CID 18144189.
- ^ A b Wang JC (June 2002). "Buněčné role DNA topoizomeráz: molekulární perspektiva". Nature Reviews Molecular Cell Biology. 3 (6): 430–40. doi:10.1038 / nrm831. PMID 12042765. S2CID 205496065.
- ^ Basu HS, Feuerstein BG, Zarling DA, Shafer RH, Marton LJ (October 1988). "Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies". Journal of Biomolecular Structure & Dynamics. 6 (2): 299–309. doi:10.1080/07391102.1988.10507714. PMID 2482766.
- ^ Franklin RE, Gosling RG (6 March 1953). "The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content" (PDF). Acta Crystallogr. 6 (8–9): 673–77. doi:10.1107/S0365110X53001939. Archivováno (PDF) from the original on 9 January 2016.
Franklin RE, Gosling RG (1953). "The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function" (PDF). Acta Crystallogr. 6 (8–9): 678–85. doi:10.1107/S0365110X53001940. - ^ A b Franklin RE, Gosling RG (April 1953). "Molecular configuration in sodium thymonucleate" (PDF). Příroda. 171 (4356): 740–41. Bibcode:1953Natur.171..740F. doi:10.1038/171740a0. PMID 13054694. S2CID 4268222. Archivováno (PDF) z původního dne 3. ledna 2011.
- ^ A b Wilkins MH, Stokes AR, Wilson HR (April 1953). "Molecular structure of deoxypentose nucleic acids" (PDF). Příroda. 171 (4356): 738–40. Bibcode:1953Natur.171..738W. doi:10.1038/171738a0. PMID 13054693. S2CID 4280080. Archivováno (PDF) z původního dne 13. května 2011.
- ^ Leslie AG, Arnott S, Chandrasekaran R, Ratliff RL (October 1980). "Polymorphism of DNA double helices". Journal of Molecular Biology. 143 (1): 49–72. doi:10.1016/0022-2836(80)90124-2. PMID 7441761.
- ^ Baianu IC (1980). "Structural Order and Partial Disorder in Biological systems". Býk. Matematika. Biol. 42 (4): 137–41. doi:10.1007 / BF02462372. S2CID 189888972.
- ^ Hosemann R, Bagchi RN (1962). Přímá analýza difrakce hmotou. Amsterdam - New York: North-Holland Publishers.
- ^ Baianu IC (1978). "Rentgenový rozptyl částečně narušenými membránovými systémy" (PDF). Acta Crystallogr A. 34 (5): 751–53. Bibcode:1978AcCrA..34..751B. doi:10.1107 / S0567739478001540.
- ^ Wahl MC, Sundaralingam M (1997). "Krystalové struktury duplexů A-DNA". Biopolymery. 44 (1): 45–63. doi:10.1002 / (SICI) 1097-0282 (1997) 44: 1 <45 :: AID-BIP4> 3.0.CO; 2- #. PMID 9097733.
- ^ Lu XJ, Shakked Z, Olson WK (červenec 2000). "Konformační motivy ve formě A ve strukturách DNA vázaných na ligand". Journal of Molecular Biology. 300 (4): 819–40. doi:10.1006 / jmbi.2000.3690. PMID 10891271.
- ^ Rothenburg S, Koch-Nolte F, Haag F (prosinec 2001). „Methylace DNA a tvorba Z-DNA jako mediátory kvantitativních rozdílů v expresi alel“. Imunologické recenze. 184: 286–98. doi:10.1034 / j.1600-065x.2001.1840125.x. PMID 12086319. S2CID 20589136.
- ^ Oh DB, Kim YG, Rich A (prosinec 2002). „Proteiny vázající Z-DNA mohou působit jako účinné efektory genové exprese in vivo“. Sborník Národní akademie věd Spojených států amerických. 99 (26): 16666–71. Bibcode:2002PNAS ... 9916666O. doi:10.1073 / pnas.262672699. PMC 139201. PMID 12486233.
- ^ Globus N, Blandford RD (20. května 2020). "Chirální hádanka života". The Astrophysical Journal Letters. 895 (1): L11. arXiv:2002.12138. Bibcode:2020ApJ ... 895L..11G. doi:10.3847 / 2041-8213 / ab8dc6. S2CID 211532577.
- ^ Palmer J (2. prosince 2010). „Bakterie milující arsen mohou pomoci při hledání mimozemského života“. BBC novinky. Archivováno z původního dne 3. prosince 2010. Citováno 2. prosince 2010.
- ^ A b Bortman H (2. prosince 2010). „Bakterie konzumující arsen otevírají nové možnosti mimozemského života“. ProfoundSpace.org. Archivováno z původního dne 4. prosince 2010. Citováno 2. prosince 2010.
- ^ Katsnelson A (2. prosince 2010). "Mikrob pojídající arsen může předefinovat chemii života". Zprávy o přírodě. doi:10.1038 / novinky.2010.645. Archivováno z původního dne 12. února 2012.
- ^ Cressey D (3. října 2012). "'Bakterie z arsenového života přeci jen preferují fosfor “. Zprávy o přírodě. doi:10.1038 / příroda.2012.11520. S2CID 87341731.
- ^ A b Greider CW, Blackburn EH (prosinec 1985). "Identifikace specifické aktivity telomerové terminální transferázy v extraktech Tetrahymena". Buňka. 43 (2 Pt 1): 405–13. doi:10.1016/0092-8674(85)90170-9. PMID 3907856.
- ^ A b C Nugent CI, Lundblad V (duben 1998). "Reverzní transkriptáza telomerázy: komponenty a regulace". Geny a vývoj. 12 (8): 1073–85. doi:10.1101 / gad.12.8.1073. PMID 9553037.
- ^ Wright WE, Tesmer VM, Huffman KE, Levene SD, Shay JW (listopad 1997). „Normální lidské chromozomy mají na jednom konci dlouhé telomerické převisy bohaté na G“. Geny a vývoj. 11 (21): 2801–09. doi:10.1101 / gad.11.21.2801. PMC 316649. PMID 9353250.
- ^ Vytvořeno z Archivováno 17. října 2016 v Wayback Machine
- ^ A b Burge S, Parkinson GN, Hazel P, Todd AK, Neidle S (2006). "Quadruplex DNA: sekvence, topologie a struktura". Výzkum nukleových kyselin. 34 (19): 5402–15. doi:10.1093 / nar / gkl655. PMC 1636468. PMID 17012276.
- ^ Parkinson GN, Lee MP, Neidle S (červen 2002). "Krystalová struktura paralelních kvadruplexů z lidské telomerické DNA". Příroda. 417 (6891): 876–80. Bibcode:2002 Natur.417..876P. doi:10.1038 / příroda755. PMID 12050675. S2CID 4422211.
- ^ Griffith JD, Comeau L, Rosenfield S, Stansel RM, Bianchi A, Moss H, de Lange T (květen 1999). "Savčí telomery končí ve velké duplexní smyčce". Buňka. 97 (4): 503–14. CiteSeerX 10.1.1.335.2649. doi:10.1016 / S0092-8674 (00) 80760-6. PMID 10338214. S2CID 721901.
- ^ Seeman NC (listopad 2005). „DNA umožňuje kontrolu struktury hmoty v nanoměřítku“. Čtvrtletní recenze biofyziky. 38 (4): 363–71. doi:10.1017 / S0033583505004087. PMC 3478329. PMID 16515737.
- ^ Warren M. (21. února 2019). „Čtyři nová písmena DNA zdvojnásobují abecedu života“. Příroda. 566 (7745): 436. Bibcode:2019Natur.566..436W. doi:10.1038 / d41586-019-00650-8. PMID 30809059.
- ^ Hoshika S, Leal NA, Kim MJ, Kim MS, Karalkar NB, Kim HJ a kol. (22. února 2019). „Hachimoji DNA a RNA: Genetický systém s osmi stavebními kameny (paywall)“. Věda. 363 (6429): 884–887. Bibcode:2019Sci ... 363..884H. doi:10.1126 / science.aat0971. PMC 6413494. PMID 30792304.
- ^ Hu Q, Rosenfeld MG (2012). "Epigenetická regulace lidských embryonálních kmenových buněk". Frontiers in Genetics. 3: 238. doi:10.3389 / fgene.2012.00238. PMC 3488762. PMID 23133442.
- ^ Klose RJ, Bird AP (únor 2006). „Methylace genomové DNA: značka a její mediátoři“. Trendy v biochemických vědách. 31 (2): 89–97. doi:10.1016 / j.tibs.2005.12.008. PMID 16403636.
- ^ Bird A (leden 2002). „Methylační vzorce DNA a epigenetická paměť“. Geny a vývoj. 16 (1): 6–21. doi:10,1101 / gad.947102. PMID 11782440.
- ^ Walsh CP, Xu GL (2006). "Methylace cytosinu a oprava DNA". Aktuální témata v mikrobiologii a imunologii. 301: 283–315. doi:10.1007/3-540-31390-7_11. ISBN 3-540-29114-8. PMID 16570853.
- ^ Kriaucionis S, Heintz N (květen 2009). „Jaderná DNA báze 5-hydroxymethylcytosin je přítomna v Purkyňových neuronech a v mozku“. Věda. 324 (5929): 929–30. Bibcode:2009Sci ... 324..929K. doi:10.1126 / science.1169786. PMC 3263819. PMID 19372393.
- ^ Ratel D, Ravanat JL, Berger F, Wion D (březen 2006). „N6-methyladenin: druhá methylovaná báze DNA“. BioEssays. 28 (3): 309–15. doi:10.1002 / bies.20342. PMC 2754416. PMID 16479578.
- ^ Gommers-Ampt JH, Van Leeuwen F, de Beer AL, Vliegenthart JF, Dizdaroglu M, Kowalak JA, Crain PF, Borst P (prosinec 1993). „beta-D-glukosyl-hydroxymethyluracil: nová modifikovaná báze přítomná v DNA parazitického prvoka T. brucei“. Buňka. 75 (6): 1129–36. doi:10.1016 / 0092-8674 (93) 90322-H. PMID 8261512. S2CID 24801094.
- ^ Vytvořeno z PDB 1JDG
- ^ Douki T, Reynaud-Angelin A, Cadet J, Sage E (srpen 2003). „Bipyrimidinové fotoprodukty spíše než oxidační léze jsou hlavním typem poškození DNA podílejícím se na genotoxickém účinku slunečního UVA záření“. Biochemie. 42 (30): 9221–26. doi:10.1021 / bi034593c. PMID 12885257.
- ^ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget JP, Ravanat JL, Sauvaigo S (březen 1999). "Hydroxylové radikály a poškození DNA báze". Mutační výzkum. 424 (1–2): 9–21. doi:10.1016 / S0027-5107 (99) 00004-4. PMID 10064846.
- ^ Beckman KB, Ames BN (srpen 1997). „Oxidační rozpad DNA“. The Journal of Biological Chemistry. 272 (32): 19633–36. doi:10.1074 / jbc.272.32.19633. PMID 9289489.
- ^ Valerie K, Povirk LF (září 2003). „Regulace a mechanismy opravy dvouvláknových zlomů savců“. Onkogen. 22 (37): 5792–812. doi:10.1038 / sj.onc.1206679. PMID 12947387.
- ^ Johnson G (28. prosince 2010). „Odhalení prehistorických nádorů a debata“. The New York Times. Archivováno z původního dne 24. června 2017.
Kdybychom žili dost dlouho, dříve nebo později bychom všichni dostali rakovinu.
- ^ Alberts B, Johnson A, Lewis J a kol. (2002). „Zamezitelné příčiny rakoviny“. Molekulární biologie buňky (4. vydání). New York: Garland Science. ISBN 0-8153-4072-9. Archivováno z původního dne 2. ledna 2016.
Bez ohledu na okolnosti lze očekávat určitý neredukovatelný základní výskyt rakoviny: mutacím se nelze nikdy absolutně vyhnout, protože jsou nevyhnutelným důsledkem základních omezení přesnosti replikace DNA, jak je popsáno v kapitole 5. Pokud by člověk mohl žít dlouho dostatečně, je nevyhnutelné, že alespoň jedna z jeho buněk nakonec nahromadí sadu mutací dostatečných k rozvoji rakoviny.
- ^ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvořák K (2008). „Rakovina a stárnutí jako důsledky neopraveného poškození DNA“. V Kimura H, Suzuki A (eds.). Nový výzkum poškození DNA. New York: Nova Science Publishers. s. 1–47. ISBN 978-1-60456-581-2. Archivováno z původního dne 25. října 2014.
- ^ Hoeijmakers JH (říjen 2009). „Poškození DNA, stárnutí a rakovina“. The New England Journal of Medicine. 361 (15): 1475–85. doi:10.1056 / NEJMra0804615. PMID 19812404.
- ^ Freitas AA, de Magalhães JP (2011). "Přehled a hodnocení teorie poškození DNA stárnutí". Mutační výzkum. 728 (1–2): 12–22. doi:10.1016 / j.mrrev.2011.05.001. PMID 21600302.
- ^ Ferguson LR, Denny WA (září 1991). "Genetická toxikologie akridinů". Mutační výzkum. 258 (2): 123–60. doi:10.1016 / 0165-1110 (91) 90006-H. PMID 1881402.
- ^ Stephens TD, Bunde CJ, Fillmore BJ (červen 2000). "Mechanismus účinku při teratogenezi thalidomidu". Biochemická farmakologie. 59 (12): 1489–99. doi:10.1016 / S0006-2952 (99) 00388-3. PMID 10799645.
- ^ Jeffrey AM (1985). "Modifikace DNA chemickými karcinogeny". Farmakologie a terapeutika. 28 (2): 237–72. doi:10.1016/0163-7258(85)90013-0. PMID 3936066.
- ^ Braña MF, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (listopad 2001). "Interkalátory jako protinádorové léky". Současný farmaceutický design. 7 (17): 1745–80. doi:10.2174/1381612013397113. PMID 11562309.
- ^ Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG a kol. (Únor 2001). „Sekvence lidského genomu“. Věda. 291 (5507): 1304–51. Bibcode:2001Sci ... 291.1304V. doi:10.1126 / science.1058040. PMID 11181995.
- ^ Thanbichler M, Wang SC, Shapiro L (říjen 2005). „Bakteriální nukleoid: vysoce organizovaná a dynamická struktura“. Journal of Cellular Biochemistry. 96 (3): 506–21. doi:10.1002 / jcb.20519. PMID 15988757.
- ^ Wolfsberg TG, McEntyre J, Schuler GD (únor 2001). „Průvodce po návrhu lidského genomu“. Příroda. 409 (6822): 824–26. Bibcode:2001 Natur.409..824W. doi:10.1038/35057000. PMID 11236998.
- ^ Gregory TR (leden 2005). „Záhada s hodnotou C u rostlin a živočichů: přehled paralel a výzva k partnerství“. Annals of Botany. 95 (1): 133–46. doi:10.1093 / aob / mci009. PMC 4246714. PMID 15596463.
- ^ Birney E, Stamatoyannopoulos JA, Dutta A, Guigó R, Gingeras TR, Margulies EH, et al. (Červen 2007). „Identifikace a analýza funkčních prvků v 1% lidského genomu pilotním projektem ENCODE“. Příroda. 447 (7146): 799–816. Bibcode:2007Natur.447..799B. doi:10.1038 / nature05874. PMC 2212820. PMID 17571346.
- ^ Vytvořeno z PDB 1 MSW Archivováno 6. Ledna 2008 v Wayback Machine
- ^ Pidoux AL, Allshire RC (březen 2005). „Role heterochromatinu ve funkci centromery“. Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 360 (1455): 569–79. doi:10.1098 / rstb.2004.1611. PMC 1569473. PMID 15905142.
- ^ Harrison PM, Hegyi H, Balasubramanian S, Luscombe NM, Bertone P, Echols N, Johnson T, Gerstein M (únor 2002). „Molekulární fosilie v lidském genomu: identifikace a analýza pseudogenů v chromozomech 21 a 22“. Výzkum genomu. 12 (2): 272–80. doi:10,1101 / gr.207102. PMC 155275. PMID 11827946.
- ^ Harrison PM, Gerstein M (květen 2002). "Studium genomů skrz věky: proteinové rodiny, pseudogeny a vývoj proteomu". Journal of Molecular Biology. 318 (5): 1155–74. doi:10.1016 / S0022-2836 (02) 00109-2. PMID 12083509.
- ^ Albà M (2001). „Replikativní DNA polymerázy“. Genome Biology. 2 (1): RECENZES3002. doi:10.1186 / gb-2001-2-1-reviews3002. PMC 150442. PMID 11178285.
- ^ Tani K, Nasu M (2010). "Role extracelulární DNA v bakteriálních ekosystémech". Ve věci Kikuchi Y, Rykova EY (eds.). Extracelulární nukleové kyseliny. Springer. str.25 –38. ISBN 978-3-642-12616-1.
- ^ Vlassov VV, Laktionov PP, Rykova EY (červenec 2007). "Extracelulární nukleové kyseliny". BioEssays. 29 (7): 654–67. doi:10.1002 / bies.20604. PMID 17563084. S2CID 32463239.
- ^ Finkel SE, Kolter R (listopad 2001). „DNA jako živina: nová role homologů genových kompetencí bakterií“. Journal of Bacteriology. 183 (21): 6288–93. doi:10.1128 / JB.183.21.6288-6293.2001. PMC 100116. PMID 11591672.
- ^ Mulcahy H, Charron-Mazenod L, Lewenza S (listopad 2008). „Extracelulární DNA chelatuje kationty a indukuje rezistenci na antibiotika v biofilmech Pseudomonas aeruginosa“. PLOS patogeny. 4 (11): e1000213. doi:10.1371 / journal.ppat.1000213. PMC 2581603. PMID 19023416.
- ^ Berne C, Kysela DT, Brun YV (srpen 2010). „Bakteriální extracelulární DNA inhibuje usazování pohyblivých potomků v biofilmu“. Molekulární mikrobiologie. 77 (4): 815–29. doi:10.1111 / j.1365-2958.2010.07267.x. PMC 2962764. PMID 20598083.
- ^ Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS (únor 2002). "Extracelulární DNA potřebná pro tvorbu bakteriálního biofilmu". Věda. 295 (5559): 1487. doi:10.1126 / science.295.5559.1487. PMID 11859186.
- ^ Hu W, Li L, Sharma S, Wang J, McHardy I, Lux R, Yang Z, He X, Gimzewski JK, Li Y, Shi W (2012). „DNA vytváří a posiluje extracelulární matrix v biofilmech Myxococcus xanthus interakcí s exopolysacharidy“. PLOS ONE. 7 (12): e51905. Bibcode:2012PLoSO ... 751905H. doi:10.1371 / journal.pone.0051905. PMC 3530553. PMID 23300576.
- ^ Hui L, Bianchi DW (únor 2013). „Nedávný pokrok v prenatálním vyšetřování genomu lidského plodu“. Trendy v genetice. 29 (2): 84–91. doi:10.1016 / j.tig.2012.10.013. PMC 4378900. PMID 23158400.
- ^ Foote AD, Thomsen PF, Sveegaard S, Wahlberg M, Kielgast J, Kyhn LA a kol. (2012). „Zkoumání možného využití environmentální DNA (eDNA) pro genetické monitorování mořských savců“. PLOS ONE. 7 (8): e41781. Bibcode:2012PLoSO ... 741781F. doi:10.1371 / journal.pone.0041781. PMC 3430683. PMID 22952587.
- ^ „Vědci detekují suchozemská zvířata pomocí DNA v blízkých vodních útvarech“.
- ^ Sandman K, Pereira SL, Reeve JN (prosinec 1998). "Rozmanitost prokaryotických chromozomálních proteinů a původ nukleosomu". Buněčné a molekulární biologické vědy. 54 (12): 1350–64. doi:10,1007 / s000180050259. PMID 9893710. S2CID 21101836.
- ^ Dame RT (květen 2005). „Úloha proteinů asociovaných s nukleoidy v organizaci a zhutňování bakteriálního chromatinu“. Molekulární mikrobiologie. 56 (4): 858–70. doi:10.1111 / j.1365-2958.2005.04598.x. PMID 15853876. S2CID 26965112.
- ^ Luger K, Mäder AW, Richmond RK, Sargent DF, Richmond TJ (září 1997). "Krystalová struktura částice jádra nukleosomu v rozlišení 2,8 A". Příroda. 389 (6648): 251–60. Bibcode:1997 Natur.389..251L. doi:10.1038/38444. PMID 9305837. S2CID 4328827.
- ^ Jenuwein T, Allis CD (srpen 2001). „Překlad histonového kódu“ (PDF). Věda. 293 (5532): 1074–80. doi:10.1126 / science.1063127. PMID 11498575. S2CID 1883924. Archivováno (PDF) z původního dne 8. srpna 2017.
- ^ Ito T (2003). "Sestavení a přestavba nukleosomu". Aktuální témata v mikrobiologii a imunologii. 274: 1–22. doi:10.1007/978-3-642-55747-7_1. ISBN 978-3-540-44208-0. PMID 12596902.
- ^ Thomas JO (srpen 2001). „HMG1 a 2: architektonické proteiny vázající DNA“. Transakce s biochemickou společností. 29 (Pt 4): 395–401. doi:10.1042 / BST0290395. PMID 11497996.
- ^ Grosschedl R, Giese K, Pagel J (březen 1994). "HMG doménové proteiny: architektonické prvky v sestavě nukleoproteinových struktur". Trendy v genetice. 10 (3): 94–100. doi:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ^ Iftode C, Daniely Y, Borowiec JA (1999). „Replikační protein A (RPA): eukaryotický SSB“. Kritické recenze v biochemii a molekulární biologii. 34 (3): 141–80. doi:10.1080/10409239991209255. PMID 10473346.
- ^ Vytvořeno z PDB 1LMB Archivováno 6. Ledna 2008 v Wayback Machine
- ^ Myers LC, Kornberg RD (2000). "Zprostředkovatel transkripční regulace". Roční přehled biochemie. 69: 729–49. doi:10,1146 / annurev.biochem. 69.1.729. PMID 10966474.
- ^ Spiegelman BM, Heinrich R (říjen 2004). „Biologická kontrola prostřednictvím regulovaných transkripčních koaktivátorů“. Buňka. 119 (2): 157–67. doi:10.1016 / j.cell.2004.09.037. PMID 15479634.
- ^ Li Z, Van Calcar S, Qu C, Cavenee WK, Zhang MQ, Ren B (červenec 2003). „Globální transkripční regulační role c-Myc v buňkách Burkittova lymfomu“. Sborník Národní akademie věd Spojených států amerických. 100 (14): 8164–69. Bibcode:2003PNAS..100.8164L. doi:10.1073 / pnas.1332764100. PMC 166200. PMID 12808131.
- ^ Vytvořeno z PDB 1RVA Archivováno 6. Ledna 2008 v Wayback Machine
- ^ Bickle TA, Krüger DH (červen 1993). "Biologie omezení DNA". Mikrobiologické recenze. 57 (2): 434–50. doi:10.1128 / MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ A b Doherty AJ, Suh SW (listopad 2000). "Strukturální a mechanická konzervace v DNA ligázách". Výzkum nukleových kyselin. 28 (21): 4051–58. doi:10.1093 / nar / 28.21.4051. PMC 113121. PMID 11058099.
- ^ Schoeffler AJ, Berger JM (prosinec 2005). "Nedávné pokroky v porozumění vztahům mezi strukturou a funkcí v mechanismu topoizomerázy typu II". Transakce s biochemickou společností. 33 (Pt 6): 1465–70. doi:10.1042 / BST20051465. PMID 16246147.
- ^ Tuteja N, Tuteja R (květen 2004). „Rozluštění DNA helikáz. Motiv, struktura, mechanismus a funkce“ (PDF). European Journal of Biochemistry. 271 (10): 1849–63. doi:10.1111 / j.1432-1033.2004.04094.x. PMID 15128295.
- ^ Joyce CM, Steitz TA (listopad 1995). „Polymerázové struktury a funkce: variace na téma?“. Journal of Bacteriology. 177 (22): 6321–29. doi:10.1128 / jb.177.22.6321-6329.1995. PMC 177480. PMID 7592405.
- ^ Hubscher U, Maga G, Spadari S (2002). „Eukaryotické DNA polymerázy“ (PDF). Roční přehled biochemie. 71: 133–63. doi:10.1146 / annurev.biochem.71.090501.150041. PMID 12045093. S2CID 26171993.
- ^ Johnson A, O'Donnell M (2005). "Buněčné DNA repliky: komponenty a dynamika na replikační vidlici". Roční přehled biochemie. 74: 283–315. doi:10,1146 / annurev.biochem.73.011303.073859. PMID 15952889.
- ^ A b Tarrago-Litvak L, Andréola ML, Nevinsky GA, Sarih-Cottin L, Litvak S (květen 1994). „Reverzní transkriptáza HIV-1: od enzymologie k terapeutickému zásahu“. FASEB Journal. 8 (8): 497–503. doi:10.1096 / fasebj.8.8.7514143. PMID 7514143. S2CID 39614573.
- ^ Martinez E (prosinec 2002). "Víceproteinové komplexy v transkripci eukaryotických genů". Molekulární biologie rostlin. 50 (6): 925–47. doi:10.1023 / A: 1021258713850. PMID 12516863. S2CID 24946189.
- ^ Vytvořeno z PDB 1M6G Archivováno 10. ledna 2010 v Wayback Machine
- ^ Cremer T, Cremer C (duben 2001). "Chromozomová teritoria, jaderná architektura a regulace genů v savčích buňkách". Genetika hodnocení přírody. 2 (4): 292–301. doi:10.1038/35066075. PMID 11283701. S2CID 8547149.
- ^ Pál C, Papp B, Lercher MJ (květen 2006). "Integrovaný pohled na vývoj bílkovin". Genetika hodnocení přírody. 7 (5): 337–48. doi:10.1038 / nrg1838. PMID 16619049. S2CID 23225873.
- ^ O'Driscoll M, Jeggo PA (leden 2006). „Úloha opravy dvouvláknového zlomu - poznatky z lidské genetiky“. Genetika hodnocení přírody. 7 (1): 45–54. doi:10.1038 / nrg1746. PMID 16369571. S2CID 7779574.
- ^ Vispé S, Defais M (říjen 1997). "Savčí protein Rad51: homolog RecA s pleiotropními funkcemi". Biochimie. 79 (9–10): 587–92. doi:10.1016 / S0300-9084 (97) 82007-X. PMID 9466696.
- ^ Neale MJ, Keeney S (červenec 2006). „Objasnění mechaniky výměny řetězců DNA v meiotické rekombinaci“. Příroda. 442 (7099): 153–58. Bibcode:2006Natur.442..153N. doi:10.1038 / nature04885. PMC 5607947. PMID 16838012.
- ^ Dickman MJ, Ingleston SM, Sedelnikova SE, Rafferty JB, Lloyd RG, Grasby JA, Hornby DP (listopad 2002). „Řešení RuvABC“. European Journal of Biochemistry. 269 (22): 5492–501. doi:10.1046 / j.1432-1033.2002.03250.x. PMID 12423347. S2CID 39505263.
- ^ Joyce GF (červenec 2002). „Starověk evoluce založené na RNA“. Příroda. 418 (6894): 214–21. Bibcode:2002 Natur.418..214J. doi:10.1038 / 418214a. PMID 12110897. S2CID 4331004.
- ^ Orgel LE (2004). "Prebiotická chemie a původ světa RNA". Kritické recenze v biochemii a molekulární biologii. 39 (2): 99–123. CiteSeerX 10.1.1.537.7679. doi:10.1080/10409230490460765. PMID 15217990.
- ^ Davenport RJ (květen 2001). "Ribozymes. Vytváření kopií ve světě RNA". Věda. 292 (5520): 1278a – 1278. doi:10.1126 / science.292.5520.1278a. PMID 11360970. S2CID 85976762.
- ^ Szathmáry E (duben 1992). „Jaká je optimální velikost pro genetickou abecedu?“. Sborník Národní akademie věd Spojených států amerických. 89 (7): 2614–18. Bibcode:1992PNAS ... 89.2614S. doi:10.1073 / pnas.89.7.2614. PMC 48712. PMID 1372984.
- ^ Lindahl T (duben 1993). "Nestabilita a rozpad primární struktury DNA". Příroda. 362 (6422): 709–15. Bibcode:1993Natur.362..709L. doi:10.1038 / 362709a0. PMID 8469282. S2CID 4283694.
- ^ Vreeland RH, Rosenzweig WD, Powers DW (říjen 2000). „Izolace 250 milionů let staré halotolerantní bakterie z krystalu primární soli“. Příroda. 407 (6806): 897–900. Bibcode:2000Natur.407..897V. doi:10.1038/35038060. PMID 11057666. S2CID 9879073.
- ^ Hebsgaard MB, Phillips MJ, Willerslev E (květen 2005). „Geologicky starodávná DNA: skutečnost nebo artefakt?“. Trendy v mikrobiologii. 13 (5): 212–20. doi:10.1016 / j.tim.2005.03.010. PMID 15866038.
- ^ Nickle DC, Learn GH, Rain MW, Mullins JI, Mittler JE (leden 2002). „Kupodivu moderní DNA pro„ 250 milionů let starou „bakterii“. Journal of Molecular Evolution. 54 (1): 134–37. Bibcode:2002JMolE..54..134N. doi:10.1007 / s00239-001-0025-x. PMID 11734907. S2CID 24740859.
- ^ Callahan MP, Smith KE, Cleaves HJ, Ruzicka J, Stern JC, Glavin DP, House CH, Dworkin JP (srpen 2011). „Uhlíkaté meteority obsahují širokou škálu mimozemských nukleobází“. Sborník Národní akademie věd Spojených států amerických. 108 (34): 13995–98. Bibcode:2011PNAS..10813995C. doi:10.1073 / pnas.1106493108. PMC 3161613. PMID 21836052.
- ^ Steigerwald J (8. srpna 2011). „Výzkumníci NASA: Stavební bloky DNA lze vyrobit ve vesmíru“. NASA. Archivováno z původního dne 23. června 2015. Citováno 10. srpna 2011.
- ^ Zaměstnanci ScienceDaily (9. srpna 2011). „Stavební bloky DNA lze vyrobit ve vesmíru, navrhuje NASA Evidence“. ScienceDaily. Archivováno z původního dne 5. září 2011. Citováno 9. srpna 2011.
- ^ Marlaire R (3. března 2015). „NASA Ames reprodukuje stavební kameny života v laboratoři“. NASA. Archivováno z původního dne 5. března 2015. Citováno 5. března 2015.
- ^ Goff SP, Berg P (prosinec 1976). "Konstrukce hybridních virů obsahujících segmenty DNA fága SV40 a lambda a jejich šíření v kultivovaných opičích buňkách". Buňka. 9 (4 PT 2): 695–705. doi:10.1016/0092-8674(76)90133-1. PMID 189942. S2CID 41788896.
- ^ Houdebine LM (2007). "Transgenní zvířecí modely v biomedicínském výzkumu". Zaměřte se na zjišťování a ověřování recenzí a protokolů. Metody v molekulární biologii. 360. 163–202. doi:10.1385/1-59745-165-7:163. ISBN 978-1-59745-165-9. PMID 17172731.
- ^ Daniell H, Dhingra A (duben 2002). „Vícegenové inženýrství: úsvit vzrušující nové éry v biotechnologiích“. Aktuální názor na biotechnologie. 13 (2): 136–41. doi:10.1016 / S0958-1669 (02) 00297-5. PMC 3481857. PMID 11950565.
- ^ Job D (listopad 2002). "Rostlinná biotechnologie v zemědělství". Biochimie. 84 (11): 1105–10. doi:10.1016 / S0300-9084 (02) 00013-5. PMID 12595138.
- ^ Curtis C, Hereward J (29. srpna 2017). „Z místa činu do soudní síně: cesta vzorku DNA“. Konverzace. Archivováno z původního dne 22. října 2017. Citováno 22. října 2017.
- ^ Collins A, Morton NE (červen 1994). „Pravděpodobnostní poměry pro identifikaci DNA“. Sborník Národní akademie věd Spojených států amerických. 91 (13): 6007–11. Bibcode:1994PNAS ... 91.6007C. doi:10.1073 / pnas.91.13.6007. PMC 44126. PMID 8016106.
- ^ Weir BS, Triggs CM, Starling L, Stowell LI, Walsh KA, Buckleton J (březen 1997). „Interpretace směsí DNA“ (PDF). Journal of Forensic Sciences. 42 (2): 213–22. doi:10.1520 / JFS14100J. PMID 9068179. S2CID 14511630.
- ^ Jeffreys AJ, Wilson V, Thein SL (1985). „Individuální specifické„ otisky prstů “lidské DNA“. Příroda. 316 (6023): 76–79. Bibcode:1985 Natur.316 ... 76J. doi:10.1038 / 316076a0. PMID 2989708. S2CID 4229883.
- ^ Colin Pitchfork - odsouzení za první vraždu na základě důkazů DNA také očistí hlavního podezřelého Forensic Science Service zpřístupněna 23. prosince 2006
- ^ „Identifikace DNA v případech hromadného úmrtí“. Národní institut spravedlnosti. Září 2006. Archivovány od originál dne 12. listopadu 2006.
- ^ „Testy otcovské krve, které fungují brzy v těhotenství“, New York Times 20. června 2012 Archivováno 24. června 2017 v Wayback Machine
- ^ A b Breaker RR, Joyce GF (prosinec 1994). "DNA enzym, který štěpí RNA". Chemie a biologie. 1 (4): 223–29. doi:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ^ Chandra M, Sachdeva A, Silverman SK (říjen 2009). "DNA katalyzovaná sekvenčně specifická hydrolýza DNA". Přírodní chemická biologie. 5 (10): 718–20. doi:10.1038 / nchembio.201. PMC 2746877. PMID 19684594.
- ^ Carmi N, Shultz LA, Breaker RR (prosinec 1996). „In vitro selekce samoštěpících se DNA“. Chemie a biologie. 3 (12): 1039–46. doi:10.1016 / S1074-5521 (96) 90170-2. PMID 9000012.
- ^ Torabi SF, Wu P, McGhee CE, Chen L, Hwang K, Zheng N, Cheng J, Lu Y (květen 2015). „In vitro selekce DNA-enzymu specifického pro sodík a jeho aplikace v intracelulárním snímání“. Sborník Národní akademie věd Spojených států amerických. 112 (19): 5903–08. Bibcode:2015PNAS..112.5903T. doi:10.1073 / pnas.1420361112. PMC 4434688. PMID 25918425.
- ^ Baldi P Brunak S (2001). Bioinformatika: Přístup strojového učení. MIT Stiskněte. ISBN 978-0-262-02506-5. OCLC 45951728.
- ^ Gusfield D (15. ledna 1997). Algoritmy na strunách, stromech a sekvencích: Informatika a výpočetní biologie. Cambridge University Press. ISBN 978-0-521-58519-4.
- ^ Sjölander K (leden 2004). "Fylogenomický závěr molekulární funkce proteinu: pokroky a výzvy". Bioinformatika. 20 (2): 170–79. CiteSeerX 10.1.1.412.943. doi:10.1093 / bioinformatika / bth021. PMID 14734307.
- ^ Mount DM (2004). Bioinformatika: sekvence a analýza genomu (2. vyd.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 0-87969-712-1. OCLC 55106399.
- ^ Rothemund PW (březen 2006). „Skládání DNA za účelem vytvoření obrazců a vzorů v nanoměřítku“ (PDF). Příroda. 440 (7082): 297–302. Bibcode:2006 Natur.440..297R. doi:10.1038 / nature04586. PMID 16541064. S2CID 4316391.
- ^ Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W, Golas MM, Sander B, Stark H, Oliveira CL, Pedersen JS, Birkedal V, Besenbacher F, Gothelf KV, Kjems J (květen 2009). "Vlastní sestavení nanoměřítkové DNA krabice s kontrolovatelným víkem". Příroda. 459 (7243): 73–76. Bibcode:2009 Natur.459 ... 73A. doi:10.1038 / nature07971. hdl:11858 / 00-001M-0000-0010-9362-B. PMID 19424153. S2CID 4430815.
- ^ Ishitsuka Y, Ha T (květen 2009). „DNA nanotechnologie: nanomachine jde do života“. Přírodní nanotechnologie. 4 (5): 281–82. Bibcode:2009NatNa ... 4..281I. doi:10.1038 / nnano.2009.101. PMID 19421208.
- ^ Aldaye FA, Palmer AL, Sleiman HF (září 2008). "Sestavování materiálů s DNA jako vodítkem". Věda. 321 (5897): 1795–99. Bibcode:2008Sci ... 321.1795A. doi:10.1126 / science.1154533. PMID 18818351. S2CID 2755388.
- ^ Wray GA (2002). „Datování větví na stromě života pomocí DNA“. Genome Biology. 3 (1): RECENZES0001. doi:10.1186 / gb-2001-3-1-reviews0001. PMC 150454. PMID 11806830.
- ^ Panda D, Molla KA, Baig MJ, Swain A, Behera D, Dash M (květen 2018). „DNA jako zařízení pro ukládání digitálních informací: naděje nebo humbuk?“. 3 Biotech. 8 (5): 239. doi:10.1007 / s13205-018-1246-7. PMC 5935598. PMID 29744271.
- ^ Akram F, Haq IU, Ali H, Laghari AT (říjen 2018). "Trendy ukládání digitálních dat do DNA: přehled". Zprávy o molekulární biologii. 45 (5): 1479–1490. doi:10,1007 / s11033-018-4280-r. PMID 30073589. S2CID 51905843.
- ^ Miescher F (1871). „Ueber die chemische Zusammensetzung der Eiterzellen“ [O chemickém složení buněk hnisu]. Medicinisch-chemische Untersuchungen (v němčině). 4: 441–60.
Ich habe mich daher später mit meinen Versuchen an die ganzen Kerne gehalten, die Trennung der Körper, die ich einstweilen ohne weiteres Präjudiz als lösliches und unlösliches Nuclein bezeichnen will, einem günstigeren Material überlassend. (Proto jsem se ve svých experimentech následně omezil na celé jádro a ponechal na příznivější materiál separaci látek, které prozatím bez dalšího předsudku označím jako rozpustný a nerozpustný jaderný materiál („Nuclein“)
- ^ Dahm R (leden 2008). „Objevování DNA: Friedrich Miescher a raná léta výzkumu nukleových kyselin“. Genetika člověka. 122 (6): 565–81. doi:10.1007 / s00439-007-0433-0. PMID 17901982. S2CID 915930.
- ^ Vidět:
- Kossel A (1879). „Ueber Nucleïn der Hefe“ [Na nukleinu v kvasinkách]. Zeitschrift für physiologische Chemie (v němčině). 3: 284–91.
- Kossel A (1880). „Ueber Nucleïn der Hefe II“ [O nukleinu v kvasinkách, část 2]. Zeitschrift für physiologische Chemie (v němčině). 4: 290–95.
- Kossel A (1881). „Ueber die Verbreitung des Hypoxanthins im Thier- und Pflanzenreich“ [O distribuci hypoxantinů v živočišné a rostlinné říši]. Zeitschrift für physiologische Chemie (v němčině). 5: 267–71.
- Kossel A (1881). Trübne KJ (ed.). Untersuchungen über die Nucleine und ihre Spaltungsprodukte [Vyšetřování nukleinu a jeho produktů štěpení] (v němčině). Strassburg, Německo. p. 19.
- Kossel A (1882). „Ueber Xanthin und Hypoxanthin“ [O xantinu a hypoxantinu]. Zeitschrift für physiologische Chemie. 6: 422–31.
- Albrect Kossel (1883) „Zur Chemie des Zellkerns“ Archivováno 17. listopadu 2017 v Wayback Machine (O chemii buněčného jádra), Zeitschrift für physiologische Chemie, 7 : 7–22.
- Kossel A (1886). „Weitere Beiträge zur Chemie des Zellkerns“ [Další příspěvky k chemii buněčného jádra]. Zeitschrift für Physiologische Chemie (v němčině). 10: 248–64.
Na str. 264, Kossel předneseně poznamenal: Der Erforschung der quantitativen Verhältnisse der vier stickstoffreichen Basen, der Abhängigkeit ihrer Menge von den physiologischen Zuständen der Zelle, verspricht wichtige Aufschlüsse über die elementaren physiologisch-chemischen. (Studium kvantitativních vztahů čtyř dusíkatých bází - [a] závislosti jejich množství na fyziologických stavech buňky - slibuje důležitý pohled na základní fyziologicko-chemické procesy.)
- ^ Jones ME (září 1953). „Albrecht Kossel, životopisná skica“. Yale Journal of Biology and Medicine. 26 (1): 80–97. PMC 2599350. PMID 13103145.
- ^ Levene PA, Jacobs WA (1909). „Über Inosinsäure“. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 42: 1198–203. doi:10,1002 / cber.190904201196.
- ^ Levene PA, Jacobs WA (1909). „Über die Hefe-Nucleinsäure“. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 42 (2): 2474–78. doi:10,1002 / cber.190904202148.
- ^ Levene P (1919). "Struktura kvasinkové nukleové kyseliny". J Biol Chem. 40 (2): 415–24.
- ^ Cohen JS, Portugalsko FH (1974). „Hledání chemické struktury DNA“ (PDF). Connecticutská medicína. 38 (10): 551–52, 554–57. PMID 4609088.
- ^ Koltsov navrhl, aby genetická informace buňky byla zakódována do dlouhého řetězce aminokyselin. Vidět:
- Кольцов, Н. К. (12. prosince 1927). Физико-химические основы морфологии [Fyzikálně-chemický základ morfologie] (Mluvený projev). 3. celounijní setkání zoologů, anatomů a histologů (v ruštině). Leningrad, U.S.S.R.
- Přetištěno v: Кольцов, Н. К. (1928). „Физико-химические основы морфологии“ [Fyzikálně-chemický základ morfologie]. Успехи экспериментальной биологии (Advances in Experimental Biology) série B (v Rusku). 7 (1): ?.
- Přetištěno v němčině jako: Koltzoff NK (1928). „Physikalisch-chemische Grundlagen der Morphologie“ [Fyzikálně-chemický základ morfologie]. Biologisches Zentralblatt (v němčině). 48 (6): 345–69.
- V roce 1934 Koltsov tvrdil, že se replikují proteiny, které obsahují genetickou informaci buňky. Vidět: Koltzoff N (říjen 1934). "Struktura chromozomů ve slinných žlázách Drosophila". Věda. 80 (2075): 312–13. Bibcode:1934Sci .... 80..312K. doi:10.1126 / science.80.2075.312. PMID 17769043.
Ze strany 313: „Myslím, že velikost chromozomů ve slinných žlázách [Drosophila] je určena množením genonémy. Tímto termínem označuji axiální nit chromozomu, ve které genetici lokalizují lineární kombinaci genů; … V normálním chromozomu je obvykle pouze jeden genoném; před buněčným dělením se tento genoném rozdělil do dvou řetězců. “
- ^ Soyfer VN (září 2001). „Důsledky politické diktatury pro ruskou vědu“. Genetika hodnocení přírody. 2 (9): 723–29. doi:10.1038/35088598. PMID 11533721. S2CID 46277758.
- ^ Griffith F (leden 1928). „Význam pneumokokových typů“. The Journal of Hygiene. 27 (2): 113–59. doi:10.1017 / S0022172400031879. PMC 2167760. PMID 20474956.
- ^ Lorenz MG, Wackernagel W (září 1994). „Přenos bakteriálních genů přirozenou genetickou transformací v prostředí“. Mikrobiologické recenze. 58 (3): 563–602. doi:10.1128 / MMBR.58.3.563-602.1994. PMC 372978. PMID 7968924.
- ^ Brachet J (1933). „Recherches sur la synthese de l'acide thymonucleique pendant le developpement de l'oeuf d'Oursin“. Archivy de Biologie (v italštině). 44: 519–76.
- ^ Burian R (1994). „Cytochemická embryologie Jeana Bracheta: souvislosti s obnovou biologie ve Francii?“ (PDF). V Debru C, Gayon J, Picard JF (eds.). Les sciences biologiques et médicales en France 1920–1950. Cahiers nalít I'histoire de la recherche. 2. Paříž: edice CNRS. 207–20.
- ^ Vidět:
- Astbury WT, Bell FO (1938). „Některý nedávný vývoj v rentgenové studii proteinů a souvisejících struktur“ (PDF). Cold Spring Harbor Symposia o kvantitativní biologii. 6: 109–21. doi:10,1101 / sqb.1938.006.01.013. Archivovány od originál (PDF) dne 14. července 2014.
- Astbury WT (1947). „Rentgenové studie nukleových kyselin“. Sympózia Společnosti pro experimentální biologii (1): 66–76. PMID 20257017. Archivovány od originál dne 5. července 2014.
- ^ Avery OT, Macleod CM, McCarty M (únor 1944). „Studie o chemické povaze látky vyvolávající transformaci pneumokokových typů: indukce transformace frakcí desoxyribonukleové kyseliny izolované z pneumokoka typu III“. The Journal of Experimental Medicine. 79 (2): 137–58. doi:10.1084 / jem.79.2.137. PMC 2135445. PMID 19871359.
- ^ Hershey AD, Chase M (květen 1952). "Nezávislé funkce virového proteinu a nukleové kyseliny v růstu bakteriofága". The Journal of General Physiology. 36 (1): 39–56. doi:10.1085 / jgp.36.1.39. PMC 2147348. PMID 12981234.
- ^ Pauling L, Corey RB (únor 1953). „Navrhovaná struktura nukleových kyselin“. Sborník Národní akademie věd Spojených států amerických. 39 (2): 84–97. Bibcode:1953PNAS ... 39 ... 84P. doi:10.1073 / pnas.39.2.84. PMC 1063734. PMID 16578429.
- ^ Rentgenový obrazec B-DNA napravo od tohoto propojeného obrázku Archivováno 25. května 2012 v Archiv. Dnes
- ^ Schwartz J (2008). Ve snaze o gen: od Darwina po DNA. Cambridge, Massachusetts: Harvard University Press.
- ^ Regis E (2009). Co je život?: Zkoumání podstaty života ve věku syntetické biologie. Oxford: Oxford University Press. p. 52. ISBN 978-0-19-538341-6.
- ^ „Double Helix of DNA: 50 Years“. Přírodní archivy. Archivovány od originál dne 5. dubna 2015.
- ^ „Originální rentgenový difrakční obraz“. Oregonská státní knihovna. Archivováno z původního dne 30. ledna 2009. Citováno 6. února 2011.
- ^ „Nobelova cena za fyziologii nebo medicínu 1962“. Nobelprize.org.
- ^ Maddox B (leden 2003). „Dvojitá spirála a‚ poškozená hrdinka'" (PDF). Příroda. 421 (6921): 407–08. Bibcode:2003 Natur.421..407M. doi:10.1038 / nature01399. PMID 12540909. S2CID 4428347. Archivováno (PDF) z původního dne 17. října 2016.
- ^ Crick F (1955). Poznámka pro RNA Tie Club (PDF) (Mluvený projev). Cambridge, Anglie. Archivovány od originál (PDF) dne 1. října 2008.
- ^ Meselson M, Stahl FW (červenec 1958). „Replikace DNA v Escherichia Coli“. Sborník Národní akademie věd Spojených států amerických. 44 (7): 671–82. Bibcode:1958PNAS ... 44..671M. doi:10.1073 / pnas.44.7.671. PMC 528642. PMID 16590258.
- ^ „Nobelova cena za fyziologii nebo medicínu 1968“. Nobelprize.org.
- ^ Pray L (2008). "Objev struktury a funkce DNA: Watson a Crick". Přírodní výchova. 1 (1): 100.
Další čtení
- Berry A, Watson J. (2003). DNA: tajemství života. New York: Alfred A. Knopf. ISBN 0-375-41546-7.
- Calladine CR, Drew HR, Luisi BF, Travers AA (2003). Porozumění DNA: molekula a jak funguje. Amsterdam: Elsevier Academic Press. ISBN 0-12-155089-3.
- Carina D, Clayton J (2003). 50 let DNA. Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6.
- Judson HF (1979). Osmý den stvoření: Tvůrci revoluce v biologii (2. vyd.). Cold Spring Harbor Laboratory Press. ISBN 0-671-22540-5.
- Olby RC (1994). Cesta k dvojité šroubovici: objev DNA. New York: Dover Publications. ISBN 0-486-68117-3., poprvé publikováno v říjnu 1974 MacMillanem, s předmluvou Francisa Cricka; definitivní učebnice DNA, revidovaná v roce 1994 s 9stránkovým postscriptem
- Micklas D (2003). Věda o DNA: První kurz. Cold Spring Harbor Press. ISBN 978-0-87969-636-8.
- Ridley M (2006). Francis Crick: objevitel genetického kódu. Ashland, OH: Eminent Lives, Atlas Books. ISBN 0-06-082333-X.
- Olby RC (2009). Francis Crick: Životopis. Plainview, NY: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-798-3.
- Rosenfeld I (2010). DNA: Grafický průvodce molekulou, která otřásla světem. Columbia University Press. ISBN 978-0-231-14271-7.
- Schultz M, Cannon Z (2009). Věc života: Grafický průvodce genetikou a DNA. Hill a Wang. ISBN 978-0-8090-8947-5.
- Stent GS, Watson J (1980). Double Helix: Osobní účet objevu struktury DNA. New York: Norton. ISBN 0-393-95075-1.
- Watson J (2004). DNA: The Secret of Life. Random House. ISBN 978-0-09-945184-6.
- Wilkins M (2003). Třetí muž dvojité šroubovice autobiografie Maurice Wilkinse. Cambridge, Anglie: University Press. ISBN 0-19-860665-6.
externí odkazy
| Prostředky knihovny o DNA |
- DNA na Curlie
- Predikce vazebného místa DNA na proteinu
- DNA The Double Helix Game Z oficiálního webu Nobelovy ceny
- DNA pod elektronovým mikroskopem
- Dolan DNA Learning Center
- Double Helix: 50 let DNA, Příroda
- Proteopedia DNA
- Proteopedia Forms_of_DNA
- Průzkumník vláken ENCODE Domovská stránka ENCODE. Příroda
- Double Helix 1953–2003 Národní centrum pro biotechnologické vzdělávání
- Moduly genetického vzdělávání pro učitele – DNA od začátku Studijní průvodce
- PDB Molekula měsíce DNA
- Byla nalezena stopa k chemii dědičnosti The New York Times Červen 1953. První americké zpravodajství o objevu struktury DNA
- Olby R. (Leden 2003). „Tichý debut pro dvojitou šroubovici“. Příroda. 421 (6921): 402–05. Bibcode:2003 Natur.421..402O. doi:10.1038 / nature01397. PMID 12540907.
- DNA od začátku Další web DNA Learning Center o DNA, genech a dědičnosti od Mendela po projekt lidského genomu.
- Registr osobních papírů Francise Cricka 1938-2007 v Mandeville Special Collections Library, University of California, San Diego
- Sedmistránkový ručně psaný dopis, který Crick poslal svému 12letému synovi Michaelovi v roce 1953 a který popisoval strukturu DNA. Vidět Crickova medaile jde pod kladivo, Příroda, 5. dubna 2013.

