Arylcyklohexylamin - Arylcyclohexylamine
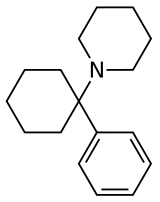
Arylcyklohexylaminy, také známý jako arylcyklohexaminy nebo arylcyklohexanaminy, plocha chemická třída z farmaceutické, návrhář, a experimentální léky.
Dějiny
Fencyklidin (PCP) je považován za první arylcyklohexylamin s uznávanými anestetickými vlastnostmi, ale před PCP bylo ve vědecké literatuře popsáno několik arylcyklohexylaminů, počínaje PCA (1-fenylcyklohexan-1-amin), jehož syntéza byla poprvé publikována v roce 1907. PCE byl hlášen v roce 1953 a PCMo v roce 1954, přičemž druhá sloučenina byla popsána jako silné sedativum.[1] Arylcyklohexylaminová anestetika byla intenzivně zkoumána v Parke-Davis, počínaje syntézou z roku 1956 fencyklidin a později příbuzná sloučenina ketamin.[1] V sedmdesátých letech došlo k debutu těchto sloučenin, zejména PCP a jeho analogy, jak bylo nezákonně použito rekreační drogy kvůli jejich disociativní halucinogenní a euforický účinky. Od té doby byla třída rozšířena o vědecký výzkum do povzbuzující, analgetikum, a neuroprotektivní agenti, a také tajný chemici při hledání románu rekreační drogy.[2][3][4]
Struktura

Arylcyklohexylamin je složen z a cyklohexylamin jednotka s aryl skupina příloha. Arylová skupina je umístěna geminal do amin. V nejjednodušších případech je arylovou částí typicky a fenylový kruh, někdy s další substitucí. Amin obvykle není hlavní; sekundární aminy, jako je methylamino nebo ethylamino, nebo terciární cykloalkylaminy, jako je piperidino a pyrrolidino, se vyskytují nejčastěji N-substituenty.
Farmakologie
Arylcyklohexylaminy mají různé vlastnosti NMDA receptor antagonistický,[5][6] inhibiční zpětné vychytávání dopaminu,[7] a μ-opioidní receptor agonistický[8] vlastnosti. Dodatečně, σ receptor agonistický,[9] nACh receptor antagonistický,[10] a D2 receptor agonistický[11] u některých z těchto agentů byly hlášeny akce. Antagonismus NMDA receptoru poskytuje anestetické, antikonvulzivní, neuroprotektivní a disociační účinky; blokáda transportér dopaminu zprostředkovává stimulační a euforické účinky a také psychóza ve vysokých množstvích; a aktivace μ-opioidního receptoru způsobuje analgetické a euforické účinky. Stimulace σ a D2 receptory mohou také přispívat k halucinogenním a psychotomimetickým účinkům.[11]
Jedná se o univerzální látky se širokou škálou možných farmakologických aktivit v závislosti na rozsahu a rozsahu, v němž jsou prováděny chemické modifikace.[12][13][14][15][16][17][18][19][20] Různý výběr substitucí, které se provádějí, umožňuje „jemné doladění“ výsledného farmakologického profilu. Jako příklady, BTCP je selektivní inhibitor zpětného vychytávání dopaminu,[7] PCP je primárně antagonista NMDA,[5] a BDPC je silný μ-opioidní agonista,[21] zatímco PRE-084 je selektivní sigma receptor agonista.[22] Díky různým strukturním kombinacím je tedy možná radikálně odlišná farmakologie.
Seznam arylcyklohexylaminů
| Struktura | Sloučenina | Aryl Substituent | N Group | Cyklohexylový kruh |
|---|---|---|---|---|
 | PCA[23] | Fenyl | NH2 | - |
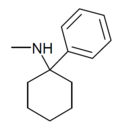 | PCM[23] | Fenyl | Methylamino | - |
 | Eticyklidin | Fenyl | Ethylamino | - |
 | PCPr [24] | Fenyl | n-Propylamino | - |
 | PCiP | Fenyl | Isopropylamino | - |
 | PCAL [25] | Fenyl | Allylamino | - |
 | PCBu | Fenyl | n-Butylamino | - |
 | PCEOH | Fenyl | Hydroxyethylamino | - |
 | PCMEA[26] | Fenyl | Methoxyethylamino | - |
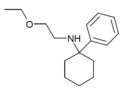 | PCEEA | Fenyl | Ethoxyethylamino | - |
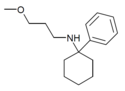 | PCMPA | Fenyl | Methoxypropylamino | - |
 | PCDM[23] | Fenyl | Dimethylamino | - |
 | Dieticyklidin | Fenyl | Diethylamino | - |
 | 2-HO-PCP[5] | Fenyl | Piperidin | 2-hydroxy |
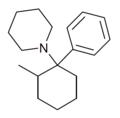 | 2-Me-PCP[27] | Fenyl | Piperidin | 2-methyl |
 | 2-MeO-PCP[28] | Fenyl | Piperidin | 2-methoxy |
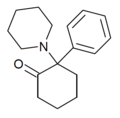 | 2-Keto-PCP | Fenyl | Piperidin | 2-keto |
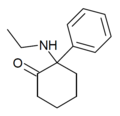 | Eticyclidone („O-PCE“) | Fenyl | Ethylamino | 2-keto |
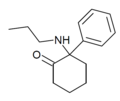 | 2-Keto-PCPr | Fenyl | n-Propylamino | 2-keto |
 | 4-Methyl-PCP | Fenyl | Piperidin | 4-methyl |
 | 4-Keto-PCP | Fenyl | Piperidin | 4-keto |
 | 2'-Cl-PCP | Ó-Chlorfenyl | Piperidin | - |
 | 3'-Cl-PCP | m-Chlorfenyl | Piperidin | - |
 | 2'-MeO-PCP | Ó-Methoxyfenyl | Piperidin | - |
 | 3'-F-PCP[29] | m-Fluorfenyl | Piperidin | - |
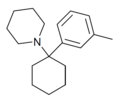 | 3'-Me-PCP[30] | m-Tolyl | Piperidin | - |
 | 3'-Me-PCPy | m-Tolyl | Pyrrolidin | - |
 | 3'-NH2-PCP | m-Aminofenyl | Piperidin | - |
 | 3'-HO-PCP | m-Hydroxyfenyl | Piperidin | - |
 | 3'-MeO-PCP | m-Methoxyfenyl | Piperidin | - |
 | 3 ', 4'-MD-PCP | 3,4-methylendioxyfenyl | Piperidin | - |
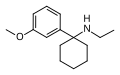 | 3'-MeO-PCE | m-Methoxyfenyl | Ethylamino | - |
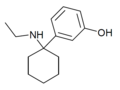 | 3'-HO-PCE | m-Hydroxyfenyl | Ethylamino | - |
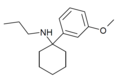 | 3'-MeO-PCPr | m-Methoxyfenyl | n-Propylamino | - |
 | 3'-HO-PCPr | m-Hydroxyfenyl | n-Propylamino | - |
 | 3 ', 4'-MD-PCPr | 3,4-methylendioxyfenyl | n-Propylamino | - |
 | 3'-MeO-PCPy[30] | m-Methoxyfenyl | Pyrrolidin | - |
 | 4'-HO-PCP | p-Hydroxyfenyl | Piperidin | - |
 | Methoxydin (4'-MeO-PCP) | p-Methoxyfenyl | Piperidin | - |
 | 4'-MeO-PCE | p-Methoxyfenyl | Ethylamino | - |
 | 4'-F-PCP[29] | p-Fluorfenyl | Piperidin | - |
 | 4'-F-PCPy | p-Fluorfenyl | Pyrrolidin | - |
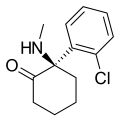 | Arketamin | Ó-Chlorfenyl | Methylamino | 2-keto |
 | Deschloroketamin | Fenyl | Methylamino | 2-keto |
 | Esketamin | Ó-Chlorfenyl | Methylamino | 2-keto |
 | Ketamin | Ó-Chlorfenyl | Methylamino | 2-keto |
 | Hydroxynorketamin | Ó-Chlorfenyl | NH2 | 2-Keto, 6-hydroxy |
 | Ethketamin | Ó-Chlorfenyl | Ethylamino | 2-keto |
 | NPNK | Ó-Chlorfenyl | n-Propylamino | 2-keto |
 | Methoxyketamin | Ó-Methoxyfenyl | Methylamino | 2-keto |
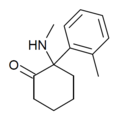 | oMDCK | Ó-Tolyl | Methylamino | 2-keto |
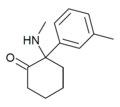 | mMDCK | m-Tolyl | Methylamino | 2-keto |
 | meta-Ketamin | m-Chlorfenyl | Methylamino | 2-keto |
 | iso-Ketamin | Ó-Chlorfenyl | Methylamino | 4-keto |
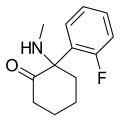 | 2-Fluorodeschloroketamin | Ó-Fluorfenyl | Methylamino | 2-keto |
 | 3-Fluorodeschloroketamin | m-Fluorfenyl | Methylamino | 2-keto |
 | Bromoketamin | Ó-Bromfenyl | Methylamino | 2-keto |
 | TFMDCK | Ó-Trifluormethylfenyl | Methylamino | 2-keto |
 | SN 35210 [31] | Ó-Chlorfenyl | Karbomethoxybutylamino | 2-keto |
 | Methoxetamin | m-Methoxyfenyl | Ethylamino | 2-keto |
 | Methoxmetamin | m-Methoxyfenyl | Methylamino | 2-keto |
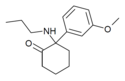 | Methoxpropamin | m-Methoxyfenyl | n-Propylamino | 2-keto |
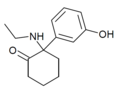 | HXE | m-Hydroxyfenyl | Ethylamino | 2-keto |
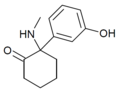 | HXM | m-Hydroxyfenyl | Methylamino | 2-keto |
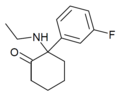 | FXE | m-Fluorfenyl | Ethylamino | 2-keto |
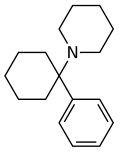 | Fencyklidin (PCP) | Fenyl | Piperidin | - |
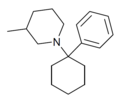 | PC3MP | Fenyl | 3-methylpiperidin | - |
 | PC4MP | Fenyl | 4-methylpiperidin | - |
 | Rolicyklidin (PCPy) | Fenyl | Pyrrolidin | - |
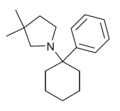 | PCDMPy | Fenyl | 3,3-dimethylpyrrolidin | - |
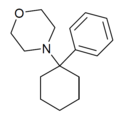 | PCMo | Fenyl | Morfolin | - |
 | Methoxy-PCM[6] (2'-MeO-PCMo) | Ó-Methoxyfenyl | Morfolin | - |
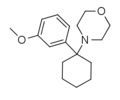 | 3'-MeO-PCMo | m-Methoxyfenyl | Morfolin | - |
 | 4'-MeO-PCMo | p-Methoxyfenyl | Morfolin | - |
 | Methyl-PCM[32] (4'-Me-PCMo) | p-Tolyl | Morfolin | - |
 | Hydroxy-methyl-PCM | 2-methyl-4-hydroxyfenyl | Morfolin | - |
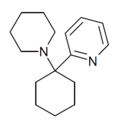 | PYCP [33] | 2-pyridinyl | Piperidin | - |
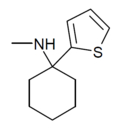 | TCM | 2-thienyl | Methylamino | - |
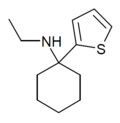 | TCE | 2-thienyl | Ethylamino | - |
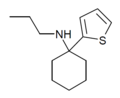 | TCPr [34] | 2-thienyl | Propylamino | - |
 | Tenocyklidin (TCP) | 2-thienyl | Piperidin | - |
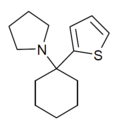 | TCPy | 2-thienyl | Pyrrolidin | - |
 | Tiletamin | 2-thienyl | Ethylamino | 2-keto |
 | Gacyklidin | 2-thienyl | Piperidin | 2-methyl |
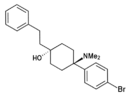 | BDPC | p-Bromfenyl | Dimethylamino | 4-fenetyl-4-hydroxy |
 | C-8813 | p-Bromfenyl | Dimethylamino | 4- (thiofen-2-yl) ethyl-4-hydroxy |
 | Dimetamin [35] | p-Tolyl | Dimethylamino | 4-keto |
 | 3 '' - OH-2'-Me-PCP [36] | Ó-Tolyl | 3-Hydroxypiperidin | - |
 | 4 '' - Ph-4 '' - OH-PCP [37] | Fenyl | 4-fenyl-4-hydroxypiperidin | - |
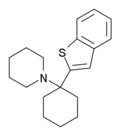 | BTCP[38] | Benzothiofen-2-yl | Piperidin | - |
 | BTCPy[39] | Benzothiofen-2-yl | Pyrrolidin | - |
 | PRE-084 | Fenyl | Morfolinylethylkarboxylát | - |
Byly experimentovány i jiné velikosti cykloalkanových kruhů, než jen čistě myšlení ve smyslu cyklohexylaminu. Cyklopentylový homolog PCP je aktivní s přibližně 1/10 účinnosti, zatímco cykloheptylové a cyklooktylové deriváty jsou neaktivní. Potřebný cykloalkylketon reaguje s PhMgBr; 3 ° alkohol poté reaguje s NaN3; azid pak redukován s LAH. Pak se v posledním kroku vytvoří piperidinový kruh s 1-5-dibrompentanem.[40]
Tuhý
Konformačně omezený analogy byly také připraveny a zkoumány Morieti et al.[41]
Reference
- ^ A b Morris, H .; Wallach, J. (2014). „Od PCP k MXE: komplexní přehled nelékařského použití disociačních léků“. Testování a analýza drog. 6 (7–8): 614–32. doi:10.1002 / dta.1620. PMID 24678061.
- ^ Valter K, Arrizabalaga P. Designer Drugs Directory. Elsevier, 1998. ISBN 0-444-20525-X
- ^ Wallach J, Brandt SD (srpen 2018). „Nové psychoaktivní látky na bázi fencyklidinu“. Nové psychoaktivní látky. Příručka experimentální farmakologie. 252. 261–303. doi:10.1007/164_2018_124. ISBN 978-3-030-10560-0. PMID 30105474.
- ^ Wallach, Jason; Brandt, Simon D. (2018). „Nové psychoaktivní látky na bázi 1,2-diarylethylaminu a ketaminu“. Nové psychoaktivní látky. Příručka experimentální farmakologie. 252. 305–352. doi:10.1007/164_2018_148. ISBN 978-3-030-10560-0. PMID 30196446.
- ^ A b C Ahmadi, A .; Mahmoudi, A. (2005). "Syntéza a biologické vlastnosti 2-hydroxy-1- (1-fenyltetralyl) piperidinu a některých jeho meziproduktů jako derivátů fencyklidinu". Arzneimittel-Forschung. 55 (9): 528–532. doi:10.1055 / s-0031-1296900. PMID 16229117.
- ^ A b Ahmadi, A .; Khalili, M .; Hajikhani, R .; Naserbakht, M. (2011). "Nové morfolinové analogy fencyklidinu: Chemická syntéza a vnímání bolesti u potkanů". Farmakologická biochemie a chování. 98 (2): 227–233. doi:10.1016 / j.pbb.2010.12.019. PMID 21215770.
- ^ A b Chaudieu, I .; Vignon; Chicheportiche; Kamenka; Trouiller; Chicheportiche (1989). "Role aromatické skupiny při inhibici vazby fencyklidinu a absorpce dopaminu pomocí analogů PCP". Farmakologická biochemie a chování. 32 (3): 699–705. doi:10.1016/0091-3057(89)90020-8. PMID 2544905.
- ^ Itzhak, Y .; Simon (1984). "Nový fencyklidinový analog interaguje selektivně s mu opioidními receptory". The Journal of Pharmacology and Experimental Therapeutics. 230 (2): 383–386. PMID 6086884.
- ^ On, X. S .; Raymon, L. P .; Mattson, M. V .; Eldefrawi, M. E .; De Costa, B. R. (1993). „Syntéza a biologické hodnocení 1-1- (2-benzobthienyl) cyklohexylpiperidinových homologů při absorpci dopaminu a fencyklidin- a sigma-vazebných místech“. Journal of Medicinal Chemistry. 36 (9): 1188–1193. doi:10.1021 / jm00061a009. PMID 8098066.
- ^ Eterović, V. A .; Lu, R .; Eakin, A.E .; Rodríguez, A. D .; Ferchmin, P. A. (1999). "Determinanty potence fencyklidinu na nikotinové acetylcholinové receptory ze svalu a elektrického orgánu". Buněčná a molekulární neurobiologie. 19 (6): 745–757. doi:10.1023 / A: 1006905106834. PMID 10456235.
- ^ A b Seeman, P .; Ko, F .; Tallerico, T. (2005). „Příspěvek dopaminových receptorů k působení PCP, LSD a ketaminových psychotomimetik“. Molekulární psychiatrie. 10 (9): 877–883. doi:10.1038 / sj.mp.4001682. PMID 15852061.
- ^ al-Deeb, OA (květen 1996). "Nová analgetika odvozená od fencyklidinového analogu thienylcyklidinu". Arzneimittelforschung. 46 (5): 505–8. PMID 8737636.
- ^ Ahmadi, A; Khalili, M; Hajikhani, R; Hosseini, H; Afshin, N; Nahri-Niknafs, B (2012). "Syntéza a studium analgetických účinků nových analogů ketaminu na samice potkanů wistar". Léčivá chemie. 8 (2): 246–51. doi:10.2174/157340612800493683. PMID 22385170. S2CID 42842315.
- ^ Ahmadi, A; Khalili, M; Abbassi, S; Javadi, M; Mahmoudi, A; Hajikhani, R (2009). "Syntéza a studie o analgetických účincích 1-1- (4-methylfenyl) (cyklohexyl) 4-piperidinolu a 1-1- (4-methoxyfenyl) (cyklohexyl) 4-piperidinolu jako dvou nových fencyklidinových derivátů". Arzneimittel-Forschung. 59 (4): 202–6. doi:10.1055 / s-0031-1296386. PMID 19517897. S2CID 5402425.
- ^ Ahmadi, A; Khalili, M; Marami, S; Ghadiri, A; Nahri-Niknafs, B (2014). "Syntéza a vnímání bolesti nových analogů fencyklidinu u samců myší NMRI". Mini recenze v medicinální chemii. 14 (1): 64–71. doi:10.2174/1389557513666131119203551. PMID 24251803.
- ^ Ahmadi, A; Solati, J; Hajikhani, R; Pakzad, S (2011). "Syntéza a analgetické účinky nových pyrrolových derivátů fencyklidinu u myší". Arzneimittel-Forschung. 61 (5): 296–300. doi:10.1055 / s-0031-1296202. PMID 21755813. S2CID 24287727.
- ^ Ahmadi, A; Khalili; Hajikhani; Barghi; Mihandoust (2010). "Syntéza a stanovení chronických a akutních aktivit tepelné a chemické bolesti nového derivátu fencyklidinu u potkanů". Iranian Journal of Pharmaceutical Research. 9 (4): 379–85. PMC 3870061. PMID 24381602.
- ^ Ahmadi, A; Khalili, M; Mihandoust, F; Barghi, L (2010). "Syntéza a stanovení aktivit akutní a chronické bolesti 1-1- (3-methylfenyl) (tetralyl) piperidinu jako nového derivátu fencyklidinu pomocí ponoření do ocasu a formalinových testů". Arzneimittel-Forschung. 60 (1): 30–5. doi:10.1055 / s-0031-1296245. PMID 20184224. S2CID 23966936.
- ^ Hajikhani, R; Ahmadi, A; Naderi, N; Yaghoobi, K; Shirazizand, Z; Rezaee, N. M .; Niknafs, B. N. (2012). „Vliv derivátů fencyklidinu na chování podobné úzkosti pomocí testu bludiště se zvýšenými plusy u myší“. Pokroky v klinické a experimentální medicíně. 21 (3): 307–12. PMID 23214193.
- ^ Ahmadi, A; Khalili, M; Mirza, B; Mohammadi-Diz, M; Azami-Lorestani, F; Ghaderi, P; Nahri-Niknafs, B (2017). "Syntéza a antinocicepční aktivity některých nových derivátů fencyklidinu se substituovanými aminobenzothiazoly". Mini Rev Med Chem. 17 (1): 78–84. doi:10.2174/1389557516666160428112532. PMID 27121715.
- ^ Lednicer, D .; Vonvoigtlander, P. F. (1979). „4- (p-Bromfenyl) -4- (dimethylamino) -1-fenethylcyklohexanol, mimořádně účinný zástupce nové analgetické řady“. Journal of Medicinal Chemistry. 22 (10): 1157–1158. doi:10.1021 / jm00196a001. PMID 513062.
- ^ Maurice, T .; Su, T. P .; Parish, D. W .; Nabeshima, T .; Privat, A. (1994). „PRE-084, sigma selektivní derivát PCP, tlumí poruchu učení u myší vyvolanou MK-801“. Farmakologická biochemie a chování. 49 (4): 859–869. doi:10.1016/0091-3057(94)90235-6. PMID 7886099.
- ^ A b C Thurkauf, A .; De Costa, B .; Yamaguchi, S .; Mattson, M. V .; Jacobson, A.E .; Rice, K. C .; Rogawski, M. A. (1990). "Syntéza a antikonvulzivní aktivita analogů 1-fenylcyklohexylaminu". Journal of Medicinal Chemistry. 33 (5): 1452–8. doi:10.1021 / jm00167a027. PMID 2329567.
- ^ Sauer, C .; Peters, F .; Staack, R .; Fritschi, G .; Maurer, H. (2008). „Metabolismus a toxikologická detekce nového značkového léčiva, N- (1-fenylcyklohexyl) propanaminu, v moči potkana pomocí plynové chromatografie - hmotnostní spektrometrie“. Journal of Chromatography A. 1186 (1–2): 380–390. doi:10.1016 / j.chroma.2007.11.002. PMID 18035363.
- ^ Kalir, A; Teomy, S; Amir, A; Fuchs, P; Lee, SA; Holsztynska, EJ; Rocki, W; Domino, EF (říjen 1984). "N-allylové analogy fencyklidinu: chemická syntéza a farmakologické vlastnosti". J Med Chem. 27 (10): 1267–71. doi:10.1021 / jm00376a006. PMID 6481761.
- ^ Sauer, C .; Peters, F .; Schwaninger, A .; Meyer, M .; Maurer, H. (2009). „Vyšetřování izoenzymů cytochromu P450 (CYP) zapojených do metabolismu návrhových léčiv N- (1-fenylcyklohexyl) -2-ethoxyethanamin a N- (1-fenylcyklohexyl) -2-methoxyethanamin“. Biochemická farmakologie. 77 (3): 444–450. doi:10.1016 / j.bcp.2008.10.024. PMID 19022226.
- ^ Iorio, M. A .; Tomassini, L .; Mattson, M. V .; George, C .; Jacobson, A. E. (1991). „Syntéza, stereochemie a biologická aktivita 1- (1-fenyl-2-methylcyklohexyl) piperidinů a 1- (1-fenyl-4-methylcyklohexyl) piperidinů. Absolutní konfigurace silných trans - (-) - 1- (L-fenyl-2-methylcyklohexyl) piperidin ". Journal of Medicinal Chemistry. 34 (8): 2615–2623. doi:10.1021 / jm00112a041. PMID 1875352.
- ^ Ahmadi, A .; Mahmoudi, A. (2006). "Syntéza se zlepšeným výtěžkem a studie o analgetickém účinku 2-methoxyfencyklidinu". Arzneimittel-Forschung. 56 (5): 346–350. doi:10.1055 / s-0031-1296732. PMID 16821645.
- ^ A b Ogunbadeniyi, A. M .; Adejare, A. (2002). "Syntéza fluorovaných fencyklidinových analogů". Journal of Fluorine Chemistry. 114: 39–42. doi:10.1016 / S0022-1139 (01) 00565-6.
- ^ A b Wallach, J .; Paoli, G. D .; Adejare, A .; Brandt, S. D. (2013). "Příprava a analytická charakterizace analogů 1- (1-fenylcyklohexyl) piperidinu (PCP) a 1- (1-fenylcyklohexyl) pyrrolidinu (PCPy)". Testování a analýza drog. 6 (7–8): 633–50. doi:10.1002 / dta.1468. PMID 23554350.
- ^ Harvey, M; Sáně, J; Voss, L; Pruijn, F; Jose, J; Gamage, S; Denny, W (2015). "Stanovení hypnotické účinnosti u potkanů nového analogu ketaminesteru SN 35210". Farmakologie. 96 (5–6): 226–32. doi:10.1159/000439598. PMID 26352278.
- ^ Ahmadi A, Khalili M, Hajikhani R, Naserbakht M (2011). "Syntéza a stanovení aktivit akutní a chronické bolesti 1- [1- (4-methylfenyl) (cyklohexyl)] morfolinu jako nového derivátu fencyklidinu u potkanů". Arzneimittel-Forschung. 61 (2): 92–7. doi:10.1055 / s-0031-1296173. PMID 21428243.
- ^ Zarantonello, P; Bettini, E; Paio, A; Simoncelli, C; Terreni, S; Cardullo, F (duben 2011). "Nové analogy ketaminu a fencyklidinu jako antagonisté NMDA receptoru". Bioorg Med Chem Lett. 21 (7): 2059–63. doi:10.1016 / j.bmcl.2011.02.009. PMID 21334205.
- ^ Wallach, J; Colestock, T; Cicali, B; Elliott, SP; Kavanagh, PV; Adejare, A; Dempster, NM; Brandt, SD (2016). "Syntézy a analytické charakterizace N-alkyl-arylcyklohexylaminů" (PDF). Anal. 8 (8): 801–815. doi:10.1002 / dta.1861. PMID 26360516.
- ^ Lednicer, D; VonVoigtlander, PF; Emmert, DE (duben 1980). „4-Amino-4-arylcyklohexanony a jejich deriváty, nová třída analgetik. 1. Modifikace arylového kruhu“. J Med Chem. 23 (4): 424–30. doi:10.1021 / jm00178a014. PMID 7381841.
- ^ Ahmadi, A; Solati, J; Hajikhani, R; Onagh, M; Javadi, M (2010). „Syntéza a analgetické účinky 1-1- (2-methylfenyl) (cyklohexyl) -3-piperidinolu jako nového derivátu fencyklidinu u myší“. Arzneimittel-Forschung. 60 (8): 492–6. doi:10.1055 / s-0031-1296317. PMID 20863005. S2CID 24803623.
- ^ Itzhak, Y; Kalir, A; Weissman, BA; Cohen, S (1981). "Nové analgetické léky odvozené od fencyklidinu". J Med Chem. 24 (5): 496–9. doi:10.1021 / jm00137a004. PMID 7241506.
- ^ Vignon, J .; Pinet, V .; Cerruti, C .; Kamenka, J. M .; Chicheportiche, R. (1988). „3HN-l- (2-benzo (b) thiofenyl) cyklohexylpiperidin (3HBTCP): nový analog fencyklidinu selektivní pro komplex absorpce dopaminu“. European Journal of Pharmacology. 148 (3): 427–436. doi:10.1016/0014-2999(88)90122-7. PMID 3384005.
- ^ On, XS; Raymon, LP; Mattson, MV; Eldefrawi, ME; de Costa, BR (duben 1993). "Syntéza a biologické hodnocení 1- [1- (2-benzo [b] thienyl) cyklohexyl] piperidinových homologů při příjmu dopaminu a fencyklidinových a sigma-vazebných místech". J Med Chem. 36 (9): 1188–93. doi:10.1021 / jm00061a009. PMID 8098066.
- ^ McQuinn, Roy L. (1981). "Vztahy mezi strukturou a aktivitou cykloalkylového kruhu fencyklidinu". Journal of Medicinal Chemistry. 24 (12): 1429–1432. doi:10.1021 / jm00144a011. PMID 7310819.
- ^ Moriarty, R .; Enache, L .; Zhao, L .; Gilardi, R .; Mattson, M .; Prakash, O. (1998). "Tuhé analogy fencyklidinu. Vazba na receptory fencyklidinu a sigma 1". Journal of Medicinal Chemistry. 41 (4): 468–477. doi:10.1021 / jm970059p. PMID 9484497.
externí odkazy
- Morris, H; Wallach, J (2014). „Od PCP k MXE: komplexní přehled nelékařského použití disociačních léků“. Anal. 6 (7–8): 614–32. doi:10.1002 / dta.1620. PMID 24678061.
- Syntéza a účinky analogů PCP
- Rozhovor s chemikem s ketaminem
