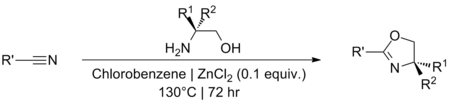Oxazolin - Oxazoline
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 2-oxazolin | |
| Systematický název IUPAC 4,5-dihydrooxazol | |
| Ostatní jména A2-oxazolin | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.007.274 |
PubChem CID | |
| UNII |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3H5NÓ | |
| Molární hmotnost | 71.079 g · mol−1 |
| Hustota | 1.075 [1] |
| Bod varu | 98 ° C (208 ° F; 371 K)[1] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxazolin je pětičlenný heterocyklický chemická sloučenina obsahující každý jeden atom kyslík a dusík. Pravděpodobně to bylo poprvé syntetizováno v roce 1884[2] ale to bylo až o 5 let později Siegmund Gabriel správně přiřazena struktura.[3] To bylo jmenováno v souladu s Hantzsch – Widmanova nomenklatura a je součástí rodiny heterocyklických sloučenin, kde existuje mezi oxazol a oxazolidin z hlediska sytosti.
Samotný oxazolin nemá žádné současné aplikace, avšak sloučeniny obsahující kruh, které jsou označovány jako oxazoliny nebo oxazolyly, mají širokou škálu použití; zejména jako ligandy v asymetrická katalýza, tak jako chránící skupiny pro karboxylové kyseliny a stále více monomery pro výrobu polymery.
Izomery
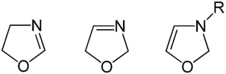 2 ‑ oxazolin, 3 ‑ oxazolin a 4 ‑ oxazolin (zleva doprava) | Tři strukturní izomery oxazolinu je možné v závislosti na umístění dvojné vazby, běžné jsou však pouze 2-oxazoliny. 4 ‑ Oxazoliny se tvoří jako meziprodukty při výrobě určitých látek azomethinylidy[4] ale jinak jsou vzácné. 3 ‑ Oxazoliny jsou ještě méně časté, ale byly syntetizovány fotochemicky[5] a otevřením kruhu aziriny.[6] Tyto tři formy se nedají snadno přeměnit, a proto nejsou tautomery. Existuje čtvrtý izomer, ve kterém sousedí atomy O a N, což je známé jako isoxazolin. |
Syntéza
Syntéza 2-oxazolinových kruhů je dobře zavedená a obecně probíhá cyklizací 2-aminoalkohol (obvykle se získá redukcí aminokyselina ) s vhodnou funkční skupinou.[7][8][9] Celkový mechanismus obvykle podléhá Baldwinova pravidla.
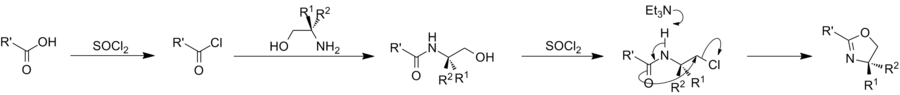
Z chloridů kyselin
Rutinní cesta k oxazolinům zahrnuje reakce acylchloridy s 2-aminoalkoholy. Thionylchlorid se běžně používá k výrobě chloridu kyseliny in situ, přičemž je třeba dbát na udržení bezvodých podmínek, protože oxazoliny mohou být otevřeny kruhem chlorid pokud já těžím bude protonován.[10] Reakce se obvykle provádí při teplotě místnosti. Pokud jsou činidla mírnější než SOCl2 jsou potřeba, oxalylchlorid může být použito.[11]
Aminomethylpropanol je klasickým předchůdcem použití oxazolinů chlorid kyseliny metoda.[12] Při aplikaci na mastné kyseliny se výsledný dimethyloxazolin (DMOX) deriváty lze analyzovat plynovou chromatografií.
Z karboxylových kyselin
Úpravy Appel reakce umožňuje syntézu oxazolinových kruhů.[13] Tato metoda probíhá za relativně mírných podmínek teploty místnosti, ale vzhledem k velkému množství trifenylfosfin oxid metoda není ideální pro reakce ve velkém měřítku. Použití této metody se stává méně častým z důvodu chlorid uhličitý je omezen pod Montrealský protokol.
Z aldehydů
Cyklizace aminoalkoholu a aldehyd produkuje meziprodukt oxazolidin který lze převést na oxazolin působením na bázi halogenu oxidační činidlo (např. NBS,[14] nebo jód[15]); to potenciálně probíhá prostřednictvím imidoylhalogenid. Ukázalo se, že metoda je účinná pro širokou škálu aromatický a alifatický aldehydy, avšak elektronově bohaté aromatické R skupiny, jako je fenoly, jsou nevhodné, protože přednostně procházejí rychlými elektrofilní aromatická halogenace s oxidačním činidlem.
Z nitrilů
Použití katalytického množství ZnCl2 generovat oxazoliny z nitrily poprvé popsali Witte a Seeliger,[16][17] a dále je rozvíjí Bolm et al.[18] Reakce vyžaduje, aby byla úspěšná vysoká teplota, a obvykle se provádí při refluxu chlorbenzen pod bezvodý podmínky. Přesný reakční mechanismus nebyl nikdy navržen, i když je pravděpodobně podobný Pinnerova reakce; předcházející prostřednictvím meziproduktu amidin.[19][20] Došlo k omezenému výzkumu identifikace alternativních rozpouštědel nebo katalyzátorů pro reakci.[21][22]
Ligandy
Ligandy obsahující chirální 2-oxazolinový kruh se používají v asymetrická katalýza díky jejich snadné syntéze, široké škále forem a účinnosti pro mnoho typů katalytické transformace.[23][24]
2-Substituované oxazoliny mohou být připraveny mnoha způsoby a mají střední míru tvrdý N-dárce. Chirality je snadno začleněn pomocí 2-aminoalkoholy připraven redukcí aminokyseliny; které jsou opticky čisté a levné. Protože stereocentrum v takových oxazolinech sousedí s koordinačním N-atomem, může ovlivnit selektivitu procesů probíhajících ve středu kovu. Kroužek je tepelně stabilní[25] a odolný vůči nukleofilům, zásadám, radikálům a slabým kyselinám[26] stejně jako poměrně odolný vůči hydrolýze a oxidaci;[7] lze tedy očekávat, že zůstane stabilní v širokém rozsahu reakčních podmínek.
Hlavní třídy ligandu na bázi oxazolinu zahrnují:
Pozoruhodné specializované oxazolinové ligandy zahrnují:
- Fenol-oxazoliny
- Bis (oxazolinato) s
- Trisoxazolinylborát ligandy
Polymery
2-oxazoliny, jako například 2-ethyl-2-oxazolin, může podstoupit živá kationtová polymerace otevírající kruh za vzniku poly (2-oxazolinu) s.[27] Jedná se o polyamidy a lze je považovat za analogy peptidy; mají mnoho potenciálních aplikací[28] a byla jim věnována zvláštní pozornost jejich biomedicínským účelům.[29][30]
Viz také
Strukturní analogy
- Benzoxazol: kde je oxazolin kondenzován na benzenový kruh.
- Oxazol: který má dvě dvojné vazby
- Oxazolidin: který nemá žádné dvojné vazby
- Thiazolin: kde je kyslík nahrazen sírou
Další stránky
- Aminorex lék nesoucí oxazolinový kruh
Reference
- ^ A b Wenker, H. (1938). "Syntéza z etanolaminu. V. Syntéza A2-oxazolinu a 2,2'-A2-dioxazolinu". Journal of the American Chemical Society. 60 (9): 2152–2153. doi:10.1021 / ja01276a036.
- ^ Andreasch, Rudolf (prosinec 1884). „Zur Kenntniss des Allylharnstoffs“ [Ke znalosti alkylmočoviny]. Monatshefte für Chemie (v němčině). 5 (1): 33–46. doi:10.1007 / BF01526087.
- ^ Gabriel, S. (1889). „Zur Kenntniss des Bromäthylamins“ [Ke znalostem Bromäthylaminů]. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 22 (1): 1139–1154. doi:10,1002 / cber.188902201248.
- ^ Vedejs, E .; Grissom, J. W. (1988). "4-oxazolinová cesta ke stabilizovaným azomethinylidům. Řízená redukce oxazoliových solí". Journal of the American Chemical Society. 110 (10): 3238–3246. doi:10.1021 / ja00218a038.
- ^ Armesto, Diego; Ortiz, Maria J .; Pérez-Ossorio, Rafael; Horspool, William M. (1983). "Nová fotochemická migrace 1,2-acylu v enolesteru. Syntéza 3-oxazolinových derivátů". Čtyřstěn dopisy. 24 (11): 1197–1200. doi:10.1016 / S0040-4039 (00) 86403-5.
- ^ Sá, Marcus C. M .; Kascheres, Albert (1996). „Elektronicky zprostředkovaná selektivita při otevírání kruhu 1-azirinů. Režim 3-X: Pohodlná cesta k 3-oxazolinům“. The Journal of Organic Chemistry. 61 (11): 3749–3752. doi:10.1021 / jo9518866. PMID 11667224.
- ^ A b Wiley, Richard H .; Bennett, Leonard L. (1949). "Chemie oxazolinů". Chemické recenze. 44 (3): 447–476. doi:10.1021 / cr60139a002.
- ^ Frump, John A. (1971). "Oxazoliny. Jejich příprava, reakce a aplikace". Chemické recenze. 71 (5): 483–505. doi:10.1021 / cr60273a003.
- ^ Gant, Thomas G .; Meyers, A.I. (1994). „Chemistry of 2-oxazolines (1985 – present)“. Čtyřstěn. 50 (8): 2297–2360. doi:10.1016 / S0040-4020 (01) 86953-2.
- ^ Holerca, Marian N .; Percec, Virgil (2000). „1H NMR spektroskopické zkoumání mechanismu tvorby 2-substituovaného-2-oxazolinového kruhu a hydrolýzy odpovídajících oxazoliniových solí“. European Journal of Organic Chemistry. 2000 (12): 2257–2263. doi:10.1002 / 1099-0690 (200006) 2000: 12 <2257 :: AID-EJOC2257> 3.0.CO; 2-2.
- ^ Evans, David; Peterson, Gretchen S .; Johnson, Jeffrey S .; Barnes, David M .; Campos, Kevin R .; Woerpel, Keith A. (1998). „Vylepšený postup pro přípravu 2,2-bis [2- [4 (S) - terc-butyl-1,3-oxazolinylpropanu [(S, S) -terc-butylbis (oxazolin)] a odvozené mědi (II ) Komplexy “. J. Org. Chem. 63 (13): 4541–4544. doi:10.1021 / jo980296f.
- ^ Albert I. Meyers, Mark E. Flanagan (1993). "2,2'-Dimethoxy-6-Formylbifenyl". Org. Synth. 71: 107. doi:10.15227 / orgsyn.071.0107.CS1 maint: používá parametr autoři (odkaz)
- ^ Vorbrüggen, Helmut; Krolikiewicz, Konrad (1993). „Jednoduchá syntéza A2-oxazinů, A2-oxazinů, A2-thiazolinů a 2-substituovaných benzoxazolů.“. Čtyřstěn. 49 (41): 9353–9372. doi:10.1016 / 0040-4020 (93) 80021-K.
- ^ Schwekendiek, Kirsten; Glorius, Frank (2006). "Efektivní oxidační syntéza 2-oxazolinů". Syntéza. 2006 (18): 2996–3002. doi:10.1055 / s-2006-950198.
- ^ Ishihara, Midori; Togo, Hideo (2007). "Přímá oxidační přeměna aldehydů a alkoholů na 2-imidazoliny a 2-oxazoliny pomocí molekulárního jodu". Čtyřstěn. 63 (6): 1474–1480. doi:10.1016 / j.tet.2006.11.077.
- ^ Witte, Helmut; Seeliger, Wolfgang (1972). "Jednoduchá syntéza 2-substituovaných 2-oxazolinů a 5,6-dihydro-4H-1,3-oxazinů". Angewandte Chemie International Edition v angličtině. 11 (4): 287–288. doi:10,1002 / anie.197202871.
- ^ Witte, Helmut; Seeliger, Wolfgang (1974). „Cyclische Imidsäureester aus Nitrilen und Aminoalkoholen“. Justus Liebigs Annalen der Chemie. 1974 (6): 996–1009. doi:10,1002 / jlac.197419740615.
- ^ Bolm, Carsten; Weickhardt, Konrad; Zehnder, Margareta; Ranff, Tobias (1991). „Syntéza opticky aktivních bis (2-oxazolinů): Krystalová struktura 1,2-bis (2-oxazolinyl) benzenu ZnCl2 Komplex". Chemische Berichte. 124 (5): 1173–1180. doi:10.1002 / cber.19911240532.
- ^ Makarycheva-Mikhailova, A. V .; Kukushkin, V. Y .; Nazarov, A. A .; Garnovskii, D. A .; Pombeiro, A. J. L .; Haukka, M .; Keppler, B. K .; Galanski, M. (2003). "Amidiny odvozené z nitrilové vazby na aminoskupiny zprostředkované Pt (IV) a jejich přeměnou na oxid zinečnatý" (Zn (II)). Anorganická chemie. 42 (8): 2805–13. doi:10.1021 / ic034070t. PMID 12691592.
- ^ i. Meyers, A .; Ann Hanagan, M .; l. Mazzu, A. (1981). "2-Oxazoliny z amidů prostřednictvím imidátů". Heterocykly. 15: 361. doi:10.3987 / S-1981-01-0361.
- ^ Cornejo, A .; Fraile, J. M .; García, J. I .; Gil, M. J .; Martínez-Merino, V .; Mayoral, J. A .; Pires, E .; Villalba, I. (2005). "Efektivní a obecná metoda v jedné nádobě pro syntézu chirálních bis (oxazolinových) a pyridinových bis (oxazolinových) ligandů". Synlett (15): 2321–2324. doi:10,1055 / s-2005-872672.
- ^ Aspinall, Helen C .; Bacsa, John; Beckingham, Oliver D .; Eden, Edward G. B .; Greeves, Nicholas; Hobbs, Matthew D .; Potjewyd, Frances; Schmidtmann, Marc; Thomas, Christopher D. (2014). „Přidání pravého (nebo levého) zkroucení k trischelátovým komplexům - koordinační chemie chirálních oxazolylfenolátů s ionty M3 + (M = Al nebo lanthanid)“ (PDF). Dalton Trans. 43 (3): 1434–1442. doi:10.1039 / C3DT52366G. PMID 24201227. Podrobnosti viz Doplňkové informace
- ^ McManus, Helen A .; Guiry, Patrick J. (2004). „Nejnovější vývoj v aplikaci ligandů obsahujících oxazolin v asymetrické katalýze“. Chemické recenze. 104 (9): 4151–4202. doi:10.1021 / cr040642v. PMID 15352789.
- ^ Hargaden, Gráinne C .; Guiry, Patrick J. (2009). "Nedávné aplikace ligandů obsahujících oxazolin v asymetrické katalýze". Chemické recenze. 109 (6): 2505–2550. doi:10.1021 / cr800400z. PMID 19378971.
- ^ Loo, Yim Fun; O'Kane, Ruairi; Jones, Anthony C .; Aspinall, Helen C .; Potter, Richard J .; Chalker, Paul R .; Bickley, Jamie F .; Taylor, Stephen; Smith, Lesley M. (2005). "Uložení HfO2 a ZrO2 filmy vstřikováním kapaliny MOCVD s použitím nových prekurzorů monomerního alkoxidu " Journal of Materials Chemistry. 15 (19): 1896. doi:10.1039 / B417389A.
- ^ Greene, T. W. (1991). Ochranné skupiny v organické syntéze, 2. vyd. New York: Wiley. str.265 –266 & 433–436.
- ^ Kobayashi, Shiro; Uyama, Hiroshi (15. ledna 2002). „Polymerizace cyklických iminoetherů: od objevu po současný stav techniky“. Journal of Polymer Science Part A: Polymer Chemistry. 40 (2): 192–209. Bibcode:2002JPoSA..40..192K. doi:10,1002 / pola.10090.
- ^ Hoogenboom, Richard (12. října 2009). „Poly (2-oxazolin) s: Třída polymeru s mnoha potenciálními aplikacemi“. Angewandte Chemie International Edition. 48 (43): 7978–7994. doi:10.1002 / anie.200901607. PMID 19768817.
- ^ Adams, Nico; Schubert, Ulrich S. (1. prosince 2007). „Poly (2-oxazoliny) v kontextech biologické a biomedicínské aplikace“. Pokročilé recenze dodávek drog. 59 (15): 1504–1520. doi:10.1016 / j.addr.2007.08.018. PMID 17904246.
- ^ Kelly, Andrew M; Wiesbrock, Frank (15. října 2012). „Strategies for the Synthesis of Poly (2-Oxazoline) -Based Hydrogels“. Makromolekulární rychlá komunikace. 33 (19): 1632–1647. doi:10.1002 / březen.201200333. PMID 22811405.