Solventní - Solvent

A solventní (z latinský Solvó „uvolněte, uvolněte, vyřešte“) je látka, která rozpouští rozpuštěnou látku, což má za následek a řešení. Rozpouštědlo je obvykle kapalina, ale může to být také pevná látka, plyn nebo a nadkritická tekutina. Množství rozpuštěné látky, které se může rozpustit v určitém objemu rozpouštědla, se mění s teplota. Hlavní použití rozpouštědel jsou barvy, odstraňovače barev, inkousty, chemické čištění.[1] Specifické použití pro organický rozpouštědla jsou v čistírna (např. tetrachlorethylen ), tak jako ředidla na barvy (např. toluen, terpentýn ), jako odlakovače a rozpouštědla lepidla (aceton, methylacetát, ethylacetát ), v odstraňovačech skvrn (např. hexan, benzín ether), v pracích prostředcích (citrusové terpeny ) a v parfémy (ethanol ). Voda je rozpouštědlem pro polární molekuly a nejběžnější rozpouštědlo používané živými věcmi; všechny ionty a proteiny v buňce jsou v buňce rozpuštěny ve vodě. Rozpouštědla nacházejí různé aplikace v chemii, farmaceutické, ropný a plynárenský průmysl, včetně v chemické syntézy a procesy čištění.
Řešení a solvatace
Když je jedna látka rozpuštěn do jiného, a řešení je vytvořen.[2] To je na rozdíl od situace, kdy sloučeniny jsou nerozpustný jako písek ve vodě. V roztoku jsou všechny složky rovnoměrně rozloženy na molekulární úrovni a nezůstávají žádné zbytky. Směs rozpouštědel a solutů se skládá z jediné fáze přičemž všechny molekuly rozpuštěné látky se vyskytují jako solváty (rozpuštěná látka komplexy ), na rozdíl od oddělených kontinuálních fází, jako jsou suspenze, emulze a jiné typy neroztokových směsí. Schopnost jedné sloučeniny být rozpuštěna v jiné je známá jako rozpustnost; pokud k tomu dojde ve všech poměrech, je to nazýváno mísitelný.
Kromě míchání se látky v roztoku vzájemně ovlivňují na molekulární úrovni. Když je něco rozpuštěno, uspořádají se molekuly rozpouštědla molekuly rozpuštěné látky. Přenos tepla je zapojen a entropie se zvyšuje, čímž je řešení více termodynamicky stabilní než rozpuštěná látka a rozpouštědlo samostatně. Toto uspořádání je zprostředkováno příslušnými chemickými vlastnostmi rozpouštědla a rozpuštěné látky, jako je např vodíkové vazby, dipólový moment a polarizovatelnost.[3] Rozpouštění nezpůsobuje chemickou reakci nebo změny chemické konfigurace v rozpuštěné látce. Solvatace se však podobá a koordinační komplex formační reakce, často se značnou energií (solvatační teplo a entropie solvatace), a je tak daleko od neutrálního procesu.
Když se jedna látka rozpustí v druhou, vytvoří se roztok. Roztok je homogenní směs sestávající z rozpuštěné látky rozpuštěné v rozpouštědle. Rozpuštěná látka je látka, která se rozpouští, zatímco rozpouštědlo je rozpouštěcí médium. Řešení lze vytvářet mnoha různými typy a formami rozpuštěných látek a rozpouštědel.
Klasifikace rozpouštědel
Rozpouštědla lze obecně rozdělit do dvou kategorií: polární a nepolární. Zvláštní případ je rtuť, jehož řešení jsou známá jako amalgámy; také další kovová řešení existují kapaliny při pokojové teplotě. Obecně platí, že dielektrická konstanta rozpouštědla poskytuje hrubou míru polarity rozpouštědla. Silná polarita vody je indikována její vysokou dielektrickou konstantou 88 (při 0 ° C).[4] Rozpouštědla s dielektrickou konstantou menší než 15 se obecně považují za nepolární.[5] Dielektrická konstanta měří tendenci rozpouštědla částečně rušit intenzitu pole elektrického pole a nabitá částice ponořený do toho. Toto snížení je poté srovnáno s intenzita pole nabité částice ve vakuu.[5] Heuristicky lze dielektrickou konstantu rozpouštědla považovat za její schopnost snížit účinnou látku vnitřní náboj. Obecně je dielektrická konstanta rozpouštědla přijatelným prediktorem schopnosti rozpouštědla běžně se rozpouštět iontové sloučeniny, jako jsou soli.
Jiné stupnice polarity
Dielektrické konstanty nejsou jediným měřítkem polarity. Protože chemici používají rozpouštědla k provádění chemických reakcí nebo k pozorování chemických a biologických jevů, je zapotřebí konkrétnějších opatření polarity. Většina z těchto opatření je citlivá na chemickou strukturu.
The Grunwald – Winstein mY měřítko měří polaritu, pokud jde o vliv rozpouštědla na nárůst kladného náboje rozpuštěné látky během chemické reakce.
Kosower je Z měřítko měří polaritu z hlediska vlivu rozpouštědla na UV - absorpční maxima soli, obvykle pyridinium jodid nebo pyridinium zwitterion.[6]
Číslo dárce a stupnice příjemce dárce měří polaritu, pokud jde o to, jak rozpouštědlo interaguje s konkrétními látkami, například silnými Lewisova kyselina nebo silná Lewisova základna.[7]
The Hildebrandův parametr je druhá odmocnina z soudržná hustota energie. Může být použit s nepolárními sloučeninami, ale nemůže pojmout složitou chemii.
Reichardtovo barvivo, a solvatochromní barvivo, které mění barvu v reakci na polaritu, dává stupnici ET(30) hodnot. ET je přechodová energie mezi základním stavem a nejnižším excitovaným stavem v kcal / mol a (30) identifikuje barvivo. Další, zhruba korelovaná stupnice (ET(33)) lze definovat pomocí Nilská červená.
Polarita, dipólový moment, polarizovatelnost a vodíkové vazby rozpouštědla určuje, jaký typ sloučeniny je schopen se rozpustit a s jakými dalšími rozpouštědly nebo kapalnými sloučeninami je mísitelný. Obecně platí, že polární rozpouštědla nejlépe rozpouštějí polární sloučeniny a nepolární rozpouštědla rozpouštějí nepolární sloučeniny nejlépe: „jako se rozpouští jako“. Silně polární sloučeniny jako cukry (např. sacharóza) nebo iontové sloučeniny anorganické soli (např. stolní sůl ) se rozpouští pouze ve velmi polárních rozpouštědlech, jako je voda, zatímco silně nepolární sloučeniny jako oleje nebo vosky rozpouštět pouze ve velmi nepolárních organických rozpouštědlech, jako je hexan. Podobně voda a hexan (nebo ocet a rostlinný olej) nejsou mísitelný navzájem a rychle se rozdělí na dvě vrstvy i po dobrém protřepání.
Polaritu lze rozdělit na různé příspěvky. Například Parametry Kamlet-Taft jsou dipolarita / polarizovatelnost (π *), kyselost vodíkových vazeb (α) a zásaditost vodíkových vazeb (β). Ty lze vypočítat z posunů vlnových délek 3–6 různých solvatochromních barviv v rozpouštědle, obvykle včetně Reichardtovo barvivo, nitroanilin a diethylnitroanilin. Další možností, Hansenovými parametry, je rozdělení hustoty kohezní energie na disperzní, polární a vodíkové vazby.
Polární protika a polární aprotika
Rozpouštědla s dielektrickou konstantou (přesněji relativní statická permitivita ) větší než 15 (tj. polární nebo polarizovatelný) lze dále rozdělit na protický a aprotický. Protická rozpouštědla solvátují anionty (záporně nabité rozpuštěné látky) silně prostřednictvím vodíkové vazby. Voda je protické rozpouštědlo. Aprotická rozpouštědla, jako je aceton nebo dichlormethan mívají velké dipólové momenty (oddělení částečných kladných a částečných záporných nábojů ve stejné molekule) a solvatují kladně nabité druhy prostřednictvím jejich záporného dipólu.[8] v chemické reakce použití polárních protických rozpouštědel upřednostňuje SN1 mechanismus reakce, zatímco polární aprotická rozpouštědla upřednostňují SN2 mechanismus reakce. Tato polární rozpouštědla jsou schopna tvořit vodíkové vazby s vodou, aby se rozpustila ve vodě, zatímco nepolární rozpouštědla nejsou schopna silných vodíkových vazeb.
Vícesložkový
Vícesložková rozpouštědla se objevila po druhé světové válce v SSSR a nadále se používají a vyrábějí v postsovětských státech.
Rozpouštědla
| název | Složení |
|---|---|
| Rozpouštědlo 645 | toluen 50%, butylacetát 18%, ethylacetát 12%, butanol 10%, ethanol 10%. |
| Rozpouštědlo 646 | toluen 50%, ethanol 15%, butanol 10%, butyl- nebo amylacetát 10%, ethylcellosolve 8%, aceton 7%[9] |
| Rozpouštědlo 647 | butyl- nebo amylacetát 29,8%, ethylacetát 21,2%, butanol 7,7%, toluen nebo pyrobenzen 41.3%[10] |
| Rozpouštědlo 648 | butylacetát 50%, ethanol 10%, butanol 20%, toluen 20%[11] |
| Rozpouštědlo 649 | ethylcellosolve 30%, butanol 20%, xylen 50% |
| Rozpouštědlo 650 | ethylcellosolve 20%, butanol 30%, xylen 50%[12] |
| Rozpouštědlo 651 | bílá duše 90%, butanol 10% |
| Rozpouštědlo KR-36 | butylacetát 20%, butanol 80% |
| Rozpouštědlo P-4 | toluen 62%, aceton 26%, butylacetát 12%. |
| Rozpouštědlo P-10 | xylen 85%, aceton 15%. |
| Rozpouštědlo P-12 | toluen 60%, butylacetát 30%, xylen 10%. |
| Rozpouštědlo P-14 | cyklohexanon 50%, toluen 50%. |
| Rozpouštědlo P-24 | rozpouštědlo 50%, xylen 35%, aceton 15%. |
| Rozpouštědlo P-40 | toluen 50%, ethylcellosolve 30%, aceton 20%. |
| Rozpouštědlo P-219 | toluen 34%, cyklohexanon 33%, aceton 33%. |
| Rozpouštědlo P-3160 | butanol 60%, ethanol 40%. |
| Rozpouštědlo RCC | xylen 90%, butylacetát 10%. |
| Rozpouštědlo RML | ethanol 64%, ethylcellosolve 16%, toluen 10%, butanol 10%. |
| Rozpouštědlo PML-315 | toluen 25%, xylen 25%, butylacetát 18%, ethylcellosolve 17%, butanol 15%. |
| Rozpouštědlo PC-1 | toluen 60%, butylacetát 30%, xylen 10%. |
| Rozpouštědlo PC-2 | lakový benzín 70%, xylen 30%. |
| Solvent RFG | ethanol 75%, butanol 25%. |
| Rozpouštědlo RE-1 | xylen 50%, aceton 20%, butanol 15%, ethanol 15%. |
| Rozpouštědlo RE-2 | Rozpouštědlo 70%, ethanol 20%, aceton 10%. |
| Rozpouštědlo RE-3 | 50% rozpouštědlo, 20% ethanol, 20% aceton, 10% ethylcelloso. |
| Rozpouštědlo RE-4 | rozpouštědlo 50%, aceton 30%, ethanol 20%. |
| Rozpouštědlo FK-1 (?) | absolutní alkohol (99,8%) 95%, ethylacetát 5% |
Ředidla
| název | Složení |
|---|---|
| Ředidlo RKB-1 | butanol 50%, xylen 50% |
| Ředidlo RKB-2 | butanol 95%, xylen 5% |
| Ředidlo RKB-3 | xylen 90%, butanol 10% |
| Ředidlo M. | ethanol 65%, butylacetát 30%, ethylacetát 5%. |
| Ředidlo P-7 | cyklohexanon 50%, ethanol 50%. |
| Ředidlo R-197 | xylen 60%, butylacetát 20%, ethyl cellosolve 20%. |
| Ředidlo WFD | toluen 50%, butylacetát (nebo amylacetát) 18%, butanol 10%, ethanol 10%, ethylacetát 9%, aceton 3%. |
Fyzikální vlastnosti
Tabulka vlastností běžných rozpouštědel
Rozpouštědla jsou seskupena do nepolární, polární aprotický a polární protický rozpouštědla, přičemž každá skupina je uspořádána podle zvýšení polarity. The vlastnosti rozpouštědel, která přesahují rozpouštědla, jsou tučně.
| Solventní | Chemický vzorec | Bod varu[13] (° C) | Dielektrická konstanta[14] | Hustota (g / ml) | Dipólový moment (D ) |
|---|---|---|---|---|---|
Nepolární rozpouštědla | |||||
| Pentan |  CH3CH2CH2CH2CH3 | 36.1 | 1.84 | 0.626 | 0.00 |
| Cyklopentan | 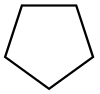 C5H10 | 49.2 | 1.97 | 0.751 | 0.00 |
| Hexan | 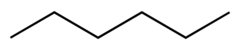 CH3CH2CH2CH2CH2CH3 | 69 | 1.88 | 0.655 | 0.00 |
| Cyklohexan |  C6H12 | 80.7 | 2.02 | 0.779 | 0.00 |
| Benzen | 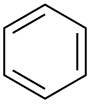 C6H6 | 80.1 | 2.3 | 0.879 | 0.00 |
| Chlorid uhličitý | CCl4 | 76.7 | 2.3 | 1.5867 | 0.00 |
| Toluen | C6H5-CH3 | 111 | 2.38 | 0.867 | 0.36 |
| 1,4-dioxan |  C4H8Ó2 | 101.1 | 2.3 | 1.033 | 0.45 |
| Diethylether |  CH3CH2-O-CH2CH3 | 34.6 | 4.3 | 0.713 | 1.15 |
| Chloroform |  CHCI3 | 61.2 | 4.81 | 1.498 | 1.04 |
Polární aprotický rozpouštědla | |||||
| Dichlormethan (DCM) | 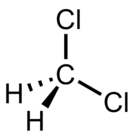 CH2Cl2 | 39.6 | 9.1 | 1.3266 | 1.60 |
| Tetrahydrofuran (THF) | 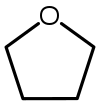 C4H8Ó | 66 | 7.5 | 0.886 | 1.75 |
| Ethylacetát |  CH3-C (= O) -O-CH2-CH3 | 77.1 | 6.02 | 0.894 | 1.78 |
| Aceton |  CH3-C (= O) -CH3 | 56.1 | 21 | 0.786 | 2.88 |
| Dimethylformamid (DMF) | 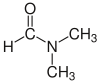 H-C (= 0) N (CH3)2 | 153 | 38 | 0.944 | 3.82 |
| Acetonitril (MeCN) | CH3-C≡N | 82 | 37.5 | 0.786 | 3.92 |
| Dimethylsulfoxid (DMSO) |  CH3-S (= O) -CH3 | 189 | 46.7 | 1.092 | 3.96 |
| Nitromethan |  CH3-NE2 | 100–103 | 35.87 | 1.1371 | 3.56 |
| Propylenkarbonát |  C4H6Ó3 | 240 | 64.0 | 1.205 | 4.9 |
Polární protický rozpouštědla | |||||
| Amoniak | 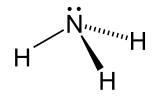 NH3 | -33.3 | 17 | 0.674 (při -33,3 ° C) | 1.42 |
| Kyselina mravenčí |  H-C (= O) OH | 100.8 | 58 | 1.21 | 1.41 |
| n-Butanol | CH3CH2CH2CH2ACH | 117.7 | 18 | 0.810 | 1.63 |
| Isopropylalkohol (IPA) | 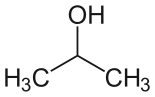 CH3-CH (-OH) -CH3 | 82.6 | 18 | 0.785 | 1.66 |
| n-Propanol |  CH3CH2CH2ACH | 97 | 20 | 0.803 | 1.68 |
| Ethanol | CH3CH2ACH | 78.2 | 24.55 | 0.789 | 1.69 |
| Metanol | 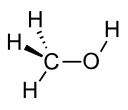 CH3ACH | 64.7 | 33 | 0.791 | 1.70 |
| Octová kyselina |  CH3-C (= O) OH | 118 | 6.2 | 1.049 | 1.74 |
| Voda |  H-O-H | 100 | 80 | 1.000 | 1.85 |
The ACS Green Chemistry Institute udržuje nástroj pro výběr rozpouštědel na základě a analýza hlavních komponent vlastností rozpouštědel.[15]
Hodnoty parametrů rozpustnosti podle Hansena
Hodnoty parametru rozpustnosti podle Hansena[16][17] jsou založeny na disperzní vazby (δD), polární vazby (δP) a Vodíkové vazby (5H). Ty obsahují informace o intermolekulárních interakcích s jinými rozpouštědly a také s polymery, pigmenty, nanočásticemi atd. To umožňuje racionální formulace například s vědomím, že existuje dobrá shoda HSP mezi rozpouštědlem a polymerem. Racionální substituce mohou být také provedeny za „dobrá“ rozpouštědla (účinná při rozpouštění rozpuštěné látky), která jsou „špatná“ (drahá nebo škodlivá pro zdraví nebo životní prostředí). Následující tabulka ukazuje, že intuice z „nepolárních“, „polárních aprotických“ a „polárních protik“ jsou číslovány - „polární“ molekuly mají vyšší hladiny δP a protická rozpouštědla vyšší úrovně δH. Protože se používají číselné hodnoty, lze srovnání provádět racionálně srovnáním čísel. Například acetonitril je mnohem polárnější než aceton, ale vykazuje o něco méně vodíkové vazby.
| Solventní | Chemický vzorec | δD disperze | δP Polar | δH vodíková vazba |
|---|---|---|---|---|
Nepolární rozpouštědla | ||||
| n-hexan | CH3CH2CH2CH2CH2CH3 | 14.9 | 0.0 | 0.0 |
| Benzen | C6H6 | 18.4 | 0.0 | 2.0 |
| Toluen | C6H5-CH3 | 18.0 | 1.4 | 2.0 |
| Diethylether | CH3CH2-O-CH2CH3 | 14.5 | 2.9 | 4.6 |
| Chloroform | CHCI3 | 17.8 | 3.1 | 5.7 |
| 1,4-dioxan | / -CH2-CH2-O-CH2-CH2-Ó- | 17.5 | 1.8 | 9.0 |
Polární aprotická rozpouštědla | ||||
| Ethylacetát | CH3-C (= O) -O-CH2-CH3 | 15.8 | 5.3 | 7.2 |
| Tetrahydrofuran (THF) | / -CH2-CH2-O-CH2-CH2-\ | 16.8 | 5.7 | 8.0 |
| Dichlormethan | CH2Cl2 | 17.0 | 7.3 | 7.1 |
| Aceton | CH3-C (= O) -CH3 | 15.5 | 10.4 | 7.0 |
| Acetonitril (MeCN) | CH3-C≡N | 15.3 | 18.0 | 6.1 |
| Dimethylformamid (DMF) | H-C (= 0) N (CH3)2 | 17.4 | 13.7 | 11.3 |
| Dimethylsulfoxid (DMSO) | CH3-S (= O) -CH3 | 18.4 | 16.4 | 10.2 |
Polární protická rozpouštědla | ||||
| Octová kyselina | CH3-C (= O) OH | 14.5 | 8.0 | 13.5 |
| n-Butanol | CH3CH2CH2CH2ACH | 16.0 | 5.7 | 15.8 |
| Isopropanol | CH3-CH (-OH) -CH3 | 15.8 | 6.1 | 16.4 |
| n-Propanol | CH3CH2CH2ACH | 16.0 | 6.8 | 17.4 |
| Ethanol | CH3CH2ACH | 15.8 | 8.8 | 19.4 |
| Metanol | CH3ACH | 14.7 | 12.3 | 22.3 |
| Kyselina mravenčí | H-C (= O) OH | 14.6 | 10.0 | 14.0 |
| Voda | H-O-H | 15.5 | 16.0 | 42.3 |
Pokud je z důvodu ochrany životního prostředí nebo z jiných důvodů k nahrazení jiného ekvivalentní solventnosti nutné použít rozpouštědlo nebo směs rozpouštědel, lze náhradu provést na základě Hansenovy parametry rozpustnosti každého. Hodnoty pro směsi se berou jako vážené průměry hodnot čistých rozpouštědel. To lze vypočítat pomocí pokus omyl, tabulku hodnot nebo software HSP.[16][17] Směs 1: 1 toluen a 1,4 dioxan má hodnoty δD, δP a δH 17,8, 1,6 a 5,5, srovnatelné s hodnotami z chloroform na 17,8, 3,1 a 5,7. Kvůli zdravotním rizikům spojeným s toluenem samotným lze najít jiné směsi rozpouštědel s použitím úplného obsahu HSP datová sada.
Bod varu
| Solventní | Bod varu (° C)[13] |
|---|---|
| ethylen dichlorid | 83.48 |
| pyridin | 115.25 |
| methylisobutylketon | 116.5 |
| methylenchlorid | 39.75 |
| isooktan | 99.24 |
| sirouhlík | 46.3 |
| chlorid uhličitý | 76.75 |
| o-xylen | 144.42 |
Bod varu je důležitou vlastností, protože určuje rychlost odpařování. Malá množství rozpouštědel s nízkou teplotou varu diethylether, dichlormethan nebo aceton se odpaří během několika sekund při pokojové teplotě, zatímco rozpouštědla s vysokou teplotou varu, jako je voda nebo dimethylsulfoxid potřebujete vyšší teploty, proudění vzduchu nebo aplikaci vakuum pro rychlé odpařování.
- Nízkovroucí: bod varu pod 100 ° C (bod varu vody)
- Střední kotle: mezi 100 ° C a 150 ° C
- Vysoké kotle: nad 150 ° C
Hustota
Většina organických rozpouštědel má nižší hustota než voda, což znamená, že jsou lehčí než a vytvoří vrstvu na vodě. Důležité výjimky jsou většinou halogenované rozpouštědla jako dichlormethan nebo chloroform klesne na dno nádoby a jako vrchní vrstva zůstane voda. To je zásadní pro zapamatování kdy rozdělení sloučeniny mezi rozpouštědly a vodou v a dělicí nálevka během chemických syntéz.
Často, specifická gravitace je uveden v místě hustoty. Specifická hmotnost je definována jako hustota rozpouštědla dělená hustotou vody při stejné teplotě. Specifická hmotnost je tedy bezjednotkovou hodnotou. Snadno sděluje, zda ve vodě nerozpustné rozpouštědlo bude plavat (SG <1,0) nebo klesat (SG> 1,0), když je smícháno s vodou.
| Solventní | Specifická gravitace[18] |
|---|---|
| Pentan | 0.626 |
| Ropný ether | 0.656 |
| Hexan | 0.659 |
| Heptan | 0.684 |
| Diethylamin | 0.707 |
| Diethylether | 0.713 |
| Triethylamin | 0.728 |
| Terc-butylmethylether | 0.741 |
| Cyklohexan | 0.779 |
| Terc-butylalkohol | 0.781 |
| Isopropanol | 0.785 |
| Acetonitril | 0.786 |
| Ethanol | 0.789 |
| Aceton | 0.790 |
| Metanol | 0.791 |
| Methylisobutylketon | 0.798 |
| Izobutylalkohol | 0.802 |
| 1-propanol | 0.803 |
| Methylethylketon | 0.805 |
| 2-butanol | 0.808 |
| Isoamylalkohol | 0.809 |
| 1-Butanol | 0.810 |
| Diethylketon | 0.814 |
| 1-oktanol | 0.826 |
| p-xylen | 0.861 |
| m-xylen | 0.864 |
| Toluen | 0.867 |
| Dimethoxyethan | 0.868 |
| Benzen | 0.879 |
| Butylacetát | 0.882 |
| 1-chlorbutan | 0.886 |
| Tetrahydrofuran | 0.889 |
| Ethylacetát | 0.895 |
| o-xylen | 0.897 |
| Hexamethylfosfor triamid | 0.898 |
| 2-ethoxyethylether | 0.909 |
| N, N-dimethylacetamid | 0.937 |
| Diethylenglykol dimethylether | 0.943 |
| N, N-dimethylformamid | 0.944 |
| 2-methoxyethanol | 0.965 |
| Pyridin | 0.982 |
| Kyselina propanová | 0.993 |
| Voda | 1.000 |
| 2-methoxyethylacetát | 1.009 |
| Benzonitril | 1.01 |
| L-Methyl-2-pyrrolidinon | 1.028 |
| Hexamethylfosforamid | 1.03 |
| 1,4-dioxan | 1.033 |
| Octová kyselina | 1.049 |
| Anhydrid kyseliny octové | 1.08 |
| Dimethylsulfoxid | 1.092 |
| Chlorbenzen | 1.1066 |
| Oxid deuteria | 1.107 |
| Ethylenglykol | 1.115 |
| Diethylenglykol | 1.118 |
| Propylenkarbonát | 1.21 |
| Kyselina mravenčí | 1.22 |
| 1,2-dichlorethan | 1.245 |
| Glycerol | 1.261 |
| Sirouhlík | 1.263 |
| 1,2-dichlorbenzen | 1.306 |
| Methylenchlorid | 1.325 |
| Nitromethan | 1.382 |
| 2,2,2-Trifluorethanol | 1.393 |
| Chloroform | 1.498 |
| 1,1,2-Trichlortrifluorethan | 1.575 |
| Chlorid uhličitý | 1.594 |
| Tetrachlorethylen | 1.623 |
Bezpečnost
oheň
Většina organických rozpouštědel je hořlavá nebo vysoce hořlavá, v závislosti na jejich těkavosti. Výjimkou jsou některá chlorovaná rozpouštědla dichlormethan a chloroform. Směsi par rozpouštědel a plechovky se vzduchem explodovat. Páry rozpouštědel jsou těžší než vzduch; klesnou ke dnu a mohou cestovat téměř na nezředěnou vzdálenost. Páry rozpouštědel lze také najít v údajně prázdných sudech a plechovkách, které představují a blesk nebezpečí; prázdné nádoby s těkavými rozpouštědly by proto měly být skladovány otevřené a vzhůru nohama.
Oba diethylether a sirouhlík mají výjimečně nízké teploty samovznícení které značně zvyšují riziko požáru spojené s těmito rozpouštědly. Teplota samovznícení sirouhlíku je nižší než 100 ° C (212 ° F), takže předměty jako pára trubky, žárovky, horké talíře a nedávno uhašen bunsenovy hořáky jsou schopny zapálit jeho páry.
Některá rozpouštědla, například metanol, mohou navíc hořet velmi horkým plamenem, který může být za určitých světelných podmínek téměř neviditelný.[19][20] To může oddálit nebo zabránit včasnému rozpoznání nebezpečného požáru, dokud se plameny nerozšíří na jiné materiály.
Výbušná tvorba peroxidu
Etherové jako diethylether a tetrahydrofuran (THF) mohou tvořit vysoce výbušné látky organické peroxidy při vystavení kyslíku a světlu. THF obvykle vytváří takové peroxidy pravděpodobněji než diethylether. Jedním z nejcitlivějších rozpouštědel je diisopropylether, ale všechny ethery jsou považovány za potenciální zdroje peroxidů.
Heteroatom (kyslík ) stabilizuje tvorbu a volné radikály který je tvořen abstrakcí a vodík atom jiným volným radikálem.[je zapotřebí objasnění ] Takto vytvořený volný radikál se středem na uhlí je schopen reagovat s molekulou kyslíku za vzniku peroxidové sloučeniny. Proces tvorby peroxidů je značně urychlen vystavením i nízkým úrovním světla, ale může postupovat pomalu i za tmavých podmínek.
Pokud a vysoušedlo používá se, který může zničit peroxidy, během kterých se budou koncentrovat destilace, kvůli jejich vyšší bod varu. Když se vytvoří dostatečné množství peroxidů, mohou tvořit a krystalický, nárazuvzdorná pevná látka sraženina u ústí nádoby nebo láhve. Drobné mechanické poruchy, jako je poškrábání vnitřku nádoby nebo uvolnění usazenin, pouhé zkroucení víčka, může poskytnout dostatečnou energii pro výbuch nebo vybuchnout. Při rychlém použití čerstvých rozpouštědel není tvorba peroxidu významným problémem; jsou více problémem v laboratořích, jejichž dokončení jedné lahve může trvat roky. Uživatelé s malým objemem by měli získávat pouze malá množství rozpouštědel náchylných k peroxidům a stará rozpouštědla pravidelně likvidovat.
Aby se zabránilo tvorbě výbušných peroxidů, měly by být ethery skladovány ve vzduchotěsné nádobě mimo dosah světla, protože světlo i vzduch mohou podporovat tvorbu peroxidů.[21]
K detekci přítomnosti peroxidu v etheru lze použít řadu testů; jedním z nich je použít kombinaci síran železnatý a thiokyanát draselný. Peroxid je schopen okysličovat Fe2+ iont na Fe3+ iont, který pak tvoří tmavě červenou barvu koordinační komplex s thiokyanát.
Peroxidy lze odstranit promytím kyselým síranem železnatým a přefiltrováním oxid hlinitý nebo destilační z sodík /benzofenon. Oxid hlinitý neničí peroxidy, pouze je zachycuje a musí být řádně zlikvidován. Výhodou použití sodíku / benzofenonu je to vlhkost a kyslík jsou také odstraněny.[Citace je zapotřebí ]
Zdravé efekty
Obecná zdravotní rizika spojená s expozicí rozpouštědlu zahrnují toxicitu pro nervový systém, poškození reprodukce, poškození jater a ledvin, poškození dýchacích cest, rakovinu a dermatitida.[22]
Akutní expozice
Mnoho rozpouštědel může vést k náhlé ztrátě vědomí, pokud vdechován ve velkém množství. Rozpouštědla jako diethylether a chloroform byly v medicíně používány jako anestetika, sedativa, a hypnotika na dlouhou dobu. Ethanol (obilný alkohol) je široce používaný a zneužívaný psychoaktivní droga. Diethylether, chloroform a mnoho dalších rozpouštědel, např. z benzín nebo jsou lepidla rekreačně zneužívána čichání lepidla, často se škodlivými dlouhodobými účinky na zdraví, jako je neurotoxicita nebo rakovina. Podvodné nahrazení 1,5-pentandiol psychoaktivní 1,4-butandiol subdodavatelem způsobil Bindeez stažení produktu.[23] Při požití takzvané toxické alkoholy (jiné než ethanol), jako jsou methanolu, propanol, a ethylenglykol metabolizují na toxické aldehydy a kyseliny, které jsou potenciálně smrtelné metabolická acidóza.[24] Běžně dostupný alkoholový rozpouštědlový methanol může při požití způsobit trvalou slepotu nebo smrt. Rozpouštědlo 2-butoxyethanol, použito v štěpení tekutin, může způsobit hypotenze a metabolická acidóza.[25]
Chronická expozice
Některá rozpouštědla včetně chloroform a benzen běžná složka v benzín je známo, že jsou karcinogenní, zatímco mnoho dalších je považováno za Světová zdravotnická organizace pravděpodobně karcinogeny. Rozpouštědla mohou poškodit vnitřní orgány, jako je játra, ledviny, nervový systém, nebo mozek. Kumulativní účinky dlouhodobé nebo opakované expozice rozpouštědlům se nazývají chronická rozpouštědlem indukovaná encefalopatie (CSE).
Chronické vystavení organickým rozpouštědlům v pracovním prostředí může mít řadu nežádoucích neuropsychiatrických účinků. Například pracovní expozice organickým rozpouštědlům byla spojena s vyšším počtem malířů, kteří trpí alkoholismus.[26] Ethanol má a synergický účinek při užívání v kombinaci s mnoha rozpouštědly; například kombinace toluen /benzen a ethanol způsobuje větší nevolnost /zvracení než jakákoli látka samotná.
Je známo nebo existuje podezření, že je mnoho kataraktogenních rozpouštědel, což značně zvyšuje riziko vývoje šedý zákal v oční čočce.[27] Expozice rozpouštědlům byla také spojena s neurotoxickým poškozením ztráta sluchu[28][29] a barevné vidění ztráty.[30]
Kontaminace životního prostředí
Hlavní cesta k vyvolání účinků na zdraví vzniká únikem nebo únikem rozpouštědel, které se dostanou do podloží. Vzhledem k tomu, rozpouštědla snadno migrují značné vzdálenosti, vytvoření rozšířené kontaminace půdy není neobvyklé; jedná se zejména o zdravotní riziko, pokud vodonosné vrstvy jsou ovlivněny. Vniknutí par může nastat z míst s velkou podpovrchovou kontaminací rozpouštědly.[31][Citace je zapotřebí ]
Viz také
- Volná energie solvatace
- Rozpouštědla jsou často refluxována s vhodným vysoušedlo před destilací k odstranění vody. To lze provést před chemickou syntézou, kde může voda interferovat s plánovanou reakcí
- Seznam rozpouštědel mísitelných s vodou
- Lyoluminiscence
- Ochrana zdraví při práci
- Rozdělovací koeficient (log P) je míra diferenciální rozpustnosti sloučeniny ve dvou rozpouštědlech
- Řešení
- Řešení
- Systémy rozpouštědel existují mimo oblast běžných organických rozpouštědel: Superkritické kapaliny, iontové kapaliny a hluboce eutektická rozpouštědla
- Vodní model
- Znečištění vody
Reference
- ^ Stoye, Dieter (2000). "Rozpouštědla". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a24_437.
- ^ Tinoco I, Sauer K, Wang JC (2002). Fyzikální chemie. Prentice Hall. p.134. ISBN 978-0-13-026607-1.
- ^ Lowery a Richardson, str. 181–183
- ^ Malmberg CG, Maryott AA (leden 1956). „Dielektrická konstanta vody od 0 ° do 100 ° C“. Journal of Research of the National Bureau of Standards. 56 (1): 1. doi:10,6028 / jres.056.001.
- ^ A b Lowery a Richardson, str. 177.
- ^ Kosower, E. M. (1969) „An Introduction to Physical Organic Chemistry“ Wiley: New York, str. 293
- ^ Gutmann V (1976). "Účinky rozpouštědel na reaktivitu organokovových sloučenin". Coord. Chem. Rev. 18 (2): 225. doi:10.1016 / S0010-8545 (00) 82045-7.
- ^ Lowery a Richardson, str. 183.
- ^ dcpt.ru Rozpouštědlo 646 Vlastnosti (ru)
- ^ dcpt.ru Rozpouštědlo 647 Vlastnosti (ru)
- ^ dcpt.ru Rozpouštědlo 648 Vlastnosti (ru)
- ^ dcpt.ru Solvent 650 Charakteristiky (ru)
- ^ A b Vlastnosti rozpouštědla - bod varu Archivováno 14. června 2011 v Wayback Machine. Xydatasource.com. Citováno dne 26. ledna 2013.
- ^ Dielektrická konstanta Archivováno 4. července 2010 v Wayback Machine. Makro.lsu.edu. Citováno dne 26. ledna 2013.
- ^ Diorazio, Louis J .; Hadice, David R. J .; Adlington, Neil K. (2016). „Směrem k holističtějšímu rámci pro výběr rozpouštědel“. Výzkum a vývoj organických procesů. 20 (4): 760–773. doi:10.1021 / acs.oprd.6b00015.
- ^ A b Abbott S, Hansen CM (2008). Hansenovy parametry rozpustnosti v praxi. Hansenova rozpustnost. ISBN 978-0-9551220-2-6.
- ^ A b Hansen CM (leden 2002). Parametry rozpustnosti Hansen: uživatelská příručka. CRC tisk. ISBN 978-0-8493-7248-3.
- ^ Vybrané vlastnosti rozpouštědla - specifická gravitace Archivováno 14. června 2011 v Wayback Machine. Xydatasource.com. Citováno dne 26. ledna 2013.
- ^ Fanick ER, Smith LR, Baines TM (1. října 1984). „Bezpečnostní přísady do methanolového paliva“. Série technických papírů SAE. 1. Warrendale, PA. doi:10.4271/841378. Archivováno z původního dne 12. srpna 2017.
- ^ Anderson JE, Magyarl MW, Siegl WO (1. července 1985). „Co se týče svítivosti difúzních plamenů methanolu a uhlovodíků“. Věda a technologie spalování. 43 (3–4): 115–125. doi:10.1080/00102208508947000. ISSN 0010-2202.
- ^ "Peroxidy a ethery | Environmentální zdraví, bezpečnost a řízení rizik". www.uaf.edu. Citováno 25. ledna 2018.
- ^ "Rozpouštědla". Správa bezpečnosti a ochrany zdraví při práci. Americké ministerstvo práce. Archivováno z původního dne 15. března 2016.
- ^ Rood, David (7. listopadu 2007). „National: Recall ordered for toy that changes into drug“. www.theage.com.au.
- ^ Kraut JA, Mullins ME (leden 2018). „Toxické alkoholy“. The New England Journal of Medicine. 378 (3): 270–280. doi:10.1056 / NEJMra1615295. PMID 29342392. S2CID 36652482.
- ^ Hung T, Dewitt CR, Martz W, Schreiber W, Holmes DT (červenec 2010). „Fomepizol nezabrání progresi acidózy při 2-butoxyethanolu a etanolu.“ Klinická toxikologie. 48 (6): 569–71. doi:10.3109/15563650.2010.492350. PMID 20560787. S2CID 23257894.
- ^ Lundberg I, Gustavsson A, Högberg M, Nise G (červen 1992). „Diagnózy zneužívání alkoholu a dalších neuropsychiatrických poruch mezi malíři domů ve srovnání s domácími tesaři“. British Journal of Industrial Medicine. 49 (6): 409–15. doi:10.1136 / oem.49.6.409. PMC 1012122. PMID 1606027.
- ^ Raitta C, Husman K, Tossavainen A (srpen 1976). "Změny objektivu u malířů automobilů vystavených směsi organických rozpouštědel". Albrecht von Graefes Archiv pro Klinickou a experimentální oftalmologii. Archiv Albrechta von Graefe pro klinickou a experimentální oftalmologii. 200 (2): 149–56. doi:10.1007 / bf00414364. PMID 1086605. S2CID 31344706.
- ^ Campo P, Morata TC, Hong O (duben 2013). „Chemická expozice a ztráta sluchu“. Nemoc za měsíc. 59 (4): 119–38. doi:10.1016 / j.disamonth.2013.01.003. PMC 4693596. PMID 23507352.
- ^ Johnson AC, Morata TC (2010). „Pracovní expozice chemikáliím a poškození sluchu. Severská expertní skupina pro dokumentaci kritérií zdravotních rizik pro chemikálie“ (PDF). Arbete och Hälsa. 44: 177. Archivováno (PDF) z původního dne 4. června 2016.
- ^ Mergler D, Blain L, Lagacé JP (1987). "Ztráta barevného vidění související s rozpouštědly: indikátor poškození nervů?". Mezinárodní archiv zdraví a ochrany životního prostředí. 59 (4): 313–21. doi:10.1007 / bf00405275. PMID 3497110. S2CID 33855389.
- ^ Forand SP, Lewis-Michl EL, Gomez MI (duben 2012). „Nepříznivé výsledky porodu a expozice matky trichlorethylenu a tetrachlorethylenu vniknutím půdních par ve státě New York“. Perspektivy zdraví a životního prostředí. 120 (4): 616–21. doi:10,1289 / ehp.1103884. PMC 3339451. PMID 22142966.
Bibliografie
- Lowery TH, Richardson KS (1987). Mechanismus a teorie v organické chemii (3. vyd.). Vydavatelé Harper Collins. ISBN 978-0-06-364044-3.
externí odkazy
- Nástroj pro výběr rozpouštědel ACS Green Chemistry Institute
- „European Solvents Industry Group - ESIG - ESIG European Solvents Industry Group“ Rozpouštědla v Evropě.
- Tabulka a text Přednáška O-Chem
- Tabulky Vlastnosti a toxicita organických rozpouštědel
- CDC - Organická rozpouštědla - Téma bezpečnosti a ochrany zdraví na pracovišti NIOSH
- EPA - utěrky kontaminované rozpouštědly
