Dimethylheptylpyran - Dimethylheptylpyran
 | |
| Klinické údaje | |
|---|---|
| ATC kód |
|
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Odstranění poločas rozpadu | 20–39 hodin |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
| Vzorec | C25H38Ó2 |
| Molární hmotnost | 370.577 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
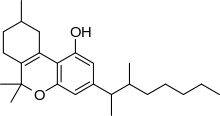
Dimethylheptylpyran (DMHP, 3- (1,2-dimethylheptyl) -A6a (10a)-THC, 1,2-dimethylheptyl-A3-THC, A-40824nebo EA-2233) je syntetický analogový z THC, který byl vynalezen v roce 1949 během pokusů o objasnění struktury Δ9-THC, jedna z aktivních složek Konopí.[1] DMHP je světle žlutý viskózní olej, který je nerozpustný ve vodě, ale rozpouští se v alkoholu nebo v nepolárních rozpouštědlech.
Účinky
DMHP má podobnou strukturu jako THC, liší se pouze polohou jedné dvojné vazby a nahrazením 3-pentylového řetězce řetězcem 3- (1,2-dimethylheptyl).[2] Produkuje podobnou aktivitu jako THC, například sedativní účinky, ale je podstatně účinnější,[3] zvláště mít mnohem silnější analgetikum a antikonvulzivum účinky než THC, i když relativně slabší psychologické účinky. Předpokládá se, že funguje jako CB1 agonista, podobným způsobem jako ostatní kanabinoid deriváty.[4][5] I když samotný DMHP byl od charakterizace kanabinoidních receptorů předmětem relativně malého studia, ukázalo se, že strukturní izomer 1,2-dimethylheptyl-Δ8-THC je vysoce účinným agonistou kanabinoidů a byla studována aktivita jeho enantiomerů odděleně.[6]
Vyšetřování jako nesmrtelné paralyzující činidlo
DMHP a jeho Ó-acetát ester byly rozsáhle vyšetřovány Americký program vojenských chemických zbraní v Experimenty Edgewood Arsenal, jak je to možné, neletální paralyzující látky.[7]
DMHP má tři stereocentra a následně má osm možných stereoizomery, které se značně liší v účinnosti. Směs všech osmi izomerů Ó-acetylester dostal kódové číslo EA-2233, přičemž osm jednotlivých izomerů bylo očíslováno EA-2233-1 až EA-2233-8. Nejúčinnějším izomerem byl EA-2233-2 s rozsahem aktivní dávky u lidí 0,5–2,8 μg / kg (tj. ~ 35–200 μg pro 70 kg dospělého). Aktivní dávky se mezi jednotlivci výrazně lišily, ale když byla dávka EA-2233 přijata do 1–2 mg, byli všichni dobrovolníci považováni za neschopné vykonávat vojenské povinnosti, přičemž účinky přetrvávaly až 2–3 dny.
DMHP se metabolizuje podobným způsobem jako THC za vzniku aktivního metabolitu 11-hydroxy-DMHP, avšak lipofilita DMHP je ještě vyšší než u samotného THC, což mu dává dlouhou dobu působení a prodloužený poločas v těle mezi 20 a 39 hodinami, přičemž poločas metabolitu 11-hydroxy-DMHP je delší než 48 hodin.
DMHP a jeho estery produkují sedace a mírné halucinogenní účinky podobné velkým dávkám THC, ale kromě toho také způsobují výrazné hypotenze (nízký krevní tlak), ke kterému dochází při dávkách hluboko pod halucinogenní dávkou, a může vést k závažným závrať, mdloby, ataxie a svalová slabost, dostačující k tomu, aby bylo obtížné stát vzpřímeně nebo provádět jakoukoli intenzivní fyzickou aktivitu.[Citace je zapotřebí ] Bylo zjištěno, že akutní toxicita DMHP je nízká ve studiích na lidech i na zvířatech, přičemž terapeutický index měřeno jako poměr ED50 na LD50 u zvířat přibližně 2 000krát, přičemž smrt nakonec vyústila v kombinaci hypotenze a podchlazení a lze mu předcházet podpůrnou léčbou.[Citace je zapotřebí ]
Kombinace silných paralyzujících účinků a příznivé bezpečnostní rezervy vedla tým Edgewood Arsenal k závěru, že DMHP a jeho deriváty, zejména O-acetylester nejaktivnějšího izomeru EA-2233-2, patří mezi nejslibnější neletální ochromující agenti vyjít z jejich výzkumného programu. Byli však znevýhodněni vytvářením těžké hypotenze v paralyzujících dávkách a nebyli tak efektivní jako obecně propagované anticholinergní látky, jako je 3-chinuklidinylbenzilát který už také byl vyzbrojen.[8] Financování dalšího vývoje nakonec nebylo schváleno a program výzkumu kanabinoidů byl na konci 70. let spolu s ostatními experimenty Edgewood Arsenal na neurčito pozastaven.[Citace je zapotřebí ]
Izomerismus

| Sedm izomerů dvojné vazby dimethylheptylpyranu a jejich 120 stereoizomerů | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Dibenzopyranové číslování | Číslování monoterpenoidů | Další chirální centra na postranním řetězci | Počet stereoizomerů | Přirozený výskyt | Úmluva o psychotropních látkách Plán | ||||
| Krátké jméno | Chirální centra v páteři dibenzopyranu | Celé jméno | Krátké jméno | Chirální centra v páteři dibenzopyranu | Číslování 1,2-dimethylheptylu | Číslování 3-methyloktan-2-ylu | |||
| Δ6a (7)-DMHP | 9 a 10a | 3- (1,2-dimethylheptyl) -8,9,10,10a-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ4-DMHP | 1 a 3 | 1 a 2 | 2 a 3 | 16 | Ne | neplánovaný |
| Δ7-DMHP | 6a, 9 a 10a | 3- (1,2-dimethylheptyl) -6a, 9,10,10a-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ5-DMHP | 1, 3 a 4 | 1 a 2 | 2 a 3 | 32 | Ne | neplánovaný |
| Δ8-DMHP | 6a a 10a | 3- (1,2-dimethylheptyl) -6a, 7,10,10a-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ6-DMHP | 3 a 4 | 1 a 2 | 2 a 3 | 16 | Ne | neplánovaný |
| Δ9,11-DMHP | 6a a 10a | 3- (1,2-dimethylheptyl) -6a, 7,8,9,10,10a-hexahydro-6,6-dimethyl-9-methylen-6H-dibenzo [b,d] pyran-1-ol | Δ1(7)-DMHP | 3 a 4 | 1 a 2 | 2 a 3 | 16 | Ne | neplánovaný |
| Δ9-DMHP | 6a a 10a | 3- (1,2-dimethylheptyl) -6a, 7,8,10a-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ1-DMHP | 3 a 4 | 1 a 2 | 2 a 3 | 16 | Ne | neplánovaný |
| Δ10-DMHP | 6a a 9 | 3- (1,2-dimethylheptyl) -6a, 7,8,9-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ2-DMHP | 1 a 4 | 1 a 2 | 2 a 3 | 16 | Ne | neplánovaný |
| Δ6a (10a)-DMHP | 9 | 3- (1,2-dimethylheptyl) -7,8,9,10-tetrahydro-6,6,9-trimethyl-6H-dibenzo [b,d] pyran-1-ol | Δ3-DMHP | 1 | 1 a 2 | 2 a 3 | 8 | Ne | Rozvrh I |
Všimněte si, že 6H-dibenzo [b,d] pyran-1-ol je stejný jako 6H-benzo [C] chromen-1-ol.
Viz také
Reference
- ^ Adams R, Harfenist M, Loewe S (1949). "Nové analogy tetrahydrokanabinolu. XIX". Journal of the American Chemical Society. 71 (5): 1624–1628. doi:10.1021 / ja01173a023.
- ^ Razdan RK (1980). „Celková syntéza kanabinoidů“. Celková syntéza přírodních produktů, svazek 4. Celková syntéza přírodních produktů. Wiley-Interscience. 185–262. doi:10.1002 / 9780470129678.ch2. ISBN 9780471054603.
- ^ Wilkison DM, Pontzer N, Hosko MJ (červenec 1982). „Zpomalení kortikální somatosenzorické vyvolané aktivity delta 9-tetrahydrokanabinolem a dimethylheptylpyranem u koček v anestezii alfa-chloralózou“. Neurofarmakologie. 21 (7): 705–9. doi:10.1016/0028-3908(82)90014-4. PMID 6289158. S2CID 35663464.
- ^ Winn M, Arendsen D, Dodge P, Dren A, Dunnigan D, Hallas R, Hwang K, Kyncl J, Lee YH, Plotnikoff N, Young P, Zaugg H. Drogy odvozené od kanabinoidů. 5. delta6a, 10a-tetrahydrokanabinol a heterocyklické analogy obsahující aromatické postranní řetězce. J Med Chem. 1976 duben; 19 (4): 461-71. doi:10.1021 / jm00226a003 PMID 817021
- ^ Parker LA, Mechoulam R (2003). „Kanabinoidní agonisté a antagonisté modulují podmíněné štěpení vyvolané lithiem u potkanů“. Integrativní fyziologická a behaviorální věda. 38 (2): 133–45. doi:10.1007 / BF02688831. PMID 14527182. S2CID 38974868.
- ^ Huffman JW a kol. Syntéza a farmakologie 1 ', 2'-dimethylheptyl-Δ8-THC izomerů: výjimečně silné kanabinoidy. Dopisy o bioorganické a léčivé chemii 1997; 7(21): 2799-2804. doi:10.1016 / S0960-894X (97) 10086-5
- ^ Možné dlouhodobé zdravotní účinky krátkodobé expozice chemickým látkám. Sv. 2: Cholinesterázové reaktivátory, psychochemikálie a dráždivé látky a vesikanty. Komise pro biologické vědy. Národní akademie Press. 1984. str. 79–99.
- ^ Ketchum JS (2006). Tajemství chemické války téměř zapomenuta. ChemBooks Inc. ISBN 978-1-4243-0080-8..
