Remacemid - Remacemide
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Ecovia[1] |
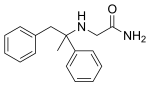
| Ostatní jména | (±) -2-amino-N- [l, 2-di (fenyl) propan-2-yl] acetamidPR 934-423 |
| Trasy z správa | ústní |
| ATC kód |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
| Vzorec | C17H20N2Ó |
| Molární hmotnost | 268.360 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Remacemid je lék který funguje jako nízká afinita Antagonista NMDA s sodík kanál blokovací vlastnosti.[2] Byl studován pro léčbu akutních onemocnění cévní mozková příhoda,[3][4] epilepsie,[5] Huntingtonova choroba, a Parkinsonova choroba.
Protože remacemid má jen mírný účinek na frekvenci záchvatů a jejich příčiny závrať, již se nevěří, že remacemid bude účinnou léčbou epilepsie.[6] Ačkoli nebylo učiněno žádné takové prohlášení o potenciálu remacemidu při léčbě mrtvice, Huntingtonova nebo Parkinsonova, remacemid se již pro tyto stavy nevyvíjí.[Citace je zapotřebí ]
Remacemid je také známý jako remacemid hydrochlorid, (±) -2-amino-N- (1-methyl-1,2-difenylethyl) -acetamid-hydrochlorid nebo FPL 12924AA.[7]
Nepříznivé účinky
Nedostatek nepříznivých účinků
Na rozdíl od mnoha jiných způsobů léčby epilepsie se zdá, že remacemid nenarušuje kognitivní výkon[9][10][11] nebo jízdní výkon[12] u lidí, ačkoli důkazy o účincích na kognitivní výkon u zvířat byly smíšené.[13][14][15][16][17] Remacemid není sedativum.[18]
Toxicita
The střední toxická dávka remacemidu pro testy neurální poruchy u myší je 5,6 mg / kg.[18]Jeho odhad střední smrtelná dávka je přibližně 927,3 mg / kg u myší.[18]Má příznivé terapeutický index 28,1 u myší.[18]
Lékové interakce
Levodopa
Remacemid zpomaluje absorpci levodopa (300 mg remacemidu jednu hodinu před léčbou levodopou prodlužuje průměrnou dobu do dosažení maximální plazmatické koncentrace levodopy o 20%), ale nikoli jeho celková absorpce (plocha pod křivkou pro plazmatickou koncentraci levodopy se nezměnila).[19]
Valproát sodný
Remacemid neinteraguje s valproát sodný, léčba epilepsie.[20]
Karbamazepin
Ramacemid interaguje s karbamazepin. Remacemid inhibuje metabolismus karbamazepinu, zatímco karbamazepin indukuje metabolismus remacemidu a FPL 12495.[21]
Alkohol
Soli remacemidu
Remacemid se nejčastěji syntetizuje jako sůl remacemid hydrochlorid. Bylo však provedeno určité zkoumání dalších solí remacemidu a jejich solí krystaly, protože různé soli remacemidu mohou chutnat příjemněji nebo mohou mít rozpustnost vhodnější pro pediatrické použití suspenze formulace.[22]
Mechanismus účinku
Remacemid se váže slabě a nesoutěžně na místo iontového kanálu v Komplex receptoru NMDA.[7] Remacemid se váže jak astericky, tak v kanálu.[23] Protože se však remacemid váže tak slabě na NMDAR, většina z remacemidu in vivo účinek proti excitotoxicita Předpokládá se, že je způsobena jeho metabolickou přeměnou na účinnější derivát desglycinu FPL 12495.[7] To znamená, že remacemid může ve skutečnosti působit jako proléčivo doručit aktivní metabolit FPL 12495 do centrálního nervového systému.[24]
Epilepsie
V dobře ověřeném a popsaném genetickém modelu nepřítomnosti epilepsie bylo zjištěno, že potkany kmene WAG / Rij, remacemidu a jeho metabolitu FPL 12495 mají společný účinek na obvyklý účinek antagonisty glutamátu na počet výbojů špice / vlnaEEG, léky snižují dávku / vlnu v závislosti na dávce. Avšak na rozdíl od většiny ostatních antagonistů glutamátu zvýšila FPL 12495 dobu trvání výbojů špičatými vlnami.[25]
Farmakokinetika
Krev-mozková bariéra
Index absorpce mozku (BUI), míra schopnosti drogy projít hematoencefalická bariéra který zahrnuje injekci radioaktivně značené zkoušené a referenční látky do společná krční tepna anestetizovaných zvířat,[26][27] pro remacemid je 51 ± 0,9 SD.[24]
Enantiomery
The (-)stereoizomer Remacemid má stejnou účinnost jako racemická směs při prevenci maximálních záchvatů elektrošoků při perorálním podání krysám, zatímco (+) stereoizomer je méně účinný.[28]
Metabolity
FPL 12495
Hodně z účinku remacemidu in vivo Předpokládá se, že je způsoben derivátem desglycinu FPL 12495 (±).[7]FPL 12495 (±) se váže specificky a nekompetitivně na NMDAR.[29] Jeho účinek na maximální elektrokonvulzivní šok je více silný než remacemid.[7] The S izomer (FPL 12859) je ještě účinnější než racemická směs, zatímco R izomer je méně účinný než racemát.[7]
FPL 12495 se někdy označuje jako ARL 12495AA.[30][31][32]
Další metabolity
FPL 15053
FPL 15053 je N-hydroxy-desglycinát remacemidu a vykazuje mírnou vazbu na NMDAR a mírné účinky na křeče a úmrtnost u testovaných myší a potkanů.[7]
FPL 14331 a FPL 14465
FPL 14331 a FPL 14465 jsou str-hydroxy-desglycináty remacemidu a vykazují určitou účinnost proti maximálnímu elektrokonvulzivnímu šoku po i.p. a i.v. dávkování.[7]
FPL 15455
FPL 15455 je oxoacetátový matabolit remacemidu, ale nemá prokázanou biologickou aktivitu.[7]
FPL 14991 a FPL 14981
FPL 14991 a FPL 14981 jsou oba β-Miydroxy-desglycináty remacemidu a vykazují nízkou účinnost proti maximálnímu elektrokonvulzivnímu šoku u myší.[7] Nicméně FPL 14981 a ne FPL 14991 brání NMDLA vyvolaným křečím a úmrtnosti u myší.[7]
FPL 13592 a FPL 15112
Hydroxy-methylderivát remacemidu (FPL 13592) a jeho desglycinát (FPL 15112) zabraňuje křečím vyvolaným elektrickým šokem až po i.v. správa; pouze derivát desglycinu se váže na NMDAR.[7]
FPL 14467
FPL 14467 (str-dihydroxy-desglycin) je neaktivní in vivo a slabý ve vazbě na NMDAR.[7]
Farmakodynamika
The hodnoty pro 50% posunutí z [3H] MK801 byly 68 μM pro remacemid a 0,48 μM pro FPL 12495AA.[7]
Dějiny
Aktuální stav
Remacemid je experimentální droga naposledy byla vyvinuta britskou nadnárodní společností farmaceutická společnost AstraZeneca. Od roku 2000 však o jeho pokroku existují jen malé zprávy. Několik zdrojů naznačuje, že jeho vývoj byl zastaven.[33][34]
Výměna rukou
Remacemid byl jedním z posledních léčiv vyvíjených dnes již zaniklou anglickou farmaceutickou společností Fisons.[35] V roce 1995 byla získána spolu s většinou Fisonsových výzkum a vývoj operace švédské farmaceutické společnosti Astra,[36] která se v roce 1999 spojila s britskou společností Zeneca tvořit AstraZeneca.[37] V roce 2000 společnost AstraZeneca zvažovala možnost licencování remacemidu jiné farmaceutické společnosti,[38] ale od té doby bylo o remacemidu málo zpráv. Vývoj přípravku Remacemide mohl být ukončen v červenci 2001.[34]
Objev a vývoj pod Fisons
V roce 1990 vědci z Fisonsu zjistili, že remacemid působí jako antikonvulzivum u myší a potkanů[18][28] .[39] Vzhledem k potenciálu remacemidu jako a neuroprotektivní agenta prostřednictvím prevence toxicita glutamátu, to bylo brzy také vyšetřováno jako léčba pro Huntingtonova choroba[40] a Parkinsonova choroba.[41]
Astra
Do roku 1995, kdy Astra získal remacemid, už byl v Fáze IIb klinický vývoj jako antiepileptikum[36] a Fáze I klinický vývoj jako léčba Huntingtonova.[40][42]
AstraZeneca
Do roku 1998, kdy Astra oznámila fúzi s Zeneca remacemid postoupil do Fáze III pokusy o epilepsii a Fáze II pokusy o Parkinsonovu chorobu a společnost Astra také zkoumala její potenciál léčby neuropatická bolest[43]
V roce 1999, po fúzi, AstraZeneca uvedla, že vyšetřuje jeho remacemid neuroprotektivní účinky a že plánovali regulační podání pro Huntingtonova choroba v roce 2001 a pro Parkinsonova choroba a epilepsie v roce 2003.[44]
Remacemid pod obchodním názvem Ecovia byl označen jako lék na vzácná onemocnění pro léčbu Huntingtonova choroba podle FDA v březnu 2000.[1]
Remacemid byl naposledy zmíněn v AstraZeneca zprávy o jeho VaV plynovod v roce 2000, kdy byl v Fáze III klinické testy pro remacemid při léčbě Huntingtonova choroba a Fáze II pro léčbu Parkinsonova choroba. V té době bylo podání Nová aplikace drog (NDA) do FDA a Žádost o registraci do CHMP byl promítán pro Huntington's v roce 2001 a pro Parkinsonovu po roce 2003,[38] ale o takovém podání nebyly žádné zprávy. V této zprávě bylo také uvedeno, že remacemid byl „ve strategickém přezkumu a potenciálním kandidátem na licenční činnost“[38] (viz externí článek o drogách licencování.)
Aktuální novinky
Podle studijní skupiny Huntington neexistují žádné klinické studie remacemidu,[45] a Parkinsonova studijní skupina.[46]
Dostupnost
Remacemid je experimentální droga není k dispozici veřejnosti a v současné době neprobíhá klinické testy. Je k dispozici pro výzkumné účely od společnosti Tocris Bioscience na základě licence od společnosti AstraZeneca.[47]
Viz také
Reference
- ^ A b FDA (05.05.2009). „Kumulativní seznam všech produktů, které obdržely označení pro vzácná onemocnění“ (dokument aplikace Excel). FDA. Citováno 28. dubna 2012.
- ^ Santangeli S, Sills GJ, Thompson GG, Brodie MJ (březen 2002). „Účinky remacemidu a desglycinyl-remacemidu na (+) kanál v kortikálních synaptosomech potkanů“. European Journal of Pharmacology. 438 (1–2): 63–8. doi:10.1016 / S0014-2999 (02) 01297-9. PMID 11906711.
- ^ Muir KW, Lees KR (září 1995). "Počáteční zkušenosti s hydrochloridem remacemidu u pacientů s akutní ischemickou cévní mozkovou příhodou". Annals of the New York Academy of Sciences. 765 (1 Neuroprotecti): 322–3. Bibcode:1995NYASA.765..322M. doi:10.1111 / j.1749-6632.1995.tb16602.x. PMID 7486631.
- ^ Dyker AG, Lees KR (září 1999). „Remacemid hydrochlorid: dvojitě zaslepená, placebem kontrolovaná studie bezpečnosti a snášenlivosti u pacientů s akutní ischemickou cévní mozkovou příhodou“. Mrtvice. 30 (9): 1796–801. doi:10.1161 / 01.STR.30.9.1796. PMID 10471426.
- ^ Wesnes KA, Edgar C, Dean AD, Wroe SJ (březen 2009). „Kognitivní a psychomotorické účinky remacemidu a karbamazepinu u nově diagnostikované epilepsie“. Epilepsie a chování. 14 (3): 522–8. doi:10.1016 / j.yebeh.2008.11.012. PMID 19111629.
- ^ A b Leach JP, Marson AG, Hutton JL (2002). „Remacemid pro lékovou rezistentní epilepsii související s lokalizací“. Cochrane Database of Systematic Reviews (4): CD001900. doi:10.1002 / 14651858.CD001900. PMID 12519561.
- ^ A b C d E F G h i j k l m n Palmer GC, Murray RJ, Wilson TC, Eisman MS, Ray RK, Griffith RC a kol. (Červen 1992). "Biologický profil metabolitů a potenciálních metabolitů antikonvulzivního remacemidu". Výzkum epilepsie. 12 (1): 9–20. doi:10.1016/0920-1211(92)90086-9. PMID 1388119.
- ^ A b „Multicentrická randomizovaná kontrolovaná studie s remacemid-hydrochloridem jako monoterapií pro PD. Parkinsonova studijní skupina“. Neurologie. 54 (8): 1583–8. Dubna 2000. doi:10.1212 / ml. 54.8.1583. PMID 10762497.
- ^ Lockton J, Cole G, Hammersley M, Wesnes K (1998). „Kognitivní funkce není remakemidem ovlivněna v terapeuticky relevantních jednotlivých dávkách.“ J Psychopharmacol. 12 (A41).
- ^ Lockton JA, Wesnes KA, Yeates N, Rolan P, Diggory G (1998). "Remacemid neovlivňuje kognitivní funkce po opakovaném podání". J Psychopharmacol. 12 (A41).
- ^ Wesnes KA, Edgar C, Dean AD, Wroe SJ (březen 2009). „Kognitivní a psychomotorické účinky remacemidu a karbamazepinu u nově diagnostikované epilepsie“. Epilepsie a chování. 14 (3): 522–8. doi:10.1016 / j.yebeh.2008.11.012. PMID 19111629.
- ^ Ramaekers G, Lamers J, Verhey F, Muntjewerff D, Mobbs E, Sanders N a kol. (Leden 2002). „Srovnávací studie účinků karbamazepinu a antagonisty receptoru NMDA remacemidu na sledování silnic a sledování automobilů ve skutečném provozu.“ Psychofarmakologie. 159 (2): 203–10. doi:10,1007 / s002130100898. PMID 11862350.
- ^ Wright LK, Pearson EC, Hammond TG, Paule MG (květen - červen 2007). "Behaviorální účinky spojené s chronickou expozicí ketaminu nebo remacemidu u potkanů". Neurotoxikologie a teratologie. 29 (3): 348–59. doi:10.1016 / j.ntt.2006.12.004. PMID 17291718.
- ^ Popke EJ, Allen RR, Pearson EC, Hammond TG, Paule MG (1. července 2001). „Diferenciální účinky dvou antagonistů NMDA receptoru na kognitivně-behaviorální vývoj u nelidských primátů I“. Neurotoxikologie a teratologie. 23 (4): 319–32. doi:10.1016 / S0892-0362 (01) 00156-8. PMID 11485835.
- ^ Popke EJ, Allen RR, Pearson EC, Hammond TG, Paule MG (1. července 2001). „Diferenciální účinky dvou antagonistů NMDA receptorů na kognitivně-behaviorální výkon u mladých nelidských primátů II“. Neurotoxikologie a teratologie. 23 (4): 333–47. doi:10.1016 / S0892-0362 (01) 00138-6. PMID 11485836.
- ^ Popke EJ, Patton R, Newport GD, Rushing LG, Fogle CM, Allen RR a kol. (1. března 2002). „Posouzení potenciální toxicity MK-801 a remacemidu: chronická expozice u juvenilních opic rhesus“. Neurotoxikologie a teratologie. 24 (2): 193–207. doi:10.1016 / S0892-0362 (02) 00206-4. PMID 11943507.
- ^ Paule MG, Fogle CM, Allen RR, Pearson EC, Hammond TG, Popke EJ (květen 2003). „Chronická expozice blokátorům NMDA receptorů a sodíkových kanálů během vývoje u opic a potkanů: dlouhodobé účinky na kognitivní funkce“. Annals of the New York Academy of Sciences. 993 (1): 116–22, diskuse 123-4. doi:10.1111 / j.1749-6632.2003.tb07519.x. PMID 12853303.
- ^ A b C d E Stagnitto ML, Palmer GC, Ordy JM, Griffith RC, Napier JJ, Becker CN a kol. (Září – říjen 1990). „Preklinický profil remacemidu: nový antikonvulzivum účinný proti maximálním záchvatům elektrošoků u myší“. Výzkum epilepsie. 7 (1): 11–28. doi:10.1016/0920-1211(90)90050-6. PMID 1963406.
- ^ „Dopad remacemidiumchloridu na koncentrace levodopy při Parkinsonově nemoci. Parkinsonova studijní skupina“. Klinická neurofarmakologie. 22 (4): 220–5. Červenec – srpen 1999. PMID 10442252.
- ^ Leach JP, Girvan J, Jamieson V, Jones T, Richens A, Brodie MJ (červen 1997). „Nedostatek farmakokinetických interakcí mezi remacemid hydrochloridem a valproátem sodným u pacientů s epilepsií“. Záchvat. 6 (3): 179–84. doi:10.1016 / S1059-1311 (97) 80003-9. PMID 9203245.
- ^ Leach JP, Blacklaw J, Jamieson V, Jones T, Richens A, Brodie MJ (listopad 1996). „Vzájemná interakce mezi remacemid-hydrochloridem a karbamazepinem: dva léky s aktivními metabolity“. Epilepsie. 37 (11): 1100–6. doi:10.1111 / j.1528-1157.1996.tb01031.x. PMID 8917061.
- ^ Lewis GR, Steele G, McBride L, Florence AJ, Kennedy AR, Shankland N a kol. (1. března 2005). „Hydrofobní vs. hydrofilní: iontová konkurence ve strukturách solí remacemidu“. Růst a design krystalů. 5 (2): 427–438. doi:10.1021 / cg049836u.
- ^ Subramaniam S, Donevan SD, Rogawski MA (leden 1996). „Blokování N-methyl-D-aspartátového receptoru remacemidem a jeho metabolitem des-glycinu“. The Journal of Pharmacology and Experimental Therapeutics. 276 (1): 161–8. PMID 8558426.
- ^ A b Heyn H, McCarthy DJ, Curry SH, Eisman MS, Anders MW (květen - červen 1994). "Příjem mozku a biotransformace remacemid hydrochloridu, nového antikonvulziva". Metabolismus a dispozice léků. 22 (3): 443–6. PMID 8070322.
- ^ van Luijtelaar EL, Coenen AM (duben 1995). „Účinky remacemidu a jeho metabolitu FPL 12495 na výboje hrotovými vlnami, elektroencefalogram a chování u potkanů bez epilepsie“. Neurofarmakologie. 34 (4): 419–25. doi:10.1016 / 0028-3908 (95) 00008-T. hdl:2066/28626. PMID 7566473.
- ^ Hardebo JE, Nilsson B (říjen 1979). „Odhad mozkové extrakce cirkulujících sloučenin metodou indexu absorpce mozkem: vliv doby oběhu, objemové injekce a průtoku krve mozkem“. Acta Physiologica Scandinavica. 107 (2): 153–9. doi:10.1111 / j.1748-1716.1979.tb06455.x. PMID 525379.
- ^ Oldendorf WH, Pardridge WM, Braun LD, Crane PD (květen 1982). "Měření využití glukózy v mozku pomocí vymývání po injekci karotidy u krysy". Journal of Neurochemistry. 38 (5): 1413–8. doi:10.1111 / j.1471-4159.1982.tb07920.x. PMID 7062059.
- ^ A b Garske GE, Palmer GC, Napier JJ, Griffith RC, Freedman LR, Harris EW a kol. (Září 1991). "Preklinický profil antikonvulzivního remacemidu a jeho enantiomerů u krysy". Výzkum epilepsie. 9 (3): 161–74. doi:10.1016 / 0920-1211 (91) 90050-p. PMID 1660399.
- ^ Hu RQ, Davies JA (prosinec 1995). "Účinek desglycinylového metabolitu remacemidu na kortikální klíny připravené z myší DBA / 2". European Journal of Pharmacology. 287 (3): 251–6. doi:10.1016/0014-2999(95)00500-5. PMID 8991798.
- ^ Norris SK, King AE (červenec 1997). „Elektrofyziologické účinky antikonvulzivního hydrochloridu remacemidu a jeho metabolitu ARL 12495AA na hipokampální neurony potkanů CA1 in vitro“. Neurofarmakologie. 36 (7): 951–9. doi:10.1016 / S0028-3908 (97) 00069-5. PMID 9257939.
- ^ Leach JP, Sills GJ, Butler E, Forrest G, Thompson GG, Brodie MJ (červenec 1997). „Neurochemické účinky desglycinylového metabolitu remacemid hydrochloridu (ARL 12495AA) v myším mozku“. British Journal of Pharmacology. 121 (5): 923–6. doi:10.1038 / sj.bjp.0701219. PMC 1564774. PMID 9222548.
- ^ Norris SK, King AE (červen 1997). „Stereo-izomery antikonvulzivního ARL 12495AA omezují trvalé opakované vypalování a modifikují vlastnosti akčního potenciálu potkaních hipokampálních neuronů in vitro.“ The Journal of Pharmacology and Experimental Therapeutics. 281 (3): 1191–8. PMID 9190853.
- ^ „Online databáze remacemidu () UKMi pro nové léky“. Citováno 2. května 2012.
- ^ A b "remacemid AstraZeneca ukončen, Evropa, USA, Kanada (epilepsie)". Zprávy o drogových drogách zaměřené na výzkum a vývoj. 15. března 2004. Archivovány od originál dne 18. května 2013. Citováno 2. května 2012.
- ^ „FISONY ZASTAVUJÍ TIPREDANE DEV'T“. farmaceutický dopis. 12. dubna 1993. Citováno 28. dubna 2012.
- ^ A b „Švédská Astra kupuje většinu Fisons R&D Ops“. farmaceutický dopis. 27. března 1995. Citováno 28. dubna 2012.
- ^ "Historie společnosti AstraZeneca". AstraZeneca. Citováno 29. dubna 2012.
- ^ A b C „Potrubí výzkumu a vývoje AstraZeneca: NCE“. AstraZeneca. 2000. Citováno 28. dubna 2012.
- ^ Palmer GC, Harris EW, Napier JJ, Stagnitto ML, Garske GE, Griffith RC, Swinyard EA (1990). „Status PR 934-423, nového antikonvulziva zaměřeného na generalizované tonické / klonické záchvaty (nové označení je FPL 12924AA)“. Pokrok v klinickém a biologickém výzkumu. 361: 435–41. PMID 2290849.
- ^ A b Kieburtz K, Feigin A, McDermott M, Como P, Abwender D, Zimmerman C a kol. (Květen 1996). „Kontrolovaná studie s remacemid hydrochloridem u Huntingtonovy choroby“. Poruchy pohybu. 11 (3): 273–7. doi:10,1002 / mds.870110310. PMID 8723144.
- ^ Greenamyre JT, Eller RV, Zhang Z, Ovadia A, Kurlan R, Gash DM (červen 1994). „Antiparkinsonické účinky remacemid hydrochloridu, antagonisty glutamátu, na modelech Parkinsonovy nemoci u hlodavců a primátů“. Annals of Neurology. 35 (6): 655–61. doi:10,1002 / analog. 410350605. PMID 8210221.
- ^ „Dokončené klinické studie“. Huntingtonova studijní skupina. 2010. Archivovány od originál dne 28. června 2012. Citováno 29. dubna 2012.
- ^ „Výroční zpráva Astra 98“ (PDF). Stellan Ståls Grafiska AB. Citováno 28. dubna 2012.
- ^ Polinsky R. „AstraZeneca CNS“. AstraZeneca. Citováno 27. dubna 2012.
- ^ „Probíhají klinické studie a pozorovací studie“. Huntingtonova studijní skupina. 2010. Archivovány od originál dne 18. května 2009. Citováno 29. dubna 2012.
- ^ „Probíhají klinické studie - studijní skupina pro Parkinsonovu chorobu“. Archivovány od originál dne 11. září 2011. Citováno 2. května 2012.
- ^ "Remacemid hydrochlorid, kat. Č. 1622". Tocris. Citováno 29. dubna 2012.
