Sibutramin - Sibutramine
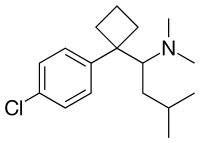 | |
 Sibutramin (nahoře), (S) - (-) - sibutramin (dole) | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Meridia, další |
| Ostatní jména | BTS-54524 |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a601110 |
| Těhotenství kategorie |
|
| Trasy z správa | Ústní (kapsle ) |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Farmakokinetické data | |
| Biologická dostupnost | Absorpce 77%, značná metabolismus prvního průchodu |
| Vazba na bílkoviny | 97% (94% pro jeho desmethyl metabolity, M1 & M.2) |
| Metabolismus | Jaterní (CYP3A4 - zprostředkovaný) |
| Odstranění poločas rozpadu | 1 hodina (sibutramin), 14 hodin (M.1) & 16 hodin (M.2) |
| Vylučování | Moč (77%), výkaly (8%) |
| Identifikátory | |
| |
| Číslo CAS |
|
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.130.097 |
| Chemické a fyzikální údaje | |
| Vzorec | C17H26ClN |
| Molární hmotnost | 279.85 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| (ověřit) | |
Sibutramin, dříve prodávané pod značkou Meridia mimo jiné je potlačující chuť k jídlu který byl v mnoha zemích ukončen. Do roku 2010 byl široce uváděn na trh a předepisován jako doplněk při léčbě obezita spolu s strava a cvičení. Bylo to spojeno se zvýšeným kardiovaskulární příhody a tahy a byl stažen z trhu v několika zemích a regionech včetně Austrálie,[1] Kanada,[2]Čína,[3] the Evropská unie,[4] Hongkong,[5] Indie,[6] Mexiko, Nový Zéland,[7] the Filipíny,[8] Thajsko,[9] the Spojené království,[10] a Spojené státy.[11] Droga však zůstává v některých zemích dostupná.[12]
Sibutramin byl původně vyvinut v roce 1988 společností Boty v Nottingham, SPOJENÉ KRÁLOVSTVÍ.,[13] a prodávaný společností Knoll Pharmaceuticals poté, co společnost BASF / Knoll AG koupila divizi Boots Research v roce 1995, a naposledy ji vyráběla a prodávala Abbott Laboratories před jeho stažením z většiny trhů. Bylo prodáváno pod různými značkami, včetně Reductil, Meridia, Siredia a Sibutrex. Je klasifikován jako a Rozvrh IV regulovaná látka v Spojené státy.
Lékařské použití
Sibutramin se používá k vyvolání potlačení chuti k jídlu za účelem dosažení ztráta váhy při léčbě pacientů s obezitou.
Kontraindikace
Sibutramin je kontraindikován u pacientů s:
- Psychiatrické stavy jako mentální bulimie, mentální anorexie vážně Deprese nebo již existující mánie
- Pacienti s anamnézou nebo náchylností ke zneužívání drog nebo alkoholu
- Přecitlivělost na lék nebo na kteroukoli z neaktivních složek
- Pacienti mladší 18 let a starší 65 let[14]
- Souběžná léčba a Inhibitor MAO, antidepresivum nebo jiný centrálně aktivní léčiva, zejména jiná teoretická východiska
- Historie onemocnění periferních tepen
- Hypertenze není dostatečně kontrolován (např.> 145/90 mmHg), opatrnost u kontrolované hypertenze
- Existující Plicní Hypertenze
- Stávající poškození srdečních chlopní, ischemická choroba srdeční, městnavé srdeční selhání, závažné arytmie, předchozí infarkt myokardu
- Anamnéza ischemické choroby srdeční (např. Angina pectoris, infarkt myokardu v anamnéze), městnavé srdeční selhání, tachykardie, okluzivní onemocnění periferních arterií, arytmie nebo cerebrovaskulární onemocnění (cévní mozková příhoda nebo přechodný ischemický záchvat (TIA))[14]
- Mrtvice nebo přechodný ischemický záchvat (TIA)
- Hypertyreóza (hyperaktivní štítná žláza)
- Uzavřený úhel glaukom
- Záchvat poruchy
- Rozšíření prostata žláza s zadržování moči (relativní kontraindikace)
- Feochromocytom
- Těhotná a kojící ženy (relativní kontraindikace)
Vedlejší efekty
Vyšší počet kardiovaskulární příhody byl pozorován u lidí užívajících sibutramin oproti kontrole (11,4% vs. 10,0%).[15] V roce 2010 FDA zaznamenala obavy, že sibutramin zvyšuje riziko infarkty a tahy u pacientů s anamnézou kardiovaskulárních onemocnění.[15]
Často se setkáváme vedlejší efekty jsou: sucho v ústech, paradoxně zvýšená chuť k jídlu, nevolnost, podivná chuť v ústech, podrážděný žaludek, zácpa, potíže se spánkem, závratě, ospalost, menstruační křeče / bolest, bolest hlavy, návaly nebo bolest kloubů / svalů.
Sibutramin se může podstatně zvýšit krevní tlak a srdeční frekvence u některých pacientů.[16] Proto je třeba provádět pravidelné monitorování.
Následující nežádoucí účinky jsou časté, ale závažné a vyžadují okamžitou lékařskou pomoc: srdeční arytmie, parestézie, změny duševní / nálady (např. vzrušení, neklid, zmatenost, deprese, vzácné myšlenky na sebevražda ).
Příznaky vyžadující okamžitou lékařskou pomoc jsou záchvaty problémy s močením, abnormální modřiny nebo krvácení, melena, hemateméza, žloutenka, horečka a přísnosti, bolest na hrudi, hemiplegie abnormální vidění, dušnost a otok.
V současné době žádný případ Plicní Hypertenze bylo zaznamenáno. (Fenfluramin, kombinace 90. let „Fen-Phen“, vynútil nadměrné uvolňování neurotransmiterů - jiný účinek. Fentermin nebyl zapojen do vzácných - ale klinicky významných - srdečních problémů fenfluraminu.)
Interakce
Sibutramin má řadu klinicky významných interakcí. Současné užívání sibutraminu a inhibitory monoaminooxidázy (MAOI, jako např selegilin ) není indikováno, protože může zvýšit riziko serotoninový syndrom, poněkud vzácné, ale vážné nežádoucí reakce na léky.[17] Sibutramin by neměl být užíván do dvou týdnů od ukončení nebo zahájení IMAO. Užívání sibutraminu a určitých léků používaných při léčbě migrény -jako ergoliny a triptany -stejně jako opioidy, může také zvyšovat riziko serotoninového syndromu, stejně jako užívání více než jednoho inhibitoru zpětného vychytávání serotoninu současně.[17]
Současné užívání sibutraminu a léků, které inhibují CYP3A4, jako ketokonazol a erythromycin, může zvýšit plazmatické hladiny sibutraminu.[18]Sibutramin neovlivňuje účinnost hormonální antikoncepce.[17]
Farmakologie
Farmakodynamika
| Sloučenina | SERT | SÍŤ | DAT |
|---|---|---|---|
| Sibutramin | 298–2,800 | 350–5,451 | 943–1,200 |
| Desmethylsibutramin | 15 | 20 | 49 |
| (R) -Desmethylsibutramin | 44 | 4 | 12 |
| (S) -Desmethylsibutramin | 9,200 | 870 | 180 |
| Didesmethylsibutramin | 20 | 15 | 45 |
| (R) -Didesmethylsibutramin | 140 | 13 | 8.9 |
| (S) -Didesmethylsibutramin | 4,300 | 62 | 12 |
| Hodnoty jsou K.i (nM). | |||
Sibutramin je a inhibitor zpětného vychytávání monoaminu (MRI), která u lidí snižuje zpětné vychytávání z norepinefrin (o ~ 73%), serotonin (o ~ 54%) a dopamin (o ~ 16%),[21] čímž se zvyšuje hladina těchto látek v synaptické rozštěpy a pomáhá vylepšovat sytost; Především se předpokládá, že serotonergní působení ovlivňuje chuť k jídlu. Starší anorektický agenti jako amfetamin a fenfluramin vynucení uvolňování těchto neurotransmiterů spíše než ovlivnění jejich zpětného vychytávání.[22]
Přes mechanismus působení podobný tricyklická antidepresiva, sibutramin neprokázal antidepresivum vlastnosti ve studiích na zvířatech. Byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA) v listopadu 1997[23] pro léčbu obezity.
Sibutramin je údajně a proléčivo na dva aktivní metabolity, desmethylsibutramin (M1; BTS-54354) a didesmethylsibutramin (M2; BTS-54505), s mnohem větší účinností jako MRI.[24][25]
Na rozdíl od jiných serotonergních látek potlačujících chuť k jídlu fenfluramin, sibutramin a jeho metabolity mají jen nízké a pravděpodobně bezvýznamné afinita pro 5-HT2B receptor.[21]
Farmakokinetika
Sibutramin je dobře absorbován z gastrointestinální trakt (77%), ale podstoupí značné metabolismus prvního průchodu, což snižuje jeho biologickou dostupnost. Samotná droga dosahuje svého vrcholu plazma úroveň po 1 hodině a má také poločas 1 hodiny. Sibutramin je metabolizován cytochrom P450 isozym CYP3A4 na dvě farmakologicky aktivní primární a sekundární aminy (nazývané aktivní metabolity 1 a 2) s poločasy 14, respektive 16 hodin. Maximální plazmatické koncentrace aktivních metabolitů 1 a 2 je dosaženo po třech až čtyřech hodinách. Následující metabolická cesta má za následek hlavně dva neaktivní konjugované a hydroxylované metabolity (nazývané metabolity 5 a 6). Metabolity 5 a 6 se vylučují hlavně močí.
Chemie
Sibutramin se obvykle používá ve formě hydrochlorid monohydrát sůl.
Detekce v tělních tekutinách
Sibutramin a jeho dva aktivní N-dimethylované metabolity lze měřit v biofluidy podle kapalinová chromatografie -hmotnostní spektrometrie. Plazmatické hladiny těchto tří druhů jsou obvykle v rozmezí 1–10 μRozsah g / l u osob podstupujících léčbu tímto lékem. Mateřská sloučenina a norsibutramin často nejsou detekovatelné v moči, ale dinorsibutramin je obecně přítomen v koncentracích> 200 μg / l.[26][27][28]
Společnost a kultura
Regulační schválení
Probíhají studie týkající se zpráv o náhlé smrti, srdeční selhání, selhání ledvin a gastrointestinální problémy. Přes petici 2002 předloženou Ralph Nader -Založený Nevládní organizace Veřejný občan,[29] FDA se nepokusil stáhnout drogu, ale byl součástí jednání Senátu v roce 2005.[30] Podobně, David Graham, „Informátor“ FDA, svědčil před a Finanční výbor Senátu slyšení, že sibutramin může být nebezpečnější než podmínky, pro které se používá.[31]
V období od ledna 2003 do listopadu 2005 rozsáhlá randomizovaná kontrolovaná studie „Sibutramine Cardiovascular OUTcomes“ (SCOUT) s 10 742 pacienty zkoumala, zda sibutramin podávaný v rámci programu redukce hmotnosti snižuje riziko kardiovaskulárních komplikací u lidí s vysokým rizikem srdečních onemocnění a dospěli k závěru, že použití silbutraminu mělo RR 1,16 pro primární výsledek (složení nefatálního IM, nefatální CVA, srdeční zástava a CV smrt).[32]
V nesouhlasném článku „Sibutramin: pryč, ale nezapomenut“, David Haslam (předseda Národní fórum pro obezitu ) uvádí, že studie SCOUT je chybná, protože se týkala pouze vysoce rizikových pacientů a nezohledňovala obézní pacienty, kteří nemají kardiovaskulární komplikace nebo podobné kontraindikace [33]
21. Ledna 2010 Evropská agentura pro léčivé přípravky doporučené pozastavení registrace sibutraminu na základě výsledků studie SCOUT.[34]
V srpnu 2010 FDA přidala novou kontraindikaci pro pacienty starší 65 let vzhledem k tomu, že klinické studie sibutraminu nezahrnovaly dostatečný počet těchto pacientů.[14]
Abbott Laboratories 8. října 2010 oznámila, že stahuje sibutramin z amerického trhu pod tlakem FDA, s odvoláním na obavy ohledně minimální účinnosti spojené se zvýšeným rizikem nežádoucích kardiovaskulárních příhod.[35]
Padělané výrobky na hubnutí
22. prosince 2008, Spojené státy Úřad pro kontrolu potravin a léčiv vydal varování pro spotřebitele, kteří pojmenovali 27 různých produktů prodávaných jako „doplňky stravy „Pro hubnutí, které nelegálně obsahují nezveřejněná množství sibutraminu.[36][37] V březnu 2009 Dieter Müller et al. zveřejnil studii případů otravy sibutraminem od podobných Číňanů “bylinné doplňky „prodává se v Evropě a obsahuje až dvojnásobnou dávku legálně licencované drogy.[38]
Dalších 34 produktů FDA připomněla 22. dubna 2009, což dále podtrhuje rizika spojená s neregulovanými „bylinnými doplňky“ pro nic netušící osoby. Tato obava je obzvláště důležitá u osob se základním zdravotním stavem neslučitelným s nehlášenými farmaceutickými cizoložníky.[39] V lednu 2010 bylo vydáno podobné varování pro padělané verze volně prodejné lék na hubnutí, který Alli prodával přes internet. Místo účinné látky orlistat padělané léky obsahují sibutramin a v koncentracích nejméně dvojnásobku množství doporučeného pro hubnutí.[40]
V březnu 2010 Health Canada informoval veřejnost, že na trhu byl nalezen nelegální přípravek „Bylinná strava přírodní“, který obsahuje sibutramin, což je v Kanadě lék na předpis, aniž by byl sibutramin uveden jako přísada.[41] V říjnu 2010 FDA upozornila spotřebitele, že „Slimming Beauty Bitter Orange Slimming Capsules obsahují aktivní farmaceutickou složku sibutramin, lék na předpis, který je stimulantem. Sibutramin není uveden na štítku produktu.“[42]
V říjnu 2010 MHRA ve Velké Británii vydal varování týkající se „čajů Payouji“ a „Pai You Guo Slim Capsules“, u nichž bylo zjištěno, že obsahují nehlášené množství sibutraminu.[43]
Dne 30. prosince 2010 vydala FDA varování týkající se dietních produktů „Fruta Planta“, u nichž bylo zjištěno, že obsahují nehlášené množství sibutraminu. Odvolání uvedlo, že „na trhu v USA ŽÁDNÝ BEZPEČNÝ vzorec neexistuje a že všechny verze Fruta Planta obsahují sibutramin. Všechny verze vzoru jsou NEBEZPEČNÉ a neměly by být zakoupeny z jakéhokoli zdroje.“[44]
Bylo zjištěno, že některé nelegální produkty na hubnutí dovážené do Irska obsahují sibutramin.[45][46] Podobné obavy byly vzneseny v Austrálii, kde bylo zjištěno, že nelegální dovážené doplňky obsahují sibutramin, což má za následek veřejné výstrahy od australských Správa terapeutického zboží.[47]
V říjnu 2011 FDA varovala, že 20 značek doplňků stravy bylo poznamenáno sibutraminem.[48] Ve studii z roku 2018 FDA našla syntetické přísady včetně sibutraminu ve více než 700 doplňcích stravy prodávaných jako „přírodní“, „tradiční“ nebo „bylinné přípravky“.[49]
Reference
- ^ „Sibutramin (Reductil) - stažení v Austrálii“. Správa terapeutického zboží, ministerstvo zdravotnictví, australská vláda. 2010. Citováno 2014-10-06.
- ^ Health Canada schválila důležité bezpečnostní informace o přípravku MERIDIA (sibutramin hydrochlorid monohydrát): Předmět: Dobrovolné stažení tobolek Meridia (sibutraminu) z kanadského trhu.
- ^ „Oznámení o ukončení výroby, prodeje a používání přípravků sibutraminu a jejich aktivních farmaceutických přísad“. sda.gov v Čínské lidové republice. 30. října 2010. Citováno 2011-05-21.
- ^ (v němčině) Sibutramin-Vertrieb in der Europäischen Union ausgesetzt [1]. Abbott Laboratories v Německu. Tisková zpráva 21. 1. 2010. Citováno 2010-01-27
- ^ „Odregistrace farmaceutických výrobků obsahujících sibutramin“ (Tisková zpráva). info.gov v Hongkongu. 2. listopadu 2010. Citováno 2010-11-08.
- ^ „Zakázané léky“ (Tisková zpráva). Ministerstvo zdravotnictví a péče o rodinu. 10. února 2011. Citováno 2011-03-15.
- ^ „Odstoupení sibutraminu (Reductil) na Novém Zélandu“ (Tisková zpráva). MedSafe na Novém Zélandu. 11. října 2010. Citováno 2012-11-06.
- ^ „FDA varuje online prodejce před zakázanými prášky na hubnutí“. 12. ledna 2014. Citováno 20. února 2014.
- ^ „Thajská FDA odhaluje dobrovolné stažení sibutraminu z thajského trhu“ (PDF) (Tisková zpráva). Food and Drug Administration of Thailand. 20. října 2010. Citováno 2010-12-22.
- ^ „Lék na sibutramin s nejvyšší obezitou byl pozastaven“. BBC novinky. 2010-01-22. Citováno 2010-01-22.
- ^ Rockoff JD, Dooren JC (8. října 2010). „Abbott vytáhne z amerických regálů meridii drogových drog“. The Wall Street Journal. Citováno 8. října 2010.
- ^ "Sibutramin - Drugs.com". Druhy.com.
- ^ Buckett WR, Thomas PC, Luscombe GP (1988). „Farmakologie sibutramin-hydrochloridu (BTS 54 524), nového antidepresiva, které indukuje rychlou noradrenergní down-regulaci“. Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 12 (5): 575–84. doi:10.1016/0278-5846(88)90003-6. PMID 2851857. S2CID 24787523.
- ^ A b C „Aktualizace bezpečnosti léčiv FDA ze srpna 2010“. fda.gov.
- ^ A b „Včasná komunikace o probíhajícím hodnocení bezpečnosti meridie (sibutramin-hydrochlorid)“. United States Food and Drug Administration. 1. února 2010. Archivovány od originál dne 6. ledna 2012.
- ^ Siebenhofer A, Jeitler K, Horvath K, Berghold A, Posch N, Meschik J, Semlitsch T (2016). „Dlouhodobé účinky léků na snížení hmotnosti u pacientů s hypertenzí“. Cochrane Database of Systematic Reviews. 2016: CD007654. doi:10.1002 / 14651858.CD007654.pub4. PMID 26934640.
- ^ A b C „Vedlejší účinky meridie a lékové interakce“. RxList.com. 2007. Citováno 2007-04-29.
- ^ (v portugalštině) Cloridrato de sibutramina monoidratado. Bula. [Monohydrát hydrochloridu sibutraminu - informace na štítku]. Medley (2007).
- ^ Nisoli E, Carruba MO (říjen 2000). „Posouzení bezpečnosti a účinnosti sibutraminu, léku proti obezitě s novým mechanismem účinku“. Recenze obezity. 1 (2): 127–39. doi:10.1046 / j.1467-789x.2000.00020.x. PMID 12119986.
- ^ Rothman RB, Baumann MH (květen 2009). "Serotonergní léky a chlopenní onemocnění srdce". Znalecký posudek o bezpečnosti léčiv. 8 (3): 317–29. doi:10.1517/14740330902931524. PMC 2695569. PMID 19505264.
- ^ A b "Meridia (monohydrát hydrochloridu sibutraminu) CIV. Úplné informace o předepisování" (PDF). Abbott Laboratories, North Chicago, IL 60064, USA. Citováno 6. února 2016.
- ^ Heal DJ, Aspley S, Prow MR, Jackson HC, Martin KF, Cheetham SC (srpen 1998). "Sibutramin: nový lék proti obezitě. Přehled farmakologických důkazů, které jej odlišují od d-amfetaminu a d-fenfluraminu." International Journal of Obesity and Related Metabolic Disorders. 22 Suppl 1: S18–28, diskuse S29. PMID 9758240.
- ^ „FDA SCHVÁLUJE SIBUTRAMIN K LÉČBĚ obezity“ (Tisková zpráva). NÁS. Úřad pro kontrolu potravin a léčiv. 24. listopadu 1997. Citováno 2007-04-29.
- ^ Kim KA, Song WK, Park JY (listopad 2009). „Sdružení genetických polymorfismů CYP2B6, CYP3A5 a CYP2C19 s farmakokinetikou sibutraminu u zdravých korejských subjektů“. Klinická farmakologie a terapeutika. 86 (5): 511–8. doi:10.1038 / clpt.2009.145. PMID 19693007. S2CID 24789264.
- ^ Hofbauer K (2004). Farmakoterapie obezity: možnosti a alternativy. Boca Raton, Fla: CRC Press. ISBN 978-0-415-30321-7.
- ^ Jain DS, Subbaiah G, Sanyal M a kol. Metoda validovaná metodou tandemové hmotnostní spektrometrie pomocí kapalinové chromatografie / elektrospreje pro simultánní kvantifikaci sibutraminu a jeho primárních a sekundárních aminových metabolitů v lidské plazmě a její aplikaci na studii bioekvivalence. Rapid Comm. Mass Spec. 20: 3509-3521, 2006.
- ^ Thevis M, Sigmund G, Schiffer AK, Schänzer W. Stanovení N-desmethyl- a N-bisdesmethylových metabolitů sibutraminu v dopingové kontrolní analýze pomocí kapalinové chromatografie-tandemové hmotnostní spektrometrie. Eur. J. Mass Spec. 12: 129-136, 2006.
- ^ R. Baselt, Dispozice toxických drog a chemických látek u člověka, 8. vydání, Biomedical Publications, Foster City, CA, 2008, s. 1426–1427.
- ^ Wolfe SM, Sasich LD, Barbehenn E (19. března 2002). „Žádost FDA o zákaz dietní drogy sibutramin (MERIDIA) (publikace HRG č. 1613)“. Veřejný občan. Citováno 2007-04-29.
- ^ Japsen B (13. března 2005). „FDA váží rozhodnutí o Meridii; zdravotní poradenství pravděpodobně pro lék na obezitu Abbott“. Chicago Tribune. Chicago, Illinois. p. 1.
- ^ Slyšení ze dne 17. listopadu 2004. Související novinka CBS 19. listopadu 2004.
- ^ James WP, Caterson ID, Coutinho W, Finer N, Van Gaal LF, Maggioni AP, Torp-Pedersen C, Sharma AM, Shepherd GM, Rode RA, Renz CL (září 2010). „Vliv sibutraminu na kardiovaskulární výsledky u pacientů s nadváhou a obezitou“ (PDF). The New England Journal of Medicine. 363 (10): 905–17. doi:10.1056 / NEJMoa1003114. PMID 20818901.
- ^ Haslam D (duben 2010). „Sibutramin: pryč, ale nezapomenut“ (PDF). Pract Diab Int. 27 (3): 96–97. doi:10.1002 / pdi.1453. Archivovány od originál (PDF) dne 26. července 2015.
- ^ „Evropská agentura pro léčivé přípravky doporučuje pozastavení registrace sibutraminu“ (PDF). Evropská agentura pro léčivé přípravky. 21. ledna 2010. Archivovány od originál (PDF) dne 01.04.2010.
- ^ Pollack A (8. října 2010). „Abbott Labs stahuje Meridii z trhu“. The New York Times.
- ^ „FDA varuje spotřebitele před zkaženými prášky na hubnutí“ (Tisková zpráva). US Food and Drug Administration. 22. prosince 2008.
- ^ „Otázky a odpovědi týkající se iniciativy FDA proti kontaminovaným produktům na hubnutí zaměřené na spotřebitele“. Americké Centrum pro správu potravin a léčiv pro hodnocení a výzkum drog. 22. prosince 2008.
- ^ Müller D, Weinmann W, Hermanns-Clausen M (březen 2009). „Čínské kapsle na hubnutí obsahující sibutramin prodávané přes internet: série případů“. Deutsches Ärzteblatt International. 106 (13): 218–22. doi:10.3238 / arztebl.2009.0218. PMC 2680571. PMID 19471631.
- ^ Bylo odvoláno 34 produktů na hubnutí, WebMD, 22. dubna 2009.
- ^ „Falešné pilulky na hubnutí Alli mohou představovat zdravotní rizika“. CNN.com. 23. ledna 2010. Citováno 2010-01-24.
- ^ „Bylinkový dietní produkt představuje riziko pro srdce“. CBC News. 26. března 2010.
- ^ „Upozornění FDA: Zeštíhlující kosmetické hořko oranžové zeštíhlující kapsle: Nehlášená složka léčiva“. Druhy.com.
- ^ „Tisková zpráva: Varování před nelicencovaným bylinkovým čajem Payouji a kapslemi Pai You Guo Slim“. Spojené království Regulační agentura pro léčivé a zdravotní produkty. 20. října 2010. Archivovány od originál dne 9. února 2012.
- ^ „PRock Marketing, LLC vydává dobrovolné celonárodní stažení všech receptů na hubnutí a variace receptů na snížení hmotnosti Fruta Planta / doplněk stravy na snížení hmotnosti“. United States Food and Drug Administration. Archivovány od originál dne 23. března 2012.
- ^ Papež C. „Záchvaty nelegálních léků rostou“. Irish Times.
- ^ „Upozornění FDA: Slim Xtreme Bylinná zeštíhlující tobolka: Nehlášená složka léčiva“. Druhy.com.
- ^ „Majestic hubnutí tobolek: Bezpečnostní upozornění“. Správa terapeutického zboží. Australská vláda. 9. listopadu 2012.
- ^ Carroll L (19. října 2011). "'Přírodní „pilulky na hubnutí poskvrněné zakázaným lékem na předpis“. MSNBC. Archivovány od originál dne 11. ledna 2012.
- ^ „Není divu, že to tak dobře funguje: V tomto bylinném doplňku může být Viagra“. NPR.org. Citováno 2018-10-14.
externí odkazy
- Tisková zpráva společnosti Abbott o stažení Meridia
- Informace o drogách sibutraminem z Příručka společnosti Merck. Zahrnuje informace o dávkování a komplexní seznam mezinárodních značek
- Webové stránky o bezpečnosti produktů amerického úřadu pro kontrolu potravin a léčiv (FDA)
