Transportér norepinefrinu - Norepinephrine transporter
The transportér norepinefrinu (SÍŤ), také známý jako transportér noradrenalinu (NAT) a rodina nosičů rozpuštěných látek 6 členů 2 (SLC6A2), je protein že u lidí je kódován SLC6A2 gen.[5]
NET je a transportér monoaminů a je zodpovědný za chlorid sodný (Na+/ Cl−) -závislé zpětné vychytávání extracelulární norepinefrin (NE), který je také známý jako noradrenalin. NET může také vychytávat extracelulární dopamin (DA). Zpětné vychytávání těchto dvou neurotransmitery je nezbytný pro regulaci koncentrací v synaptická štěrbina. NET, spolu s dalšími transportéry monoaminů, jsou terčem mnoha antidepresiv a rekreačních drog. Kromě toho je nadbytečnost NET spojena s ADHD.[6][7] Existují důkazy o tom jedno-nukleotidové polymorfismy v genu NET (SLC6A2) může být základním faktorem u některých z těchto poruch.[7]
Gen
Gen transportéru norepinefrinu, SLC6A2, se nachází na člověku chromozom 16 místo 16q12.2. Tento gen je kódován 14 exony.[7] Na základě nukleotidové a aminokyselinové sekvence se NET transportér skládá z 617 aminokyselin s 12 doménami překlenujícími membrány. Strukturální organizace NET je vysoce homologní k ostatním členům rodiny neurotransmiterových transportérů závislých na sodíku / chloridu, včetně dopaminu, epinefrinu, serotonin a Transportéry GABA.[7]
Jednonukleotidové polymorfismy
A jedno-nukleotidový polymorfismus (SNP) je genetická variace, ve které je sekvence genomu pozměněna jediným nukleotidem (A, T, C nebo G ). NET proteiny se změněnou aminokyselinovou sekvencí (konkrétněji a missense mutace ) by mohly být spojeny s různými chorobami, které zahrnují abnormálně vysoké nebo nízké plazmatické hladiny norepinefrin kvůli změněné funkci NET. NET SNP a možné asociace s různými nemocemi jsou oblastí zájmu mnoha výzkumných projektů. Existují důkazy naznačující vztah mezi NET SNP a různými poruchami, jako je ADHD[7][8] psychiatrické poruchy,[7] posturální tachykardie[7][9] a ortostatická intolerance.[7][9] SNP rs3785143 a rs11568324 byly spojeny s porucha pozornosti s hyperaktivitou.[10] Doposud však jedinou potvrzenou přímou asociací mezi SNP a klinickým stavem je SNP, Ala457Pro a ortostatická intolerance.[7] Zatím bylo objeveno třináct NET mutací missense.[7]
| Umístění | Varianta aminokyselin | TMD (je-li známa) | Související nemoc |
|---|---|---|---|
| Exon 2 | Val69Ile | TMD 1 | Žádný |
| Exon 3 | Thr99Ile | TMD 2 | Žádný |
| Exon 5 | Val245Ile | TMD 4 | Žádný |
| Exon 6 | Asn292Thr | n / a | Žádný |
| Exon 8 | Val356Leu | n / a | Žádný |
| Exon 8 | Ala369Pro | n / a | Žádný |
| Exon 8 | Asn375Ser | n / a | Žádný |
| Exon 10 | Val449Ile | TMD 9 | Žádný |
| Exon 10 | Ala457Pro | TMD 9 | Ortostatická intolerance |
| Exon 10 | Lys463Arg | n / a | Žádný |
| Exon 11 | Gly478Ser | TMD 10 | Žádný |
| Exon 12 | Phe528Cys | n / a | Žádný |
| Exon 13 | Jeho | n / a | Žádný |
Tabulka výše je uvedena v této tabulce norem zkratky aminokyselin. Tato notace pro
missense mutace, například Val69Ile, naznačuje, že aminokyselina Val69 byla změněna na Ile.
Genetické variace
An epigenetický mechanismus (hypermethylace ostrovů CpG v oblasti promotoru genu NET), který vede ke snížené expresi transportéru noradrenalinu (norepinefrinu) a v důsledku toho byl u obou implikován fenotyp zhoršeného neuronálního zpětného vychytávání norepinefrinu syndrom posturální ortostatické tachykardie a panická porucha.[12]
Struktura

Transportér norepinefrinu se skládá z 12 transmembránové domény (TMD). Intracelulární část obsahuje amino (-NH
2) skupina a karboxyl (-COOH) skupina. Kromě toho je mezi TMD 3 a 4 velká extracelulární smyčka.[13][6][14] Protein se skládá z 617 aminokyseliny.[13]
Funkce
Funkce NET pro přenos synapticky uvolněné norepinefrin zpět do presynaptického neuronu. Až 90% uvolněného norepinefrinu bude NET odebráno zpět do buňky. NET funguje spojením přítoku sodíku a chloridu (Na+/ Cl−) s transportem norepinefrinu. K tomu dochází při pevném poměru 1: 1: 1.[15] NET i transportér dopaminu (DAT) může transportovat norepinefrin a dopamin. Zpětné vychytávání norepinefrinu a dopaminu je nezbytné pro regulaci koncentrace monoaminových neurotransmiterů v synaptické štěrbině. Transportér také pomáhá udržovat homeostatické rovnováhy presynaptického neuronu.[16]
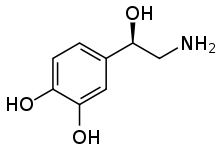
Norepinefrin (NE) se uvolňuje z noradrenergní neurony, které inervují oba CNS a PNS. NE, známý také jako noradrenalin (NA), má důležitou roli při kontrole nálady, vzrušení, paměti, učení a vnímání bolesti. NE je součástí podpůrný nervový systém.[6][17] Dysregulace odstraňování norepinefrinu pomocí NET je spojena s mnoha neuropsychiatrickými chorobami, o nichž se pojednává níže. Navíc mnoho antidepresiv a rekreačních léků soutěží o vazbu NET s NE.[13]
Transportní mechanismy
Transport norepinefrinu zpět do presynaptické buňky umožňuje kotransport s Na+ a Cl−. Sekvenční vazba iontů vede k případnému zpětnému vychytávání norepinefrinu. Iontové gradienty Na+ a Cl− učinit toto zpětné vychytávání energeticky příznivé. Gradient je generován Na + / K + -ATPáza který transportuje tři ionty sodíku ven a dva ionty draslíku do buňky.[16] NET mají chování podobné těm z ligandem řízené iontové kanály. Výsledkem výrazu NET je aktivita kanálu úniku.[15][16]
Umístění v nervovém systému
NET jsou omezeny na noradrenergní neurony a nejsou přítomny na neuronech, které uvolňují dopamin nebo epinefrin.[6][14][16] Transportéry se nacházejí podél těla buňky, axony, a dendrity neuronu.[6] NET jsou umístěny daleko od synapsí, kde se uvolňuje norepinefrin. Nacházejí se blíže k plazmatické membráně buňky. To vyžaduje, aby norepinefrin difundoval z místa, kde je uvolňován do transportéru pro zpětné vychytávání.[16] Transportéry norepinefrinu jsou omezeny na neurony sympatického systému a na ty, které inervují dřeň nadledvin, plíce a placentu.[16]
Nařízení
Regulace funkce NET je složitá a zaměřuje se na současný výzkum. NET jsou regulovány na posttranslaci na buněčné i molekulární úrovni. Mezi nejrozumnější mechanismy patří fosforylace druhým poslem protein kináza C. (PKC).[14] Bylo prokázáno, že PKC inhibuje funkci NET sekvestrací transportéru z plazmatické membrány.[18] Aminokyselinová sekvence NET ukázala více míst souvisejících s fosforylací proteinkinázy.[16] Posttranslační modifikace mohou mít širokou škálu účinků na funkci NET, včetně rychlosti fúze vezikul obsahujících NET s plazmatickou membránou a obratu transportéru.[18]
Klinický význam
Ortostatická intolerance
Ortostatická intolerance (OI) je porucha autonomní nervový systém (podkategorie dysautonomie ) charakterizovaný nástupem příznaků po vstávání. Mezi příznaky patří únava, točení hlavy, bolest hlavy, slabost, zvýšená srdeční frekvence /bušení srdce, úzkost a změněné vidění.[7] Pacienti mají často vysokou plazmu norepinefrin (NE) koncentrace (nejméně 600 pg / ml) ve vztahu k odtoku sympatiku při stání, což naznačuje, že OI je hyperadrenergní stav.[7][9]Objev identických dvojčat, které obě trpí OI, naznačil genetický základ poruchy.[7][9] A missense mutace na genu NET (SLC6A2) byl objeven, ve kterém an alanin zbytek byl nahrazen a prolin zbytek (Ala457Pro) ve vysoce konzervované oblasti transportéru.[7] Vadný NET pacientů měl pouze 2% aktivity divoký typ verze genu.[7] Genetická vada v proteinu NET vede ke snížení aktivity NET, která by mohla odpovídat za abnormálně vysoké plazmatické hladiny NE v OI. Avšak 40 dalších pacientů s OI nemělo stejnou missense mutaci, což naznačuje, že k fenotypu u identických dvojčat přispěly další faktory.[7] Tento objev vazby s mutacemi NET, který vede ke snížení noradrenalinu zpětné vychytávání aktivita a ortostatická intolerance naznačuje, že chybné mechanismy absorpce NE mohou přispívat ke kardiovaskulárním onemocněním.[19]
Terapeutické použití
Inhibice transportéru norepinefrinu (NET) má potenciální terapeutické aplikace při léčbě porucha pozornosti s hyperaktivitou (ADHD), zneužívání návykových látek neurodegenerativní poruchy (např. Alzheimerova choroba (AD) a Parkinsonova choroba (PD)) a klinická deprese.[17]
Velká depresivní porucha
Určitý antidepresivum léky působí na zvýšení noradrenalinu, jako je inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI), inhibitory zpětného vychytávání norepinefrinu a dopaminu (NDRI), inhibitory zpětného vychytávání norepinefrinu (NRI nebo NERI) a tricyklická antidepresiva (TCA). Mechanismus, kterým tyto léky fungují, spočívá v tom, že inhibitory zpětného vychytávání zabraňují zpětnému vychytávání serotoninu a norepinefrinu presynaptický neuron, paralyzující normální funkci NET. Zároveň vyšší úrovně 5-HT jsou udržovány v synapse zvyšující koncentrace těchto druhých neurotransmiterů. Vzhledem k tomu, že transportér noradrenalinu je zodpovědný za většinu clearance dopaminu v prefrontální kůře,[20] SNRI také blokují zpětné vychytávání dopaminu a akumulují dopamin v synapse. Avšak DAT, primární způsob transportu dopaminu z buňky, může pracovat na snížení koncentrace dopaminu v synapse, když je blokován NET.[21] Po mnoho let byla volba číslo jedna v léčbě poruch nálady, jako je deprese, podáváním TCA, jako je desipramin (Norpramin), nortriptylin (Arentyl, Pamelor), protriptylin (Vivactil) a amoxapin (Asendin).[17] SSRI, které regulují hlavně serotonin, následně nahradily tricyklická léčiva jako primární možnost léčby deprese kvůli jejich lepší snášenlivosti a nižšímu výskytu nežádoucích účinků.[22]
ADHD
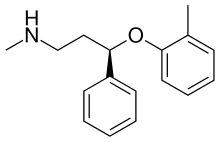
Při léčbě ADHD existuje mnoho léků. Dextroamfetamin (Dexedrin, dextrostat), Adderall, methylfenidát (Ritalin, Metadate, Concerta, Daytrana) a lisdexamfetamin (Vyvanse) blok reabsorpce katecholaminy dopamin a norepinefrin transportéry monoaminů (včetně NET), čímž se zvyšuje jejich úroveň neurotransmitery v mozku. Silný selektivní inhibitor zpětného vychytávání norepinefrinu (NRI), atomoxetin (Strattera), byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA) k léčbě ADHD u dospělých.[23][24] Role NET v ADHD je podobná tomu, jak funguje při zmírňování příznaků deprese. NET je blokován atomoxetinem a zvyšuje hladinu NE v mozku. Může pracovat na zvýšení schopnosti soustředit se, snížit impulsivitu a snížit hyperaktivitu u dětí i dospělých, kteří trpí ADHD.[25]
Psychostimulanty
Kokain
Kokain je mocný psychostimulant a je známo, že je jednou z nejčastěji zneužívaných látek.[26] Kokain je neselektivní, inhibitor zpětného vychytávání z norepinefrin, serotonin, a dopamin transportéry. To maří absorpci těchto chemikálií do presynaptický terminál[26] a umožňuje hromadění velké koncentrace dopaminu, serotoninu a norepinefrinu v synaptické štěrbině. Potenciál závislosti na kokainu je považován za důsledek jeho účinků na transportéry dopaminu v CNS, i když se předpokládá, že život ohrožující kardiovaskulární účinky kokainu mohou zahrnovat inhibici NET na sympatických a CNS autonomních synapsích.[27]
Amfetaminy
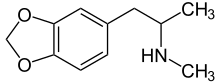
Amfetaminy působit na norepinefrin úrovně podobné té z kokain v tom, že oba zvyšují hladinu NE v mozku.[28] Drogy podobné amfetaminu jsou substráty transportéry monoaminů, zahrnují NET, které způsobují obrácení ve směru transportu neurotransmiterů.[16][29] Amfetaminy způsobují velkou akumulaci extracelulárního NE.[28] Vysoká hladina NE v mozku představuje většinu hlubokých účinků amfetaminů, včetně bdělosti a anorektických, lokomotorických a sympatomimetických účinků.[28] Účinky amfetaminů na mozek jsou však pomalejší, ale trvají déle než účinky kokainu na mozek.[28] MDMA (3,4-Methylendioxymetamfetamin nebo „extáze“) je amfetamin se širokým rekreačním využitím. Studie uvádí, že NET inhibitor reboxetin snížil stimulační účinky MDMA u lidí, což prokázalo zásadní roli, kterou NET má v kardiovaskulárních a stimulačních účincích MDMA.[30]
Další výzkum
Role NET v mnoha mozkových poruchách je základem důležitosti porozumění (dys) regulaci transportéru. Kompletní model proteinů, které se sdružují s transportérem, bude užitečný při navrhování lékových terapií pro nemoci, jako je schizofrenie, afektivní porucha a autonomní poruchy. Nedávno objevené mechanismy NET, včetně schopnosti působit reverzibilně a jako iontový kanál, poskytují další oblasti výzkumu.[14][16]
Schizofrenie

Role SV v schizofrenie nebyl plně pochopen, ale podnítil výzkum tohoto tématu.[31][32][33][34] Jediný vztah, který byl mezi vědci pochopen, je ten, že existuje pozitivní korelace mezi zvýšenými hladinami NE v mozku a míšní tekutina (CSF) a aktivita schizofrenie.[31][32][33][34] V jedné studii klonidin, lék používaný k léčbě zdravotních stavů, jako je ADHD a vysoký krevní tlak, bylo prokázáno, že produkuje významné snížení plazmatické hladiny MHPG (3-methoxy-4-hydroxyfenylglykol), metabolit NE, v normální kontrolní skupině, ale ne ve skupině schizofrenních pacientů.[33] To naznačuje, že u schizofrenie je alfa-2 adrenergní receptor, presynaptický inhibiční receptor, může být méně citlivý ve srovnání s normálně fungujícími alfa-2 receptory, a může tedy souviset se zvýšenými hladinami NE u poruchy.[33] Kromě zvýšených hladin NE v mozku a mozkomíšním moku byly s diagnózou schizofrenie spojeny také zvýšené hladiny MHPG.[34] Zhoršená regulace SV u schizofrenie je oblastí zájmu vědců a výzkum na toto téma stále probíhá.[33][34]
Zobrazování
Přes pozitronová emisní tomografie zobrazovací technika byla NET selektivně zkoumána. 11C ME @ HAPTHI a 18F-MeNER jsou dva NET selektivní rádiové stopovače pro zobrazování PET.[35]
Viz také
- Transportér neurotransmiteru
- Sodík: neurotransmiterový symportér
- Rodina nosičů solute
- Noradrenalinu
- Monoaminový transportér
- Ortostatická intolerance
- Jednonukleotidové polymorfismy
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000103546 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání Ensembl 89: ENSMUSG00000055368 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Pacholczyk T, Blakely RD, Amara SG (březen 1991). „Expresní klonování lidského transportéru noradrenalinu citlivého na kokain a antidepresivum“. Příroda. 350 (6316): 350–4. doi:10.1038 / 350350a0. PMID 2008212. S2CID 4333895.
- ^ A b C d E Schroeter S, Apparsundaram S, Wiley RG, Miner LH, Sesack SR, Blakely RD (květen 2000). „Imunolokalizace transportéru l-norepinefrinu citlivého na kokain a antidepresivum“. The Journal of Comparative Neurology. 420 (2): 211–32. doi:10.1002 / (SICI) 1096-9861 (20000501) 420: 2 <211 :: AID-CNE5> 3.0.CO; 2-3. PMID 10753308.
- ^ A b C d E F G h i j k l m n Ó str q Tellioglu T, Robertson D (listopad 2001). „Genetické nebo získané deficity v transportéru norepinefrinu: současné chápání klinických důsledků“. Recenze odborníků v molekulární medicíně. 2001 (29): 1–10. doi:10.1017 / S1462399401003878. PMID 14987367.
- ^ Kim CH, Hahn MK, Joung Y, Anderson SL, Steele AH, Mazei-Robinson MS, Gizer I, Teicher MH, Cohen BM, Robertson D, Waldman ID, Blakely RD, Kim KS (prosinec 2006). „Polymorfismus v genu pro transportér norepinefrinu mění aktivitu promotoru a je spojen s poruchou hyperaktivity s deficitem pozornosti“. Sborník Národní akademie věd Spojených států amerických. 103 (50): 19164–9. doi:10.1073 / pnas.0510836103. PMC 1748193. PMID 17146058.
- ^ A b C d Shannon JR, Flattem NL, Jordan J, Jacob G, Black BK, Biaggioni I, Blakely RD, Robertson D (únor 2000). „Ortostatická intolerance a tachykardie spojená s nedostatkem norepinefrinu a transportéru“. The New England Journal of Medicine. 342 (8): 541–9. doi:10.1056 / NEJM200002243420803. PMID 10684912.
- ^ Kim JW, Biederman J, McGrath CL, Doyle AE, Mick E, Fagerness J, Purcell S, Smoller JW, Sklar P, Faraone SV (červen 2008). „Další důkazy o asociaci mezi dvěma NET-jednonukleotidovými polymorfismy s ADHD“. Molekulární psychiatrie. 13 (6): 624–30. doi:10.1038 / sj.mp.4002090. PMID 17876324. S2CID 8341997.
- ^ Maarten E. A. Reith (2002). Transportéry neurotransmiterů: struktura, funkce a regulace. Humana Press. p. 120. ISBN 978-0-89603-945-2. Citováno 27. října 2011.
- ^ Esler M, Alvarenga M, Pier C, Richards J, El-Osta A, Barton D, Haikerwal D, Kaye D, Schlaich M, Guo L, Jennings G, Socratous F, Lambert G (červenec 2006). "Neuronální transportér noradrenalinu, úzkost a kardiovaskulární onemocnění". Journal of Psychopharmacology. 20 (4 doplňky): 60–6. doi:10.1177/1359786806066055. PMID 16785272. S2CID 10728780.
- ^ A b C Stöber G, Nöthen MM, Pörzgen P, Brüss M, Bönisch H, Knapp M, Beckmann H, Propping P (listopad 1996). „Systematické hledání variací v lidském transportním genu norepinefrinu: identifikace pěti přirozeně se vyskytujících mutací missense a studium souvislosti s hlavními psychiatrickými poruchami“. American Journal of Medical Genetics. 67 (6): 523–32. doi:10.1002 / (SICI) 1096-8628 (19961122) 67: 6 <523 :: AID-AJMG3> 3.0.CO; 2-I. PMID 8950409.
- ^ A b C d Sager JJ, Torres GE (srpen 2011). „Proteiny interagující s transportéry monoaminů: současný stav a budoucí výzvy“. Biochemie. 50 (34): 7295–310. doi:10.1021 / bi200405c. PMID 21797260.
- ^ A b Galli A, DeFelice LJ, Duke BJ, Moore KR, Blakely RD (říjen 1995). „Proudy indukované noradrenalinem závislé na sodíku v buňkách HEK-293 transfektovaných norepinefrinovým transportérem blokovaných kokainem a antidepresivy“. The Journal of Experimental Biology. 198 (Pt 10): 2197–212. PMID 7500004.
- ^ A b C d E F G h i Torres GE, Gainetdinov RR, Caron MG (leden 2003). "Transportéry monoaminů v plazmové membráně: struktura, regulace a funkce". Recenze přírody. Neurovědy. 4 (1): 13–25. doi:10.1038 / nrn1008. PMID 12511858. S2CID 21545649.
- ^ A b C Zhou J (prosinec 2004). „Inhibitory transportéru norepinefrinu a jejich terapeutický potenciál“. Drogy budoucnosti. 29 (12): 1235–1244. doi:10.1358 / dof.2004.029.12.855246. PMC 1518795. PMID 16871320.
- ^ A b Gether U, Andersen PH, Larsson OM, Schousboe A (červenec 2006). "Transportéry neurotransmiterů: molekulární funkce důležitých lékových cílů". Trendy ve farmakologických vědách. 27 (7): 375–83. doi:10.1016 / j.tips.2006.05.003. PMID 16762425.
- ^ Schroeder C, Tank J, Boschmann M, Diedrich A, Sharma AM, Biaggioni I, Luft FC, Jordan J (leden 2002). „Selektivní inhibice zpětného vychytávání norepinefrinu jako lidský model ortostatické intolerance“. Oběh. 105 (3): 347–53. doi:10.1161 / hc0302.102597. PMID 11804991.
- ^ Morón JA, Brockington A, Wise RA, Rocha BA, Hope BT (leden 2002). „Příjem dopaminu transportérem norepinefrinu v oblastech mozku s nízkou hladinou transportéru dopaminu: důkazy z knock-out myších linií“. The Journal of Neuroscience. 22 (2): 389–95. doi:10.1523 / JNEUROSCI.22-02-00389.2002. PMC 6758674. PMID 11784783.
- ^ Yavich L, Forsberg MM, Karayiorgou M, Gogos JA, Männistö PT (září 2007). „Specifická role katechol-O-methyltransferázy v přetečení dopaminu v prefrontální kůře a dorzálním striatu“. The Journal of Neuroscience. 27 (38): 10196–209. doi:10.1523 / JNEUROSCI.0665-07.2007. PMC 6672678. PMID 17881525.
- ^ Klinická farmakologie SSRI: Jak se SSRI jako skupina liší od TCA, Preskorn
- ^ „Jaké léky se používají k léčbě ADHD?“. Národní instituty duševního zdraví.
- ^ Simpson D, Plosker GL (2004). „Atomoxetin: přehled jeho použití u dospělých s poruchou pozornosti s hyperaktivitou“. Drogy. 64 (2): 205–22. doi:10.2165/00003495-200464020-00005. PMID 14717619.
- ^ „Atomoxetin -“. PubMed Health. Citováno 2. listopadu 2011.
- ^ A b Macey DJ, Smith HR, Nader MA, Porrino LJ (leden 2003). „Chronické podávání kokainu zvyšuje regulaci transportéru norepinefrinu a mění funkční aktivitu v jádře postele stria terminalis opice rhesus“. The Journal of Neuroscience. 23 (1): 12–6. doi:10.1523 / JNEUROSCI.23-01-00012.2003. PMC 6742134. PMID 12514195.
- ^ Barker EL, Blakely RD (1995). "Transportéry norepinefrinu a serotoninu". V Kupfer DJ, Bloom FE (eds.). Psychofarmakologie: čtvrtá generace pokroku. New York: Raven Press. ISBN 978-0-7817-0166-2. Citováno 2. listopadu 2011.
- ^ A b C d Informační přehledy o drogách a lidském výkonu. „Metamfetamin (a amfetamin)“. Archivovány od originál dne 31. října 2011. Citováno 1. listopadu 2011.
- ^ Sulzer D, Chen TK, Lau YY, Kristensen H, Rayport S, Ewing A (květen 1995). „Amfetamin redistribuuje dopamin ze synaptických vezikul na cytosol a podporuje zpětný transport“. The Journal of Neuroscience. 15 (5 Pt 2): 4102–8. doi:10.1523 / JNEUROSCI.15-05-04102.1995. PMC 6578196. PMID 7751968.
- ^ Hysek CM, Simmler LD, Ineichen M, Grouzmann E, Hoener MC, Brenneisen R, Huwyler J, Liechti ME (srpen 2011). „Inhibitor transportu norepinefrinu reboxetin snižuje stimulační účinky MDMA („ extáze “) na člověka.“ Klinická farmakologie a terapeutika. 90 (2): 246–55. doi:10.1038 / clpt.2011.78. PMID 21677639. S2CID 29087593.
- ^ A b Decaire, Michaele. „Neurofyziologie schizofrenie: Etiologie a psychofarmakologická léčba“. Archivovány od originál dne 17. února 2012. Citováno 1. listopadu 2011.
- ^ A b Breier A, Wolkowitz OM, Roy A, Potter WZ, Pickar D (listopad 1990). "Plazmatický norepinefrin u chronické schizofrenie". American Journal of Psychiatry. 147 (11): 1467–70. doi:10.1176 / ajp.147.11.1467. PMID 2221157.
- ^ A b C d E Sternberg DE, Charney DS, Heninger GR, Leckman JF, Hafstad KM, Landis DH (březen 1982). "Narušená presynaptická regulace norepinefrinu u schizofrenie. Účinky klonidinu u schizofrenních pacientů a normální kontroly". Archiv obecné psychiatrie. 39 (3): 285–9. doi:10.1001 / archpsyc.1982.04290030025004. PMID 6279049.
- ^ A b C d van Kammen DP, Antelman S (duben 1984). „Zhoršený noradrenergní přenos u schizofrenie?“. Humanitní vědy. 34 (15): 1403–13. doi:10.1016/0024-3205(84)90054-7. PMID 6323903.
- ^ Rami-Mark C, Berroterán-Infante N, Philippe C, Foltin S, Vraka C, Hoepping A, Lanzenberger R, Hacker M, Mitterhauser M, Wadsak W (prosinec 2015). „Radiosyntéza a první preklinické hodnocení nového transportéru norepinefrinu pet-ligand [(11) C] ME @ HAPTHI“. Výzkum EJNMMI. 5 (1): 113. doi:10.1186 / s13550-015-0113-3. PMC 4467816. PMID 26061602.
externí odkazy
- Norepinefrin + transportér v americké národní lékařské knihovně Lékařské předměty (Pletivo)