Cyklopropan - Cyclopropane
 | |||
| |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Cyklopropan[2] | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.000.771 | ||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H6 | |||
| Molární hmotnost | 42,08 g / mol | ||
| Vzhled | Bezbarvý plyn | ||
| Zápach | Sladce vonící | ||
| Hustota | 1,879 g / L (1 atm, 0 ° C) | ||
| Bod tání | -128 ° C (-198 ° F; 145 K) | ||
| Bod varu | −33 ° C (−27 ° F; 240 K) | ||
| Kyselost (strK.A) | ~46 | ||
| -39.9·10−6 cm3/ mol | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Vysoce hořlavý Dusivý | ||
| Bezpečnostní list | Externí bezpečnostní list | ||
| NFPA 704 (ohnivý diamant) | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Cyklopropan je cykloalkan s molekulárním vzorcem C3H6, skládající se ze tří uhlík atomy vzájemně spojené za vzniku kruhu, přičemž každý atom uhlíku nese dva atomy vodíku což má za následek D3h molekulární symetrie. Malá velikost prstenu vytváří značné množství napětí v kruhu ve struktuře.
Cyklopropan je anestetikum. V moderní anestetické praxi byl nahrazen jinými látkami. Vzhledem ke své extrémní reaktivitě mohou směsi cyklopropan-kyslík explodovat.
Dějiny
Cyklopropan objevil v roce 1881 Srpna Freund, který ve své první práci také navrhl správnou strukturu látky.[3] Freund léčil 1,3-dibrompropan s sodík, způsobující intramolekulární Wurtzova reakce vedoucí přímo k cyklopropanu.[4] Výtěžek reakce byl vylepšen Gustavsonem v roce 1887 s použitím zinek místo sodíku.[5] Cyklopropan neměl komerční použití, dokud Henderson a Lucas neobjevili jeho anestetické vlastnosti v roce 1929;[6] průmyslová výroba začala v roce 1936.[7]
Anestézie
Cyklopropan byl zaveden do klinického použití americkým anesteziologem Ralph Waters který používal uzavřený systém s absorpcí oxidu uhličitého, aby konzervoval toto tehdy nákladné činidlo. Cyklopropan je relativně silné, nedráždivé a sladce vonící činidlo s minimální alveolární koncentrace 17,5%[8] a a rozdělovací koeficient krev / plyn 0,55. To znamenalo, že indukce anestézie vdechováním cyklopropanu a kyslíku byla rychlá a nepříjemná. Na konci prodloužené anestézie by však pacienti mohli trpět náhlým poklesem krevního tlaku, což by mohlo vést k srdeční arytmie; reakce známá jako „cyklopropanový šok“.[9] Z tohoto důvodu, stejně jako jeho vysoké náklady a jeho výbušná povaha,[10] v poslední době se používal pouze k navození anestézie a od poloviny 80. let není k dispozici pro klinické použití. Válce a průtokoměry byly zbarveny oranžově.
Farmakologie
Cyklopropan je neaktivní na GABAA a glycinové receptory, a místo toho funguje jako Antagonista NMDA receptoru.[11][12] Rovněž inhibuje AMPA receptor a nikotinové acetylcholinové receptory, a aktivuje určité K.2P kanály.[11][12][13]
Struktura a lepení

Trojúhelníková struktura cyklopropanu vyžaduje: vazebné úhly mezi kovalentními vazbami uhlík-uhlík je 60 °. To je mnohem méně než termodynamicky nejstabilnější úhel 109,5 ° (pro vazby mezi atomy se sp3 hybridizované orbitaly ) a vede k významnému namáhání kruhu. Molekula má také torzní napětí způsobené zatměná konformace jeho atomů vodíku. Vazby mezi atomy uhlíku jsou tedy podstatně slabší než u typických alkanu, což má za následek mnohem vyšší reaktivitu.
Vazba mezi uhlíkovými centry je obecně popsána z hlediska ohnuté vazby.[14] V tomto modelu jsou vazby uhlík-uhlík ohnuty směrem ven, takže interorbitální úhel je 104 °. To snižuje úroveň deformace vazby a je toho dosaženo zkreslením sp3 hybridizace atomů uhlíku na technicky sp5 hybridizace (tj.1⁄6 hustota a5⁄6 hustota p), takže vazby C-C mají více π znaků, než je obvyklé[15] (zároveň vazby uhlík na vodík získají více s-charakteru). Jedním neobvyklým důsledkem ohnuté vazby je, že zatímco vazby C-C v cyklopropanu jsou slabší než obvykle, atomy uhlíku jsou také blíže k sobě než v běžné alkanové vazbě: 151 odpoledne proti 153 hodin (průměr alken dluhopis: 146 pm).[16]
Stabilita v důsledku cyklické delokalizace šesti elektronů tří cyklopropanových tří vazeb C-C σ byla dána Michael J. S. Dewar jako vysvětlení jediného mírně většího kmene cyklopropanu („pouze“ 27,6 kcal / mol) ve srovnání s cyklobutan (26,2 kcal / mol) s cyklohexan jako reference s Estr= 0 kcal / mol.[17] Tato stabilizace se označuje jako σ aromaticita,[18][19] na rozdíl od obvyklé π aromatičnosti je to například velmi stabilizující účinek v benzen. Jiné studie nepodporují úlohu σ-aromaticity v cyklopropanu a existenci indukovaného kruhového proudu; takové studie poskytují alternativní vysvětlení energetické stabilizace a abnormálního magnetického chování cyklopropanu.[20]
Syntéza
Cyklopropan byl nejprve vyroben pomocí a Wurtzova spojka, ve kterém 1,3-dibrompropan byl cyklicky použitím sodík.[3] Výtěžek této reakce lze zlepšit použitím zinek jako dehalogenační činidlo a jodid sodný jako katalyzátor.[21]
- BrCH2CH2CH2Br + 2 Na → (CH2)3 + 2 NaBr
Cyklopropanace
Cyklopropanové kruhy se vyskytují v mnoha biomolekuly (např., pyrethriny, skupina přírodních insekticidů) a farmaceutické léky. Jako takový vznik cyklopropanových kruhů, obecně označovaný jako cyklopropanace, je aktivní oblastí chemického výzkumu.
Reakce
Díky zvýšenému π-charakteru jeho vazeb C-C může cyklopropan v určitých případech reagovat jako alken. Například prochází hydrohalogenace s minerální kyseliny za vzniku lineárních alkylhalogenidů. Následně také reagují substituované cyklopropany Markovnikovovo pravidlo.[22] Substituované cyklopropany mohou oxidativně přidat na přechodné kovy v procesu označovaném jako Aktivace C – C.
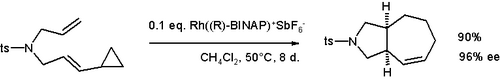
Cyklopropylové skupiny sousedící s vinylovými skupinami mohou podléhat rozšíření kruhu reakce. Mezi příklady patří vinylcyklopropan přesmyk a přesmyk divinylcyklopropan-cykloheptadien. Tuto reaktivitu lze využít ke generování neobvyklých cyklických sloučenin, jako je např cyklobuteny,[23] nebo bicyklické druhy jako cyklohepten je uvedeno níže.[24]
Bezpečnost
Cyklopropan je vysoce hořlavý. Navzdory své deformační energii však není podstatně výbušnější než jiné alkany.
Viz také
- Čtyřstěn obsahuje čtyři kondenzované cyklopropanové kruhy, které tvoří tváře a čtyřstěn
- Propellane obsahuje tři cyklopropanové kruhy, které sdílejí jednu centrální vazbu uhlík-uhlík.
- Cyklopropen
- Methylenecyklopropan
Reference
- ^ Index společnosti Merck, 11. vydání, 2755.
- ^ „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 137. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A b August Freund (1881). „Über Trimethylen“ [Na trimethylenu]. Journal für Praktische Chemie. 26 (1): 367–377. doi:10.1002 / prac.18820260125.
- ^ August Freund (1882). „Über Trimethylen“ [Na trimethylenu]. Monatshefte für Chemie. 3 (1): 625–635. doi:10.1007 / BF01516828. S2CID 197767176.
- ^ G. Gustavson (1887). „Ueber eine neue Darstellungsmethode des Trimethylens“ [O novém způsobu přípravy trimethylenu]. Journal für Praktische Chemie. 36: 300–305. doi:10.1002 / prac.18870360127.
- ^ G. H. W. Lucas; V. E. Henderson (1. srpna 1929). „Nové anestetikum: cyklopropan: předběžná zpráva“. Can Med Assoc J.. 21 (2): 173–5. PMC 1710967. PMID 20317448.
- ^ H. B. Hass; E. T. McBee; G. E. Hinds (1936). "Syntéza cyklopropanu". Průmyslová a inženýrská chemie. 28 (10): 1178–81. doi:10.1021 / ie50322a013.
- ^ Eger, Edmond I .; Brandstater, Bernard; Saidman, Lawrence J .; Regan, Michael J .; Severinghaus, John W .; Munson, Edwin S. (1965). „Rovnovážné alveolární koncentrace methoxyfluranu, halothanu, diethyletheru, fluroxenu, cyklopropanu, xenonu a oxidu dusného u psa“. Anesteziologie. 26 (6): 771–777. doi:10.1097/00000542-196511000-00012. PMID 4378907.
- ^ JOHNSTONE, M; Alberts, JR (červenec 1950). „Cyklopropanová anestézie a ventrikulární arytmie“. British Heart Journal. 12 (3): 239–44. doi:10.1136 / hrt.12.3.239. PMC 479392. PMID 15426685.
- ^ MacDonald, AG (červen 1994). "Krátká historie požárů a výbuchů způsobených anestetiky". British Journal of Anesthesia. 72 (6): 710–22. doi:10.1093 / bja / 72.6.710. PMID 8024925.
- ^ A b Hugh C. Hemmings; Philip M. Hopkins (2006). Základy anestezie: Základní vědy pro klinickou praxi. Elsevier Health Sciences. str. 292–. ISBN 978-0-323-03707-5.
- ^ A b Hemmings, Hugh C. (2009). "Molekulární cíle obecné anestetiky v nervovém systému". Potlačování mysli: 11–31. doi:10.1007/978-1-60761-462-3_2. ISBN 978-1-60761-463-0.
- ^ Hara K, Eger EI, Laster MJ, Harris RA (prosinec 2002). „Nehalogenované alkany cyklopropan a butan ovlivňují neurotransmiterový iontový kanál a receptory spojené s G-proteinem: rozdílné účinky na receptory GABAA a glycinu“. Anesteziologie. 97 (6): 1512–20. doi:10.1097/00000542-200212000-00025. PMID 12459679. S2CID 21160239.[trvalý mrtvý odkaz ]
- ^ Eric V. Anslyn a Dennis A. Dougherty. Moderní fyzikální organická chemie. 2006. strany 850-852
- ^ Knipe, editoval A.C. (2007). Marchovy pokročilé reakce, mechanismy a struktura organické chemie (6. vydání). Hoboken, N.J .: Wiley-Interscience. str. 219. ISBN 978-0470084946.CS1 maint: další text: seznam autorů (odkaz)
- ^ Allen, Frank H .; Kennard, Olga; Watson, David G .; Brammer, Lee; Orpen, A. Guy; Taylor, Robin (1987). "Tabulky délek vazeb určené rentgenovou a neutronovou difrakcí. Část 1. Délky vazeb v organických sloučeninách". Journal of the Chemical Society, Perkin Transactions 2 (12): S1 – S19. doi:10.1039 / P298700000S1.
- ^ S. W. Benson, Thermochemical Kinetics, S. 273, J. Wiley & Sons, New York, London, Sydney, Toronto 1976
- ^ Dewar, M. J. (1984). "Chemické důsledky konjugace σ". J. Am. Chem. Soc. 106 (3): 669–682. doi:10.1021 / ja00315a036.
- ^ Cremer, D. (1988). „Klady a zápory σ-aromatičnosti“. Čtyřstěn. 44 (2): 7427–7454. doi:10.1016 / s0040-4020 (01) 86238-4.
- ^ Wu, Wei; Ma, Ben; Wu, Judy I-Chia; von Ragué, Schleyer; Mo, Yirong (2009). „Je cyklopropan skutečně σ-aromatické paradigma?“. Chemistry: A European Journal. 15 (38): 9730–9736. doi:10.1002 / chem.200900586. PMID 19562784.
- ^ Wollweber, Hartmund (2000). „Anestetika, generále“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a02_289.
- ^ Pokročilá organická chemie, reakce, mechanismy a struktura 3ed. Jerry March ISBN 0-471-85472-7
- ^ Fürstner, Alois; Aïssa, Christophe (2006). „Přesmyk katalyzovaný PtCl methylenecyklopropanů“. Journal of the American Chemical Society. 128 (19): 6306–6307. doi:10.1021 / ja061392y. hdl:11858 / 00-001M-0000-0025-AE20-3. PMID 16683781.
- ^ Wender, Paul A.; Haustedt, Lars O .; Lim, Jaehong; Láska, Jennifer A .; Williams, Travis J .; Yoon, Joo-Yong (květen 2006). „Asymetrická katalýza [5 + 2] cykloadiční reakce vinylcyklopropanů a π-systémů“. Journal of the American Chemical Society. 128 (19): 6302–6303. doi:10.1021 / ja058590u. PMID 16683779.