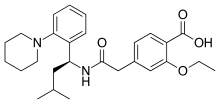
Repaglinid - Repaglinide
 | |
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Prandin, NovoNorm, Enyglid a další |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a600010 |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Pusou |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 56% (orální) |
| Vazba na bílkoviny | >98% |
| Metabolismus | Játra oxidace a glukuronidace (CYP3A4 - zprostředkovaný) |
| Odstranění poločas rozpadu | 1 hodina |
| Vylučování | Fekální (90%) a Ledviny (8%) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.158.190 |
| Chemické a fyzikální údaje | |
| Vzorec | C27H36N2Ó4 |
| Molární hmotnost | 452.595 g · mol−1 |
| 3D model (JSmol ) | |
| Bod tání | 126 až 128 ° C (259 až 262 ° F) |
| |
| |
| (ověřit) | |
Repaglinid je antidiabetikum ve třídě léků známých jako meglitinidy, a byl vynalezen v roce 1983. Repaglinid je perorální lék používaný kromě diety a cvičení pro kontrolu hladiny cukru v krvi u diabetes mellitus 2. typu.[1] Mechanismus účinku repaglinidu zahrnuje podporu uvolňování inzulínu z β-ostrůvkových buněk pankreatu; stejně jako ostatní antidiabetika je hlavním vedlejším účinkem hypoglykemie.[1] Je prodáván společností Novo Nordisk pod jménem Prandin ve Spojených státech, GlucoNorm v Kanadě, Surepost v Japonsku, Repaglinide v Egypt EIPICO a NovoNorm jinde. V Japonsku jej vyrábí společnost Dainippon Sumitomo Pharma.[2][ověření se nezdařilo ]
Lékařské použití
Repaglinid je perorální lék používaný vedle stravy a cvičení pro kontrolu hladiny cukru v krvi u diabetes mellitus 2. typu.[1]
Kontraindikace
Repaglinid je kontraindikován u lidí s:
- Diabetická ketoacidóza s kómatem nebo bez něj
- Cukrovka 1. typu
- Současné podávání s gemfibrozilem
- Známá přecitlivělost na léčivo nebo neaktivní složky [1]
Nežádoucí účinky
Mezi běžné nežádoucí účinky patří:[1]
Metabolické
- Hypoglykemie (31%)
Respirační
- Infekce horních cest dýchacích (16%)
- Sinusitida (6%)
- Rýma (3%)
Gastrointestinální
- Nevolnost (5%)
- Průjem (5%)
- Zácpa (3%)
- Zvracení (3%)
Muskuloskeletální
- Artralgie (6%)
- Bolesti zad (5%)
jiný
- Bolest hlavy (11%)
- Parestézie (3%)
Mezi závažné nežádoucí účinky patří:[1]
- Srdeční ischemie (2%)
- Angina pectoris (1,8%)
- Úmrtí na kardiovaskulární příhody (0,5%)
Zvláštní populace
Těhotenství kategorie C: bezpečnost u těhotných žen nebyla stanovena.[1] Údaje jsou omezené a existuje pouze jedna kazuistika, která nezaznamenává žádné komplikace s užíváním repaglinidu během těhotenství.[3]
Při užívání tohoto léku je třeba dbát opatrnosti u lidí s onemocněním jater a sníženou funkcí ledvin.[1]
Lékové interakce
Repaglinid je hlavním substrátem CYP3A4 a neměl by být podáván současně s gemfibrozil, klarithromycin nebo azol antimykotika jako itrakonazol nebo ketokonazol.[1] Podávání repaglinidu a jednoho nebo více těchto léků vede ke zvýšení plazmatické koncentrace repaglinidu a může vést k hypoglykémie. Současné podávání repaglinidu a klopidogrelu (inhibitor CYP2C8) může vést k významnému snížení hladin glukózy v krvi v důsledku interakce mezi léky.[4] Ve skutečnosti může společné užívání těchto léků i jeden den způsobit zvýšení hladin repaglinidu více než 5krát ... a může vést k významné hypoglykémii. Repaglinid by neměl být kombinován s sulfonylmočovina, protože mají stejný mechanismus působení.[1]
Mechanismus účinku
Repaglinid snižuje hladinu glukózy v krvi stimulací uvolňování inzulín z buněk ostrůvků beta slinivka břišní. Dosahuje toho uzavřením ATP -závislý draslíkové kanály v membráně beta buňky. Toto depolarizuje beta buňky a otevírá buňky vápníkové kanály a výsledný příliv vápníku indukuje sekreci inzulínu.[1]
Farmakokinetika
Absorpce: repaglinid má 56% biologickou dostupnost při absorpci z gastrointestinálního traktu. Biologická dostupnost je snížena při užívání s jídlem; maximální koncentrace klesá o 20%.
Distribuce: Vazba repalglinidu na albumin z bílkovin je vyšší než 98%.
Metabolismus: repaglinid je primárně metabolizován v játrech - konkrétně CYP450 2C8 a 3A4 - a v menší míře glukuronidací. Metabolity repaglinidu jsou neaktivní a nevykazují účinky snižující hladinu glukózy.
Vylučování: repaglinid se z 90% vylučuje stolicí a 8% močí. 0,1% se vylučuje v nezměněné formě močí. Méně než 2% se ve výkalech nezmění.[1]
Dějiny
Prekurzorové léky repaglinidu vynalezli koncem roku 1983 vědci z Dr. Karl Thomae GmbH, německého výrobce léčiv se sídlem v Biberach an der Riß v jižním Německu, který získal Boehringer Ingelheim v roce 1990. Droga, která se stala repaglinidem, byla později Boehringerem licencována společnosti Novo Nordisk, která podala Investigational New Drug žádost o sloučeninu s Úřad pro kontrolu potravin a léčiv (FDA) v dubnu 1992. Společnost Novo Nordisk podala své Nová aplikace drog (NDA) pro Prandin v červenci 1997 a byl rychle schválen, v prosinci 1997 byl schválen FDA. Droga byla první ze skupiny meglitinidů. Bylo to značkové Prandin protože jeho rychlý nástup a krátká doba působení koncentruje účinek kolem doby jídla ( prandium bylo římské jídlo, které je srovnatelné s moderním obědem).[2]
Duševní vlastnictví
Po několika pokusech o přihlášení do USA patent ochrany, byla podána přihláška v březnu 1990, která se nakonec stala patenty USA 5 216 167 (červen 1993), 5 312 924 (květen 1994) a 6 143 769 (listopad 2000). Po podání svého NDA pro repaglinid v roce 1997 požádala společnost Novo Nordisk o prodloužení patentu v rámci Zákon Hatch-Waxman. Tento proces se nazývá obnovení patentového termínu, umožňuje prodloužení patentů na léky na základě času, který lék strávil v klinických studiích a v procesu schvalování. Dříve o tom rozhodovalo Americký úřad pro patenty a ochranné známky že datum vypršení platnosti amerických patentů 5 216 167 a 5 312 924 bude 5. září 2006. V únoru 2001 byla životnost Prandinova patentu prodloužena na 14. března 2009 v reakci na žádost společnosti Novo Nordisk o obnovení patentového termínu, přičemž americký patent 5 216 167 byl znovu vydán jako RE37035.[5]
Před koncem patentového období repaglinidu získala společnost Novo Nordisk nový patent, US Patent 6 677 358 (leden 2004), který pokrývá kombinovanou léčbu repaglinidem spolu s generickým antidiabetickým lékem. metformin. Platnost tohoto nového patentu měla vypršet v červnu 2018. V lednu 2011 federální soud rozhodl, že nový patent společnosti Novo Nordisk je neplatný z důvodu zjevnosti a nevymahatelný z důvodu nespravedlivého chování patentových zástupců společnosti Novo Nordisk.[6]
Reference
- ^ A b C d E F G h i j k l „DailyMed - REPAGLINIDE - tableta repaglinidu“. dailymed.nlm.nih.gov. Citováno 2015-11-04.
- ^ A b „Vítejte v Novo Nordisk A / S“. Novo Nordisk A / S. Citováno 2015-11-05.
- ^ Mollar-Puchades MA, Martin-Cortes A, Perez-Calvo A, Diaz-Garcia C (leden 2007). "Použití repaglinidu u těhotné ženy během embryogeneze". Cukrovka, obezita a metabolismus. 9 (1): 146–7. doi:10.1111 / j.1463-1326.2006.00629.x. PMID 17199735. S2CID 34476970.
- ^ „Glukonorm (repaglinid) - nová kontraindikace pro současné užívání s klopidogrelem“. Health Canada.
- ^ „Podrobnosti k patentu: RE37035“.
- ^ Frankel A (2011-01-27). „Soudce shledal neplatnost a nevymahatelnost patentu na léky na cukrovku Novo Nordisk, otázky ohledně chování interního patentového právníka“. Citováno 2011-02-05.
externí odkazy
- "Repaglinid". Informační portál o drogách. Americká národní lékařská knihovna.
