Isopropylalkohol - Isopropyl alcohol
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Propan-2-ol[2] | |||
| Ostatní jména | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 635639 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.000.601 | ||
| 1464 | |||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1219 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H8Ó | |||
| Molární hmotnost | 60.096 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | štiplavý alkoholický zápach | ||
| Hustota | 0.786 g / cm3 (20 ° C) | ||
| Bod tání | -89 ° C (-128 ° F; 184 K) | ||
| Bod varu | 82,6 ° C (180,7 ° F; 355,8 K) | ||
| Mísitelný s vodou | |||
| Rozpustnost | Mísitelný s benzen, chloroform, ethanol, éter, glycerol; rozpustný v aceton | ||
| log P | 0.16[3] | ||
| Kyselost (strK.A) | 16.5[4] | ||
| −45.794·10−6 cm3/ mol | |||
Index lomu (nD) | 1.3776 | ||
| Viskozita | 2,86 cP při 15 ° C 1,96 cP při 25 ° C[5] 1,77 cP při 30 ° C[5] | ||
| 1.66 D (plyn) | |||
| Farmakologie | |||
| D08AX05 (SZO) | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Hořlavý | ||
| Bezpečnostní list | Vidět: datová stránka Externí bezpečnostní list | ||
| Piktogramy GHS |   | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H319, H336 | |||
| P210, P261, P305 + 351 + 338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Otevřený kelímek: 11,7 ° C (53,1 ° F; 284,8 K) Uzavřený kelímek: 13 ° C (55 ° F) | ||
| 399 ° C (750 ° F; 672 K) | |||
| Výbušné limity | 2–12.7% | ||
Prahová hodnota (TLV) | 980 mg / m3 (TWA), 1225 mg / m3 (STEL) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) |
| ||
LC50 (střední koncentrace ) |
| ||
LChle (nejnižší publikováno ) |
| ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | TWA 400 ppm (980 mg / m3)[6] | ||
REL (Doporučeno) | TWA 400 ppm (980 mg / m3), SVATÝ 500 ppm (1225 mg / m3)[6] | ||
IDLH (Okamžité nebezpečí) | 2000 ppm[6] | ||
| Související sloučeniny | |||
Příbuzný alkoholy | 1-propanol, ethanol, 2-butanol | ||
| Stránka s doplňkovými údaji | |||
| Index lomu (n), Dielektrická konstanta (εr), atd. | |||
Termodynamické data | Fázové chování pevná látka - kapalina - plyn | ||
| UV, IR, NMR, SLEČNA | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
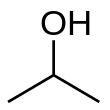
Isopropylalkohol (IUPAC název propan-2-ol; běžně nazývané isopropanol nebo 2-propanol) je a bezbarvý, hořlavý chemická sloučenina (chemický vzorec CH3CHOHCH3) se silným zápach.[8] Jako isopropyl skupina spojená s a hydroxyl skupina, je to nejjednodušší příklad a sekundární alkohol, Kde alkohol atom uhlíku je připojen ke dvěma dalším atomům uhlíku. Je to strukturní izomer z 1-propanol a ethylmethylether.
Používá se při výrobě nejrůznějších průmyslových a domácích chemikálií a je běžnou složkou chemikálií, jako je antiseptika, dezinfekční prostředky, a čistící prostředky.
Jména

Isopropylalkohol je také známý jako 2-propanol, sek-propylalkohol, IPA nebo isopropanol. IUPAC považuje isopropanol za nesprávný název, protože uhlovodíkový isopropan neexistuje.[1]
Vlastnosti
Isopropylalkohol je mísitelný ve vodě, ethanol, éter, a chloroform. Rozpouští se ethylcelulóza, polyvinylbutyral, mnoho olejů, alkaloidů, gum a přírodních pryskyřic.[9] Na rozdíl od ethanol nebo methanolu, isopropylalkohol není mísitelný se solnými roztoky a lze jej oddělit od vodní roztoky přidáním soli, jako je chlorid sodný. Proces je hovorově nazýván solení a způsobuje oddělení koncentrovaného isopropylalkoholu do odlišné vrstvy.[10]
Isopropylalkohol tvoří azeotrop s vodou, což dává teplotu varu 80,37 ° C (176,67 ° F) a složení 87,7% hmotn. (91% obj.) isopropylalkoholu. Směsi vody a isopropylalkoholu mají sníženou teplotu tání.[10] Má mírně hořkou chuť a není bezpečné pít.[10][11]
Isopropylalkohol se s klesající teplotou stává stále viskóznějším a mrzne při -89 ° C (-128 ° F).
Isopropylalkohol má maximum absorbance při 205 nm v an ultrafialové - viditelné spektrum.[12][13]
Reakce
Isopropylalkohol může být oxidovaný na aceton, což je odpovídající keton. Toho lze dosáhnout použitím oxidačních činidel, jako jsou kyselina chromová nebo dehydrogenace isopropylalkoholu na zahřátou měď katalyzátor:
- (CH3)2CHOH → (CH3)2CO + H2
Isopropylalkohol se často používá jako rozpouštědlo i jako hydrid zdroj v Redukce Meerwein-Ponndorf-Verley a další přenosová hydrogenace reakce. Isopropylalkohol lze převést na 2-brompropan použitím bromid fosforitý nebo dehydratovaný na propen vytápěním pomocí kyselina sírová.
Jako většina alkoholů, isopropylalkohol reaguje s aktivním kovy jako draslík tvořit alkoxidy které lze nazvat isopropoxidy. Reakce s hliník (zahájeno stopou rtuť ) se používá k přípravě katalyzátoru isopropoxid hlinitý.[14]
Dějiny
V roce 1920 Standardní olej nejprve vyrobil izopropylalkohol hydratací propen. Jeho hlavní použití v té době nebylo tření alkoholu ale pro oxidaci na aceton, jehož první hlavní použití bylo v první světová válka pro přípravu kordit bezdýmný, málo výbušný pohonná hmota.[15]
Výroba
V roce 1994 bylo ve Spojených státech, Evropě a Japonsku vyrobeno 1,5 milionu tun isopropylalkoholu.[16] Vyrábí se primárně kombinací vody a propen v hydratační reakce nebo hydrogenací aceton.[16][17]Existují dva způsoby procesu hydratace a oba procesy vyžadují, aby byl isopropylalkohol oddělen od vody a dalších vedlejších produktů destilace. Isopropylalkohol a voda tvoří azeotrop a jednoduchá destilace poskytne materiál, který je 87,9% hmotnostních isopropylalkoholu a 12,1% hmotnostních vody.[18] Čistý (bezvodý ) isopropylalkohol vyrábí společnost azeotropická destilace vlhkého isopropylalkoholu za použití buď diisopropylether nebo cyklohexan jako azeotropické látky.[16]
Biologický
V těle se produkuje malé množství isopropylalkoholu diabetická ketoacidóza.[19]
Nepřímá hydratace
Nepřímá hydratace reaguje s propenem kyselina sírová za vzniku směsi sulfátových esterů. Tento proces může využívat nekvalitní propen a převládá v USA. Tyto procesy poskytují primárně isopropylalkohol namísto 1-propanolu, protože následuje přidání vody nebo kyseliny sírové k propenu Markovnikovovo pravidlo. Následující hydrolýza těchto esterů parou produkuje isopropylalkohol destilací. Diisopropylether je významným vedlejším produktem tohoto procesu; recykluje se zpět do procesu a hydrolyzuje se za získání požadovaného produktu.[16]
- CH3CH = CH2 + H2Ó (CH3)2CHOH
Přímá hydratace
Přímá hydratace reaguje s propenem a vodou, ať už v plynném nebo kapalném stavu fáze, při vysokých tlacích v přítomnosti pevné nebo nanesené kyseliny katalyzátory. Tento typ procesu obvykle vyžaduje propylen vyšší čistoty (> 90%).[16] Přímá hydratace se běžněji používá v Evropě.
Hydrogenace acetonu
Isopropylalkohol lze připravit pomocí hydrogenace z aceton Tento přístup však zahrnuje další krok ve srovnání s výše uvedenými metodami, protože samotný aceton se obvykle připravuje z propenu pomocí kumenový proces.[16] Může zůstat ekonomický v závislosti na hodnotě produktů. Známým problémem je vznik MIBK a další produkty vlastní kondenzace. Raney nikl byl jedním z původních průmyslových katalyzátorů, moderní katalyzátory jsou často podporováno bimetalové materiály. Jedná se o efektivní proces a snadný
Použití
V roce 1990 bylo ve Spojených státech použito 45 000 metrických tun isopropylalkoholu, většinou jako rozpouštědlo pro nátěry nebo pro průmyslové procesy. V uvedeném roce bylo 5400 metrických tun použito pro potřeby domácnosti a pro výrobky osobní péče. Isopropylalkohol je oblíbený zejména pro farmaceutické aplikace,[16] kvůli jeho nízké toxicitě. Některé isopropylalkohol se používá jako chemický meziprodukt. Isopropylalkohol lze převést na aceton, ale kumenový proces je významnější. [16]
Solventní
Isopropylalkohol rozpouští širokou škálu nepolární sloučeniny. Rovněž se rychle odpařuje, zanechává téměř nulové stopy oleje ve srovnání s ethanolem a je relativně netoxický ve srovnání s alternativními rozpouštědly. Proto se široce používá jako rozpouštědlo a jako čisticí kapalina, zejména pro rozpouštění olejů. Dohromady s ethanol, n-butanol, a methanolu, patří do skupiny alkoholových rozpouštědel, z nichž bylo v roce 2011 celosvětově použito asi 6,4 milionu tun.[20]
K čištění se běžně používá isopropylalkohol brýle, elektrické kontakty, audio nebo video páskové hlavy, DVD a další optický disk čočky, odstranění tepelná pasta z chladiče na CPU a další IC balíčky atd.
středně pokročilí
Isopropylalkohol se esterifikuje za vzniku isopropylacetát, další rozpouštědlo. Reaguje s sirouhlík a hydroxid sodný dát isopropylxanthát sodný, a herbicid a flotace rud činidlo.[21] Isopropylalkohol reaguje s chlorid titaničitý a hliník kov dát titan a isopropoxidy hliníku první je katalyzátor a druhý chemické činidlo.[16] Tato sloučenina může sama o sobě sloužit jako chemická reagencie tím, že působí jako donor vodíku v přenosová hydrogenace.
Lékařský
Tření alkoholu, dezinfekční prostředek na ruce, a dezinfekční vložky obvykle obsahují 60–70% řešení isopropylalkoholu nebo ethanol v voda. Voda je potřebná k otevření pórů bakterií, které působí jako brána pro isopropylalkohol. 75% v / v jako dezinfekční prostředek na ruce lze použít roztok ve vodě.[22] Isopropylalkohol se používá jako pomocné vysoušecí zařízení pro prevenci otitis externa, lépe známý jako plavecké ucho.[23]
Včasné použití jako anestetikum
Ačkoli lze pro anestezii použít isopropylalkohol, jeho mnoho negativních vlastností nebo nevýhod toto použití zakazuje. Isopropylalkohol lze také použít podobně jako ether jako rozpouštědlo[24] nebo jako anestetikum vdechováním výparů nebo orálně. Dřívější použití zahrnovala použití rozpouštědla jako obecného anestetika pro malé savce[25] a hlodavci vědci a některými veterináři. Brzy však bylo přerušeno, protože se objevilo mnoho komplikací, včetně podráždění dýchacích cest, vnitřního krvácení a problémů se zrakem a sluchem. Ve vzácných případech bylo pozorováno respirační selhání vedoucí k úmrtí zvířat.
Automobilový průmysl
Isopropylalkohol je hlavní složkou „plynové sušičky“ přísady do paliv. Ve významných množstvích voda je problém v palivových nádržích, protože se odděluje od benzínu a může při nízkých teplotách zamrznout v přívodních potrubích. Alkohol neodstraňuje vodu z benzínu, ale alkohol solubilizuje voda v benzínu. Jednou rozpustný, voda nepředstavuje stejné riziko jako nerozpustná voda, protože se již nehromadí v přívodních potrubích a nezamrzá, ale je spotřebována samotným palivem. Isopropylalkohol se často prodává v aerosolových plechovkách jako čelní sklo nebo odmrazovač zámku dveří. K odstranění se také používá isopropylalkohol brzdová kapalina stopy z hydraulických brzdových systémů, takže brzdová kapalina (obvykle BOD 3, BODKA 4 nebo minerální olej ) nekontaminuje Brzdové destičky a způsobit špatné brzdění. Směsi isopropylalkoholu a vody se také běžně používají v domácí kapalině do ostřikovačů.
Laboratoř
Jako biologický konzervační prostředek poskytuje isopropylalkohol srovnatelně netoxickou alternativu k formaldehyd a další syntetické konzervační látky. K uchování vzorků se používají 70–99% roztoky isopropylalkoholu.
Isopropylalkohol se často používá v Extrakce DNA. Laboratorní pracovník ji přidá do roztoku DNA, aby vysrážel DNA, která po centrifugaci vytvoří peletu. To je možné, protože DNA je nerozpustná v isopropylalkoholu.
Bezpečnost
Výpary izopropylalkoholu jsou hustší než vzduch a jsou hořlavý, s rozsah hořlavosti ve vzduchu mezi 2 a 12,7%. Mělo by být chráněno před teplem a otevřeným plamenem.[26] Uvádí se, že se tvoří destilace isopropylalkoholu na hořčík peroxidy, které mohou při koncentraci explodovat.[27][28] Isopropylalkohol dráždí pokožku.[26][29][30] Doporučuje se nosit ochranné rukavice.
Toxikologie
Isopropylalkohol a jeho metabolit, aceton, chovat se jako centrální nervový systém (CNS) depresory.[31] Otrava může nastat při požití, vdechnutí nebo absorpci kůží. Příznaky otravy isopropylalkoholem zahrnují proplachování, bolest hlavy, závrať, Deprese CNS, nevolnost, zvracení, anestézie, podchlazení, nízký krevní tlak, šokovat, respirační deprese, a kóma.[31] Předávkování může způsobit ovocný zápach dechu v důsledku jeho metabolismu na aceton.[32]Isopropylalkohol nezpůsobuje aniontová propast acidóza ale produkuje osmolal mezera mezi vypočtenou a naměřenou osmolalitou séra, stejně jako ostatní alkoholy.[31]
Isopropylalkohol se oxiduje za vzniku acetonu alkohol dehydrogenáza v játrech,[31] a má biologický poločas u lidí mezi 2,5 a 8,0 hodinami.[31] Na rozdíl od methanolu nebo ethylenglykol otravy jsou metabolity isopropylalkoholu podstatně méně toxické a léčba je do značné míry podpůrná. Kromě toho neexistují žádné indikace pro použití fomepizol, inhibitor alkohol dehydrogenázy, pokud není podezření na společné požití s methanolem nebo ethylenglykolem.[33]
v forenzní patologie, lidé, kteří zemřeli v důsledku diabetická ketoacidóza obvykle mají koncentraci izopropylalkoholu v krvi desítek mg / dL, zatímco ti, kteří požívají fatální izopropylalkohol, mají obvykle koncentrace v krvi stovky mg / dL.[19]
Reference
- ^ A b „Alkoholy pravidlo C-201.1“. Nomenklatura organické chemie („Modrá kniha“ IUPAC), sekce A, B, C, D, E, F a H. Oxford: Pergamon Press. 1979.
Označení jako isopropanol, sek-butanol a terc-butanol jsou nesprávná, protože neexistují žádné uhlovodíky, isopropan, sek-butan a terc-butan, ke kterým lze přidat příponu „-ol“; od těchto jmen by mělo být upuštěno. Isopropylalkohol, sek-butylalkohol a terc-butylalkohol jsou však přípustné (viz pravidlo C-201.3), protože radikály isopropyl, sek-butyl a terc-butyl existují.
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 631. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ „Isopropanol_msds“. chemsrc.com.
- ^ Reeve, W .; Erikson, C.M .; Aluotto, P.F. (1979). „Nová metoda pro stanovení relativních kyselin alkoholů v alkoholových roztocích. Nukleofilita a kompetitivní reaktivita alkoxidů a fenoxidů“. Umět. J. Chem. 57 (20): 2747–2754. doi:10.1139 / v79-444.
- ^ A b Yaws, C.L. (1999). Příručka chemických vlastností. McGraw-Hill. ISBN 978-0-07-073401-2.
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0359". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C „Isopropylalkohol“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „PubChem - Isopropanol“. Citováno 10. února 2019.
- ^ Doolittle, Arthur K. (1954). Technologie rozpouštědel a změkčovadel. New York: John Wiley & Sons, Inc. str. 628.
- ^ A b C Index Merck (10. vydání). Rahway, NJ: Merck & Co. 1983. str.749.
- ^ Logsden, John E .; Loke, Richard A (1999). "Propyl Alkoholy". V Jacqueline I., Kroschwitz (ed.). Kirk-Othmer Stručná encyklopedie chemické technologie (4. vydání). New York: John Wiley & Sons, Inc., str. 1654–1656. ISBN 978-0471419617.
- ^ "Isopropylalkohol, UltimAR, vhodný pro kapalinovou chromatografii, extrakt / konc., UV-spektrofotometrie". VWR International. Citováno 25. srpna 2014.
- ^ „UV Cutoff“ (PDF). University of Toronto. Citováno 25. srpna 2014.
- ^ Young, W .; Hartung, W .; Crossley, F. (1936). "Redukce aldehydů isopropoxidem hlinitým". J. Am. Chem. Soc. 58: 100–2. doi:10.1021 / ja01292a033.
- ^ Wittcoff, M.M. Zelená ; H.A. (2003). Principy organické chemie a průmyslová praxe (1. vyd., 1. dotisk. Vyd.). Weinheim: Wiley-VCH. p. 4. ISBN 978-3-527-30289-5.
- ^ A b C d E F G h i Papa, A. J. "Propanols". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a22_173.
- ^ Logsdon, John E .; Loke, Richard A. (4. prosince 2000). "Isopropylalkohol". Kirk-Othmer Encyclopedia of Chemical Technology. Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002 / 0471238961.0919151612150719.a01. ISBN 978-0471238966.
- ^ CRC Handbook of Chemistry and Physics, 44th ed. 2143–2184
- ^ A b Petersen, Thomas H .; Williams, Timothy; Nuwayhid, Naziha; Harruff, Richard (2012). "Posmrtná detekce isopropanolu v ketoacidóze". Journal of Forensic Sciences. 57 (3): 674–678. doi:10.1111 / j.1556-4029.2011.02045.x. ISSN 0022-1198. PMID 22268588. S2CID 21101240.
- ^ Studie trhu sovětská. Ceresana. Duben 2012
- ^ „Isopropyl Xanthate Sodium, SIPX, Xanthate“. 3DChem.com. Citováno 2012-06-17.
- ^ „Průvodce po místní produkci: formulace handrubů doporučené WHO“ (PDF). Světová zdravotnická organizace. Srpna 2009.
- ^ Otitis Externa (uši plavců). Medical College of Wisconsin
- ^ Burlage, Henry M .; Welch, H; Cena, CW (2006). "Farmaceutické aplikace isopropylalkoholu II. Rozpustnost lokálních anestetik". Journal of the American Pharmaceutical Association. 36 (1): 17–9. doi:10,1002 / jps.3030360105. PMID 20285822.
- ^ Společnost pro experimentální biologii a medicínu (1922). Sborník Společnosti pro experimentální biologii a medicínu, svazek 19. p. 85.
- ^ A b "Isopropanol". Sigma-Aldrich. 19. ledna 2012. Citováno 6. července 2012.
- ^ Mirafzal, Gholam A; Baumgarten, Henry E (1988). "Kontrola peroxidovatelných sloučenin: dodatek". Journal of Chemical Education. 65 (9): A226. Bibcode:1988JChEd..65A.226M. doi:10.1021 / ed065pA226.
- ^ „Chemická bezpečnost: tvorba peroxidů ve 2-propanolu“. Chemické a technické novinky. 94 (31): 2. 1. srpna 2016.
- ^ García-Gavín, Juan; Lissens, Ruth; Timmermans, Ann; Goossens, An (2011-06-17). „Alergická kontaktní dermatitida způsobená isopropylalkoholem: vynechaný alergen?“. Kontaktujte dermatitidu. 65 (2): 101–106. doi:10.1111 / j.1600-0536.2011.01936.x. ISSN 0105-1873. PMID 21679194. S2CID 42577253.
- ^ McInnes, A (10.02.1973). „Kožní reakce na isopropylalkohol“. British Medical Journal. 1 (5849): 357. doi:10.1136 / bmj.1.5849.357-c. ISSN 0007-1447. PMC 1588210. PMID 4265463.
- ^ A b C d E Slaughter RJ, Mason RW, Beasley DM, Vale JA, Schep LJ (2014). „Otrava isopropanolem“. Klinická toxikologie. 52 (5): 470–8. doi:10.3109/15563650.2014.914527. PMID 24815348. S2CID 30223646.
- ^ Kalapos, MP (2003). „O metabolismu acetonu savců: od chemie po klinické důsledky“. Biochimica et Biophysica Acta (BBA) - Obecné předměty. 1621 (2): 122–39. doi:10.1016 / S0304-4165 (03) 00051-5. PMID 12726989.
- ^ „Otrava isopropylalkoholem“. uptodate.com. Citováno 2017-10-10.