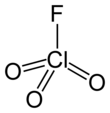
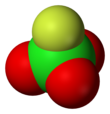
Perchlorylfluorid - Perchloryl fluoride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Perchlorylfluorid | |||
| Ostatní jména Chlor-oxyfluorid, Perchlorofluorid, Chlorfluoroxid, Trioxychlorofluorid, Perchloric acid fluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.028.660 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| ClO3F | |||
| Molární hmotnost | 102,4496 g / mol | ||
| Vzhled | Bezbarvý plyn | ||
| Zápach | sladký zápach | ||
| Hustota | 1,434 g / cm3 | ||
| Bod tání | -147,8 ° C (-234,0 ° F; 125,3 K) | ||
| Bod varu | -46,7 ° C (-52,1 ° F; 226,5 K) | ||
| 0,06 g / 100 ml (20 ° C) | |||
| Tlak páry | 10,5 atm (20 ° C)[1] | ||
| Viskozita | 3,91 x 10−3 Pa.s (@ bod tání) | ||
| Struktura | |||
| Čtyřboká[2]:373 | |||
| Termochemie | |||
Std molární entropie (S | 278,97 J / (mol * K) | ||
Std entalpie of formace (ΔFH⦵298) | -21,42 kJ / mol [3]:380 | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Žíravý, oxidační, toxický | ||
| NFPA 704 (ohnivý diamant) | |||
Prahová hodnota (TLV) | 3 ppm | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LC50 (střední koncentrace ) | 385 ppm (krysa, 4 hodiny) 451 ppm (pes, 4 hodiny)[4] | ||
LChle (nejnižší publikováno ) | 2000 ppm (krysa, 40 min) 451 ppm (pes, 4 hodiny)[4] | ||
| NIOSH (Limity expozice USA zdraví): | |||
PEL (Dovolený) | PEL (časově vážený průměr) 3 ppm (13,5 mg / m3)[1] | ||
REL (Doporučeno) | PEL (časově vážený průměr) 3 ppm (14 mg / m3) ST 6 ppm (28 mg / m.)3)[1] | ||
IDLH (Okamžité nebezpečí) | 100 ppm[1] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Perchlorylfluorid[5] je reaktivní plyn s chemický vzorec ClO
3F. Má charakteristický sladký zápach[6] který připomíná benzín a petrolej. Je toxický a silný oxidující a fluorační činidlo. To je fluorid kyseliny z kyselina chloristá.
Navzdory své malé entalpii formace (ΔHF° = −5,2 kcal / mol), je kineticky stabilní a rozkládá se pouze při 400 ° C.[2]:380 Je docela reaktivní vůči redukčním činidlům a aniontům, přičemž atom chloru působí jako elektrofil.[2]:382 Reaguje výbušně s redukčními činidly, jako je kov amidy, kovy, hydridy, atd.[6] Jeho hydrolýza ve vodě probíhá velmi pomalu, na rozdíl od hydrolýzy chlorylfluorid.
Syntéza a chemie
Perchlorylfluorid se vyrábí primárně fluorací chloristany. Antimonový pentafluorid je běžně používané fluorační činidlo:[2]:372–373
- ClO−
4 + 3 HF + 2 SbF
5 → ClO
3F + H
3Ó+
+ 2 SbF−
6
ClO
3F reaguje s alkoholy k výrobě alkyl chloristany, což jsou výbušniny extrémně citlivé na nárazy.[7] V přítomnosti Lewisovy kyseliny může být použita pro zavedení –ClO
3 seskupit do aromatických kruhů pomocí elektrofilní aromatická substituce.[8]
Aplikace
Perchlorylfluorid se používá v organické chemii jako slabé fluorační činidlo.[2]:383 Byl to první průmyslově relevantní elektrofilní fluorační činidlo, které se od 60. let používá k výrobě fluoru steroidy.[7] V přítomnosti chloridu hlinitého se také používá jako elektrofilní perchlorylační činidlo pro aromatické sloučeniny.[9]
Perchlorylfluorid byl zkoumán jako vysoce účinný kapalné palivo pro rakety okysličovadlo.[10] Ve srovnání s chlorpentafluorid a pentafluorid bromitý, má výrazně nižší specifický impuls, ale nemá tendenci korodovat nádrže. Nevyžaduje kryogenní skladování. Chemik na raketové palivo John Drury Clark uvedl ve své knize Zapalování! [11] že perchlorylfluorid je zcela mísitelný s allhalogenovými oxidačními činidly, jako je např chlorfluorid a chlorpentafluorid a taková směs poskytuje potřebný kyslík pro správné spalování paliv obsahujících uhlík.
Může být také použit v plamenová fotometrie jako zdroj buzení.[12]
Bezpečnost
Perchlorylfluorid je toxický, s a TLV ze dne 3. ppm.[13] Je to silné dráždidlo plic a očí schopné způsobit popáleniny na exponované pokožce. Své IDLH úroveň je 100 ppm.[14] Mezi příznaky expozice patří závratě, bolesti hlavy, synkopa, a cyanóza. Vystavení toxickým hladinám způsobuje těžké záněty dýchacích cest a plicní otok.[10]
Reference
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0490". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C d E Harry Julius Emeléus; A. G. Sharpe (1976). Pokroky v anorganické chemii a radiochemii, svazek 18. Akademický tisk. ISBN 0-12-023618-4.
- ^ "Perchlorylfluorid". NIST Chemistry WebBook, SRD 69. 2018.
- ^ A b „Perchlorylfluorid“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Laboratoř chemické vědy a technologie. „Perchlorylfluorid“. Národní institut pro standardy a technologie. Citováno 2009-11-28.
- ^ A b Jared Ledgard (2007). Přípravná příručka pro výbušniny (3. vyd.). Lulu.com. p. 77. ISBN 978-0-615-14290-6.
- ^ A b Peer Kirsch (2004). Moderní fluoroorganická chemie: syntéza, reaktivita, aplikace. Wiley-VCH. p. 74. ISBN 3-527-30691-9.
- ^ Peter Bernard David De la Mare (1976). Elektrofilní halogenace: reakční cesty zahrnující útok elektrofilních halogenů na nenasycené sloučeniny. Archiv CUP. p. 63. ISBN 0-521-29014-7.
- ^ Inman, C.E .; Oesterling, R.E .; Tyczkowski, E. A. (10.10.1958). „Reakce perchlorylfluoridu s organickými sloučeninami. I. Perchlorylace aromatických sloučenin1“. Journal of the American Chemical Society. 80 (19): 5286–5288. doi:10.1021 / ja01552a069. ISSN 0002-7863.
- ^ A b John Burke Sullivan; Gary R. Krieger (2001). Klinické vlivy na životní prostředí a toxické expozice (2. vyd.). Lippincott Williams & Wilkins. p. 969. ISBN 0-683-08027-X.
- ^ https://library.sciencemadness.org/library/books/ignition.pdf
- ^ Schmauch, G. E .; Serfass, E. J. (1958). "Použití perchlorylfluoridu ve fotometrii plamenem". Aplikovaná spektroskopie. 12 (3): 98–102. Bibcode:1958ApSpe..12 ... 98S. doi:10.1366/000370258774615483.
- ^ Národní institut pro bezpečnost a ochranu zdraví při práci. „Kapesní průvodce chemickými riziky NIOSH“. Centra pro kontrolu a prevenci nemocí. Citováno 2013-10-31.
- ^ Národní institut pro bezpečnost a ochranu zdraví při práci. „Dokumentace pro bezprostředně nebezpečné pro život nebo zdraví (IDLH)“. Centra pro kontrolu a prevenci nemocí. Citováno 2013-10-31.