Propen - Propene
| |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Propen[1] | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.003.693 | ||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1077 v Zkapalněný ropný plyn: 1075 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H6 | |||
| Molární hmotnost | 42.081 g · mol−1 | ||
| Vzhled | Bezbarvý plyn | ||
| Hustota | 1,81 kg / m3, plyn (1,013 bar, 15 ° C) 1,745 kg / m3, plyn (1,013 bar, 25 ° C) 613,9 kg / m3, kapalný | ||
| Bod tání | -185,2 ° C (-301,4 ° F; 88,0 K) | ||
| Bod varu | -47,6 ° C (225,6 K -53,7 ° F) | ||
| 0,61 g / m3 | |||
| -31.5·10−6 cm3/ mol | |||
| Viskozita | 8.34 µPa · s při 16,7 ° C | ||
| Struktura | |||
| 0.366 D (plyn) | |||
| Nebezpečí | |||
| Bezpečnostní list | Externí bezpečnostní list | ||
Klasifikace EU (DSD) (zastaralý) | |||
| R-věty (zastaralý) | 12 | ||
| S-věty (zastaralý) | 9-16-33 | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | -108 ° C (-162 ° F; 165 K) | ||
| Související sloučeniny | |||
Příbuzný alkeny; související skupiny | Ethylen, Izomery butylenu; Allyl, Propenyl | ||
Související sloučeniny | Propan, Propyne Propadien, 1-propanol 2-propanol | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
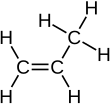
Propen, také známý jako propylen nebo methylethylen, je nenasycené organická sloučenina s chemický vzorec . Má jednu dvojná vazba a je druhým nejjednodušším členem skupiny alken třída uhlovodíky. Je to bezbarvý plyn se slabým ropným zápachem[2]
Biopropylen je biologický protějšek propylenu.[3][4]
Výroba
Praskání párou
Dominantní technologií výroby propylenu je parní krakování. Stejná technologie se aplikuje na ethan i ethylen. Tyto dvě konverze jsou procesy č. 2 a č. 1 v chemickém průmyslu, jak je posuzováno podle jejich rozsahu.[5] V tomto procesu prochází propan dehydrogenace. Vedlejším produktem je vodík:
- CH3CH2CH3 → CH3CH = CH2 + H2
Výtěžek propenu je asi 85%. Vedlejší produkty se obvykle používají jako palivo pro dehydrogenační reakci propanu. Krakování parou je jedním z energeticky nejnáročnějších průmyslových procesů.
Surovinou je nafta nebo propan, zejména v střední východ, kde je velké množství propanu z ropných / plynových operací.[6] Propen lze oddělit frakční destilace ze směsí uhlovodíků získaných z krakování a jiných rafinačních procesů; propen v rafinérské kvalitě je asi 50 až 70%.[7] Ve Spojených státech je břidlicový plyn hlavním zdrojem propan.
Technologie přeměny olefinů
Ve Phillips Triolefin nebo Technologie přeměny olefinů propylen se interkonvertuje s ethylenem a 2-buteny. Používají se katalyzátory rhenia a molybdenu:[8]
- CH2= CH2 + CH3CH = CHCH3 → 2 CH2= CHCH3
Tato technologie je založena na metateze olefinů reakce objevena v Phillips Petroleum Company.[9][10] Dosahuje se výtěžku propenu asi 90% hmotn.
Související je Methanolu na olefiny / methanolu na propenu proces. Převádí syntetický plyn (syngas) na methanolu, a pak převádí methanol na ethylen a / nebo propen. Tento proces produkuje vodu jako vedlejší produkt. Syntetický plyn se vyrábí | reformací zemního plynu nebo parou indukovanou reformací ropných produktů, jako je nafta, nebo zplyňování uhlí.
Fluidní katalytické krakování
Vysoká závažnost tekuté katalytické krakování (FCC) používá tradiční technologii FCC za náročných podmínek (vyšší poměry katalyzátoru k oleji, vyšší rychlosti vstřikování páry, vyšší teploty atd.), Aby se maximalizovalo množství propenu a jiných lehkých produktů. Jednotka FCC vysoké závažnosti je obvykle přiváděna plynovými oleji (parafiny) a zbytky a produkuje asi 20–25 m% propenu na surovině spolu s větším objemem motorového benzínu a vedlejších produktů destilátu.
Trh a výzkum
Produkce propenu zůstala statická na přibližně 35 milionech tun (Pouze Evropa a Severní Amerika) od roku 2000 do roku 2008, ale ve východní Asii, zejména v Singapuru a Číně, roste.[11] Celková světová produkce propenu je v současné době přibližně poloviční než u ethylenu.
Použití inženýrství enzymy byl prozkoumán, ale nemá žádnou komerční hodnotu.[12]
Použití
Propen je druhým nejdůležitějším výchozím produktem v EU petrochemický průmysl po ethylen. Je to surovina pro širokou škálu produktů. Výrobci plastů polypropylen tvoří téměř dvě třetiny veškeré poptávky.[13] Polypropylenová konečná použití zahrnují fólie, vlákna, nádoby, obaly a uzávěry a uzávěry. Propen se také používá k výrobě důležitých chemikálií, jako je propylenoxid, akrylonitril, kumen, butyraldehyd a kyselina akrylová. V roce 2013 bylo celosvětově zpracováno přibližně 85 milionů tun propenu.[13]
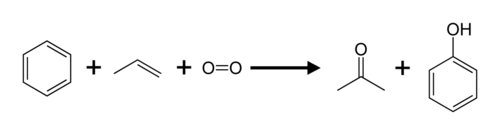
Propen a benzen jsou převedeny na aceton a fenol přes kumenový proces.
Pro výrobu se také používá propen isopropanol (propan-2-ol), akrylonitril, propylenoxid, a epichlorhydrin.[14]Průmyslová výroba akrylová kyselina zahrnuje katalytickou parciální oxidaci propenu.[15] Propen je také meziproduktem v jednokrokové selektivní oxidaci propanu na kyselinu akrylovou.[16][17][18][19]V průmyslu a dílnách se jako alternativní palivo k acetylenu používá propen Svařování a řezání kyslíkovým palivem, tvrdé pájení a ohřev kovů za účelem ohýbání. To se stalo standardem v BernzOmatic výrobky a další v náhražkách MAPP,[20] teď je to pravda MAPP plyn již není k dispozici.
Reakce
Propen se podobá ostatním alkenům v tom, že prochází přidání reakce relativně snadno při pokojové teplotě. Relativní slabost jeho dvojné vazby vysvětluje jeho tendenci reagovat s látkami, které mohou dosáhnout této transformace. Alkenové reakce zahrnují: 1) polymerizace, 2) oxidace, 3) halogenace a hydrohalogenace, 4) alkylace, 5) hydratace, 6) oligomerizace a 7) hydroformylace.
Spalování
Propen prochází spalování reakce podobným způsobem jako jiné alkeny. V přítomnosti dostatečného nebo přebytečného kyslíku propen hoří za vzniku vody a oxid uhličitý.
- 2 C.3H6 + 9 o2 → 6 CO2 + 6 hodin2Ó
Pokud není k dispozici dostatek kyslíku pro úplné spalování, dojde k neúplnému spalování kysličník uhelnatý a / nebo saze (uhlík ).
- C3H6 + 2 O.2 → 3 H2O + 2 C + CO
Bezpečnost životního prostředí
Propen je produkt spalování z lesních požárů, cigaretového kouře a výfuku motorových vozidel a letadel. Je to nečistota v některých topných plynech. Pozorované koncentrace se pohybovaly v rozmezí 0,1-4,8 dílů na miliardu (ppb ) ve venkovském vzduchu, 4–10,5 ppb ve vzduchu ve městě a 7–260 ppb ve vzorcích průmyslového vzduchu.[7]
Ve Spojených státech a některých evropských zemích a prahová hodnota 500 dílů na milion (ppm ) byla zřízena pro pracovní (8 hodin časově vážený průměr ) vystavení. Je to považováno za těkavá organická sloučenina (VOC) a emise jsou regulovány mnoha vládami, ale není uvedena v Agentuře pro ochranu životního prostředí USA (EPA) jako nebezpečná látka znečišťující ovzduší pod Zákon o čistém ovzduší. S relativně krátkým poločasem se neočekává bioakumulace.[7]
Propen má nízkou akutní toxicitu při vdechování. Vdechnutí plynu může způsobit anestetické účinky a při velmi vysokých koncentracích bezvědomí. Mez udušení pro člověka je však asi 10krát vyšší (23%) než nižší úroveň hořlavosti.[7]
Skladování a manipulace
Vzhledem k tomu, že propen je těkavý a hořlavý, je třeba přijmout preventivní opatření, aby se při manipulaci s plynem zabránilo nebezpečí požáru. Pokud je propen plněn do jakéhokoli zařízení schopného způsobit vznícení, mělo by být toto zařízení při nakládání, vykládání, připojování nebo odpojování vypnuto. Propen se obvykle skladuje jako kapalina pod tlakem, i když je také možné jej bezpečně skladovat jako plyn při teplotě okolí ve schválených nádobách.[21]
Farmakologie
Propen působí jako a centrální nervový systém depresivní přes alosterický agonismus GABAA receptor. Může dojít k nadměrné expozici sedace a amnézie, postupující do kóma a smrt v mechanismu ekvivalentním k předávkování benzodiazepiny. Úmyslné vdechování může také vést k úmrtí prostřednictvím udušení (náhlá smrt vdechováním).
Výskyt v přírodě
Propen je detekován v mezihvězdné médium pomocí mikrovlnné spektroskopie.[22] 30. září 2013 NASA také oznámil, že kosmická loď Cassini, která je součástí kosmické lodi Cassini-Huygens mise objevila malá množství přirozeně se vyskytujícího propenu v atmosféře Titan pomocí spektroskopie.[23][24]
Viz také
Reference
- ^ „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 31. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ "Propylen".
- ^ Biologický přírůstek, inteligentní přírůstek a speciální chemikálie
- ^ Duurzame bioplastics op basis van hernieuwbare grondstoffen
- ^ Giovanni Maggini (2013-04-17). „Ekonomika technologie: Propylen pomocí dehydrogenace propanu, 3. část“. Slideshare.net. Citováno 2013-11-12.
- ^ Ashfordův slovník průmyslových chemikálií, třetí vydání, 2011, ISBN 978-0-9522674-3-0, strany 7766-9
- ^ A b C d „Assessment Safety Product (PSA): Propylene“. Dow Chemical Co. Archivovány od originál dne 22.06.2013. Citováno 2011-07-11.
- ^ Ghashghaee, Mohammad (2018). „Heterogenní katalyzátory pro konverzi ethylenu v plynné fázi na vyšší olefiny“. Rev. Chem. Eng. 34 (5): 595–655. doi:10.1515 / revce-2017-0003. S2CID 103664623.
- ^ Banks, R. L .; Bailey, G. C. (1964). „Disproporcionace olefinů. Nový katalytický proces“. Výzkum a vývoj produktů průmyslové a inženýrské chemie. 3 (3): 170–173. doi:10.1021 / i360011a002.
- ^ Lionel Delaude, Alfred F. Noels (2005). "Metathesis". Kirk-Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. doi:10.1002 / 0471238961.metanoel.a01. ISBN 978-0471238966.CS1 maint: používá parametr autoři (odkaz)
- ^ Amghizar, Ismaël; Vandewalle, Laurien A .; Van Geem, Kevin M .; Marin, Guy B. (2017). „Nové trendy ve výrobě olefinů“. Inženýrství. 3 (2): 171–178. doi:10.1016 / J.ENG.2017.02.006.
- ^ de Guzman, Doris (12. října 2012). „Global Bioenergies in bio-propylene“. Zelený chemický blog.
- ^ A b „Market Market: Propylene (2nd edition), Ceresana, December 2014“. ceresana.com. Citováno 2015-02-03.
- ^ Budavari, Susan, ed. (1996). „8034. Propylen“. Merck Index, dvanácté vydání. New Jersey: Merck & Co. str. 1348–1349.
- ^ J.G.L., Fierro (vyd.) (2006). Oxidy kovů, chemie a aplikace. CRC Press. 414–455.CS1 maint: další text: seznam autorů (odkaz)
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E .; Schlögl, Robert; Trunschke, Annette (březen 2014). „Reakční síť při oxidaci propanu nad fázově čistými katalyzátory oxidu MoVTeNb M1“. Journal of Catalysis. 311: 369–385. doi:10.1016 / j.jcat.2013.12.008. hdl:11858 / 00-001M-0000-0014-F434-5.
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V .; Villa, Alberto; Schuster, Manfred E /; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (7. června 2013). "Multifunkčnost krystalických MoV (TeNb) M1 oxidových katalyzátorů při selektivní oxidaci propanu a benzylalkoholu". ACS katalýza. 3 (6): 1103–1113. doi:10.1021 / cs400010q. hdl:11858 / 00-001M-0000-000E-FA39-1.
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V .; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (leden 2012). "Povrchová chemie fázově čistého oxidu M1 MoVTeNb během provozu při selektivní oxidaci propanu na kyselinu akrylovou". Journal of Catalysis. 285 (1): 48–60. doi:10.1016 / j.jcat.2011.09.012. hdl:11858 / 00-001M-0000-0012-1BEB-F.
- ^ Csepei, Lénárd-István (2011). Kinetické studie oxidace propanu na směsných oxidových katalyzátorech na bázi Mo a V.. s. 3–24, 93. doi:10,14279 / Depositonce-2972.
- ^ Například „MAPP-Pro“
- ^ Encyclopedia of Chemical Technology, čtvrté vydání, 1996, ISBN 0471-52689-4 (v.20), strana 261
- ^ Marcelino, N .; Cernicharo, J .; Agúndez, M .; Roueff, E .; Gerin, M .; Martín-Pintado, J .; Mauersberger, R .; Thum, C. (10.08.2007). „Objev mezihvězdného propylenu (CH2CHCH3): chybějící články v mezihvězdné chemii plynné fáze“. Astrofyzikální deník. IOP. 665 (2): L127 – L130. doi:10.1086/521398. S2CID 15832967.
- ^ „Kosmická loď našla propylen na měsíci Saturn, Titan“. UPI.com. 2013-09-30. Citováno 2013-11-12.
- ^ „Cassini najde na plastu pro domácnost přísadu plastu pro domácnost“. Spacedaily.com. Citováno 2013-11-12.