Hydrid - Hydride - Wikipedia
V chemii, a hydrid je formálně anion vodíku, H−.[1] Termín je aplikován volně. V jednom extrému se všechny sloučeniny obsahující kovalentně vázané atomy H nazývají hydridy: voda je hydrid kyslíku, amoniak je hydrid dusíku atd. Pro anorganické chemiky se hydridy označují jako sloučeniny a ionty ve kterém je vodík kovalentně připojen k méně elektronegativnímu prvku. V takových případech má centrum H nukleofilní charakter, který kontrastuje s protickým charakterem kyselin. Hydridový anion je velmi zřídka pozorován.
Téměř všechny prvky se tvoří binární sloučeniny s vodíkem, výjimky jsou On,[2] Ne,[3] Ar,[4] Kr,[5] Odpoledne, Os, Ir, Rn, Fr., a Ra.[6][7][8][9] Exotické molekuly jako pozitronium hydrid byly také vyrobeny.
Vazby
Vazby mezi vodíkem a ostatními prvky se pohybují od vysoce k poněkud kovalentním. Některé hydridy, např. hydridy boru, neodpovídají klasickým pravidlům počítání elektronů a vazba je popsána pomocí multicentrických vazeb, zatímco intersticiální hydridy často zahrnují kovové lepení. Hydridy mohou být diskrétní molekuly, oligomery nebo polymery, iontové pevné látky, chemisorbovaný jednovrstvé[Citace je zapotřebí ] volně ložené kovy (vsunuté) nebo jiné materiály. Zatímco hydridy tradičně reagují jako Lewisovy základny nebo redukční činidla, některé hydridy kovů se chovají jako donory atomů vodíku a působí jako kyseliny.
Aplikace

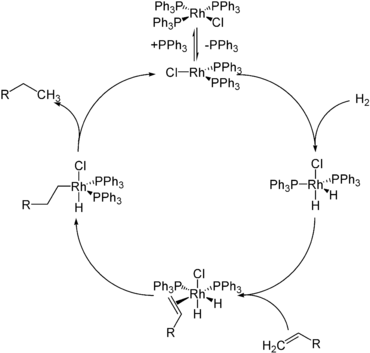
- Hydridy jako např borohydrid sodný, lithiumaluminiumhydrid, diisobutylaluminium hydrid (DIBAL) a super hydrid, se běžně používají jako redukční činidla v chemická syntéza. Hydrid se přidává k elektrofilnímu centru, obvykle nenasycenému uhlíku.
- Hydridy jako např hydrid sodný a hydrid draselný se používají jako silné základny v organická syntéza. Hydrid reaguje se slabými Bronstedova kyselina uvolnění H2.
- Hydridy jako např hydrid vápenatý se používají jako vysoušedla, tj. sušidla, k odstranění stopové vody z organických rozpouštědel. Hydrid reaguje s tvorbou vody vodík a hydroxid sůl. Suché rozpouštědlo pak může být destilováno nebo vakuově přeneseno z „nádoby s rozpouštědlem“.
- Hydridy jsou důležité v technologiích akumulačních baterií, jako jsou nikl-metal hydridová baterie. Byly zkoumány různé hydridy kovů jako prostředek pro skladování vodíku pro palivový článek - poháněná elektrická auta a další zamýšlené aspekty a vodíkové hospodářství.[11]
- Hydridové komplexy jsou katalyzátory a katalytické meziprodukty v různých homogenních a heterogenních katalytických cyklech. Mezi důležité příklady patří hydrogenace, hydroformylace, hydrosilylace, hydrodesulfurizace katalyzátory. Dokonce i některé enzymy hydrogenáza, fungují prostřednictvím hydridových meziproduktů. Nosič energie nikotinamid adenin dinukleotid reaguje jako hydridový donor nebo hydridový ekvivalent.
Hydridový ion
Volné hydridové anionty existují pouze za extrémních podmínek a nejsou vyvolávány pro homogenní roztok. Místo toho má mnoho sloučenin vodíková centra s hydridickým charakterem.
Kromě elektrický proud, hydridový ion je nejjednodušší možný anion, skládající se ze dvou elektrony a a proton. Vodík má relativně nízkou hladinu elektronová afinita 72,77 kJ / mol a exotermicky reaguje s protony jako mocný Lewisova základna.
- H− + H+ → H2; ΔH = -1676 kJ / mol
Nízká elektronová afinita vodíku a síla vazby H – H (∆HBÝT = 436 kJ / mol) znamená, že hydridový iont by byl také silný redukční činidlo
- H2 + 2e− ⇌ 2H−; E
Ó= -2,25 V
- H2 + 2e− ⇌ 2H−; E
Druhy hydridů
Podle obecné definice je každý prvek periodická tabulka (kromě některých vzácné plyny ) tvoří jeden nebo více hydridů. Tyto látky byly rozděleny do tří hlavních typů podle povahy lepení:[6]
- Iontové hydridy, které mají významné iontová vazba charakter.
- Kovalentní hydridy, které zahrnují uhlovodíky a mnoho dalších sloučenin, které kovalentně se spojit na atomy vodíku.
- Intersticiální hydridy, které lze popsat jako kovové lepení.
I když tyto divize nebyly používány univerzálně, jsou stále užitečné k pochopení rozdílů v hydridech.
Iontové hydridy
Jedná se o stechiometrické sloučeniny vodíku. Iontové nebo solné hydridy se skládají z hydridu vázaného na elektropozitivní kov, obvykle alkalický kov nebo kov alkalických zemin. Divalentní lanthanoidy jako evropské a yterbium tvoří sloučeniny podobné sloučeninám těžších kovů alkalických zemin. V těchto materiálech se na hydrid pohlíží jako na pseudohalogenid. Solné hydridy jsou nerozpustné v běžných rozpouštědlech, což odráží jejich nemolekulární struktury. Iontové hydridy se používají jako zásady a příležitostně jako redukční činidla činidla v organická syntéza.[12]
- C6H5C (O) CH3 + KH → C.6H5C (O) CH2K + H2
Typickými rozpouštědly pro takové reakce jsou ethery. Voda a další protická rozpouštědla nemůže sloužit jako médium pro iontové hydridy, protože hydridový iont je silnější základna než hydroxid a většina hydroxyl anionty. Plynný vodík se uvolňuje při typické acidobazické reakci.
Hydridy alkalických kovů často reagují s halogenidy kovů. Lithiumaluminiumhydrid (často zkráceně LAH) vyplývá z reakcí hydrid lithný s chlorid hlinitý.
- 4 LiH + AlCl3 → LiAlH4 + 3 LiCl
Kovalentní hydridy
Podle některých definic kovalentní hydridy pokrývají všechny ostatní sloučeniny obsahující vodík. Některé definice omezují hydridy na vodíková centra, která formálně reagují jako hydridy, tj. Jsou nukleofilní, a atomy vodíku vázané na kovová centra. Tyto hydridy jsou tvořeny všemi skutečnými nekovy (kromě prvků s nulovou skupinou) a prvky jako Al, Ga, Sn, Pb, Bi, Po atd., Které mají obvykle kovovou povahu, tj. Tato třída zahrnuje hydridy prvků p-bloku. V těchto látkách je hydridová vazba formálně a kovalentní vazba podobně jako vazba vytvořená protonem v a slabá kyselina. Tato kategorie zahrnuje hydridy, které existují jako diskrétní molekuly, polymery nebo oligomery, a vodík, který byl chemicky adsorbován na povrch. Obzvláště důležitým segmentem kovalentních hydridů jsou komplexní hydridy kovů, silné rozpustné hydridy běžně používané v syntetických postupech.
Molekulární hydridy často zahrnují další ligandy; například, diisobutylaluminium hydrid (DIBAL) se skládá ze dvou hliníkových center přemostěných hydridovými ligandy. Hydridy, které jsou rozpustné v běžných rozpouštědlech, jsou široce používány v organické syntéze. Obzvláště běžné jsou borohydrid sodný (NaBH4) a lithiumaluminiumhydrid a bráněná činidla, jako je DIBAL.
Intersticiální hydridy nebo hydridy kovů

Intersticiální hydridy nejčastěji existují v kovech nebo slitinách. Tradičně se jim říká „sloučeniny“, i když striktně neodpovídají definici sloučeniny, která se více podobá běžným slitinám, jako je ocel. V takových hydridech může vodík existovat buď jako atomová nebo diatomická entita. Mechanické nebo tepelné zpracování, jako je ohýbání, údery nebo žíhání, může způsobit srážení vodíku z roztoku odplyněním. Jejich vazba je obecně zvažována kovový. Takovéto přechodné kovy tvoří při vystavení vodíku intersticiální binární hydridy. Tyto systémy jsou obvykle nestechiometrický, s proměnlivým množstvím atomů vodíku v mřížce. V materiálovém inženýrství fenomén vodíková křehkost je výsledkem tvorby intersticiálních hydridů. Hydridy tohoto typu se tvoří podle jednoho ze dvou hlavních mechanismů. První mechanismus zahrnuje adsorpci dihydrogenu, následovanou štěpením vazby H-H, přemístěním elektronů vodíku a nakonec difúzí protonů do kovové mřížky. Další hlavní mechanismus zahrnuje elektrolytickou redukci ionizovaného vodíku na povrchu kovové mřížky, následovanou také difúzí protonů do mřížky. Druhý mechanismus je zodpovědný za pozorovanou dočasnou objemovou expanzi určitých elektrod používaných v elektrolytických experimentech.
Palladium absorbuje až 900násobek svého vlastního objemu vodíku při pokojové teplotě a tvoří se hydrid palladnatý. Tento materiál byl diskutován jako prostředek k přepravě vodíku pro vozidla palivové články. Intersticiální hydridy ukazují určitý příslib jako cestu k bezpečí skladování vodíku. Neutronové difrakční studie ukázaly, že atomy vodíku náhodně zaujímají oktaedrické mezery v kovové mřížce (v mřížce fcc je jedna oktaedrická díra na atom kovu). Mez absorpce za normálních tlaků je PdH0,7, což naznačuje, že přibližně 70% oktaedrických otvorů je obsazeno.[13]
Během posledních 25 let bylo vyvinuto mnoho intersticiálních hydridů, které snadno absorbují a vypouštějí vodík při teplotě místnosti a atmosférickém tlaku. Obvykle jsou založeny na intermetalické sloučeniny a slitiny v pevném roztoku. Jejich použití je však stále omezené, protože jsou schopné ukládat pouze asi 2 hmotnostní procenta vodíku, což je pro automobilové aplikace nedostatečné.[14]

Hydridové komplexy přechodných kovů
Hydridy přechodných kovů zahrnují sloučeniny, které lze klasifikovat jako kovalentní hydridy. Některé jsou dokonce klasifikovány jako intersticiální hydridy[Citace je zapotřebí ] a další přemosťující hydridy. Klasický hydrid přechodného kovu má jednoduchou vazbu mezi středem vodíku a přechodným kovem. Některé hydridy přechodných kovů jsou kyselé, např. HCo (CO)4 a H2Fe (CO)4. Anionty [ReH9]2− a [FeH6]4− jsou příklady z rostoucí sbírky známých molekul homoleptický hydridy kovů.[16] Tak jako pseudohalogenidy, hydridové ligandy jsou schopné vázat se na pozitivně polarizovaná vodíková centra. Tato interakce, tzv dihydrogenová vazba, je podobný vodíkové vazby, který existuje mezi pozitivně polarizovanými protony a elektronegativními atomy s otevřenými osamělými páry.
Deuteridy
Hydridy obsahující deuterium jsou známé jako deuteridy. Některé deuteridy, jako např Víčko, jsou důležitá fúzní paliva v termonukleární zbraně a užiteční moderátoři ve Windows jaderné reaktory.
Smíšené aniontové sloučeniny
Smíšené aniontové sloučeniny existují, které obsahují hydrid s jinými anionty. Patří mezi ně boridové hydridy, sacharidy, hydridonitridy, oxyhydridy a další.
Dodatek k nomenklatuře
Chránit, deuterid a tritide se používají k popisu iontů nebo sloučenin, které obsahují obohacený vodík-1, deuterium nebo tritium, resp.
V klasickém smyslu se hydridem rozumí jakýkoli sloučenina vodík se tvoří s dalšími prvky, sahajícími přes skupiny 1–16 ( binární sloučeniny vodíku ). Následuje seznam nomenklatury pro hydridové deriváty sloučenin hlavní skupiny podle této definice:[9]
- alkálie a alkalická zemina kovy: hydrid kovu
- bór: borane, BH3
- hliník: hliník AlH3
- galium: gallane GaH3
- indium: indigane, InH3
- thalium: thallane, TlH3
- uhlík: alkany, alkeny, alkyny, a všechno uhlovodíky
- křemík: silan
- germanium: germane
- cín: stannane
- Vést: plumbane
- dusík: amoniak („azan“, když nahrazeno ), hydrazin
- fosfor: fosfin (poznámka "fosfan" je IUPAC doporučený název)
- arsen: arsine (poznámka "arsane" je IUPAC doporučený název)
- antimon: stibine (poznámka "stibane" je IUPAC doporučený název)
- vizmut: vizmutin (poznámka "bismuthan" je IUPAC doporučený název)
- hélium: hélium hydrid (existuje pouze jako iont)
Podle výše uvedené konvence jsou následující „vodíkové sloučeniny“, nikoli „hydridy“:[Citace je zapotřebí ]
- kyslík: voda („oxidan“, když je substituován; synonymum: kyslíkhydrid), peroxid vodíku
- síra: sirovodík ("sulfan", pokud je substituován) synonymum: hydrid síry
- selen: selenid vodíku ("selane", když je nahrazen)
- telur: telurid vodíku („tellane“, když je nahrazen)
- polonium: polonid vodíku („polane“, když je nahrazen)
- halogeny: halogenovodíky
Příklady:
- hydrid nikelnatý: použito v NiMH baterie
- hydrid palladnatý: elektrody uvnitř studená fúze experimenty
- lithiumaluminiumhydrid: silné redukční činidlo používané v organické chemii
- borohydrid sodný: selektivní speciální redukční činidlo, skladování vodíku v palivové články
- hydrid sodný: silná základna používaná v organické chemii
- diboran: redukční činidlo, raketové palivo, polovodičová příměs, katalyzátor, používané v organické syntéze; taky borane, pentaboran a dekaboran
- arsine: používá doping polovodiče
- stibine: použito v polovodič průmysl
- fosfin: používá fumigace
- silan: mnoho průmyslových využití, např. výroba kompozitní materiály a odpuzovače vody
- amoniak: chladicí kapalina, palivo, hnojivo, mnoho dalších průmyslových využití
- sirovodík: složka zemní plyn, důležitý zdroj síra
- Chemicky, dokonce voda a uhlovodíky lze považovat za hydridy.
Všechny metaloidové hydridy jsou vysoce hořlavé. Všechny pevné nekovové hydridy kromě led jsou vysoce hořlavé. Ale když se vodík spojí s halogeny, produkuje spíše kyseliny než hydridy a nejsou hořlavé.
Prioritní konvence
Podle Konvence IUPAC, podle priority (stylizovaná elektronegativita), vodík spadá mezi skupina 15 a skupina 16 elementy. Proto máme NH3„hydrid dusíku“ (amoniak ), ve srovnání s H2O, „oxid vodíku“ (voda ). Tato konvence je někdy porušena pro polonium, které je z důvodu metalicity polonia často označováno jako „hydrid polonia“ místo očekávaného „polonidu vodíku“.
Viz také
Reference
- ^ Zlatá kniha IUPAC https://goldbook.iupac.org/terms/view/H02904. Chybějící nebo prázdný
| název =(Pomoc) - ^ Hydrid hélia existuje jako ion.
- ^ Neonium je ion a existuje také HNe excimer.
- ^ Argonium existuje jako ion.
- ^ Kryptoniový ion existují jako kation.
- ^ A b Greenwood, N. N .; & Earnshaw, A. (1997). Chemistry of the Elements (2. vyd.), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Stručná anorganická chemie J.D. Lee
- ^ Chemie hlavní skupiny, 2. vydání A.G. Massey
- ^ A b Nomenklatura anorganické chemie („Červená kniha“) (PDF). Doporučení IUPAC. 2005. Odst. IR-6.
- ^ Chatgilialoglu, Chryssostomos; Ferreri, Carla; Landais, Yannick; Timokhin, Vitaliy I. (2018). „Třicet let (TMS)3SiH: Milník v radikální syntetické chemii “. Chemické recenze. 118 (14): 6516–6572. doi:10.1021 / acs.chemrev.8b00109. PMID 29938502.
- ^ Grochala, Wojciech; Edwards, Peter P. (03.03.2004). „Tepelný rozklad neintersticiálních hydridů pro skladování a výrobu vodíku“. Chemické recenze. 104 (3): 1283–1316. doi:10.1021 / cr030691s. PMID 15008624.
- ^ Brown, H. C. (1975). Organické syntézy pomocí boranů. New York: John Wiley & Sons. ISBN 0-471-11280-1.
- ^ Hydrid palladnatý
- ^ Züttel, Andreas (2003). „Materiály pro skladování vodíku“. Materiály dnes. 6 (9): 24–33. doi:10.1016 / s1369-7021 (03) 00922-2.
- ^ Jackson, Peter F .; Johnson, Brian F. G .; Lewis, Jack; Raithby, Paul R .; McPartlin, Mary; Nelson, William J. H .; Rouse, Keith D .; Allibon, John; Mason, Sax A. (1980). „Přímé umístění intersticiálního hydridového ligandu v [HRu6(CO)18]– rentgenovou i neutronovou analýzou [Ph4Jako] [HRu6(CO)18]". Chem. Commun. (7): 295. doi:10.1039 / c39800000295.
- ^ A. Dedieu (editor) Transition Metal Hydrides 1991, Wiley-VCH, Weinheim. ISBN 0-471-18768-2
Bibliografie
W. M. Mueller, J. P. Blackledge, G. G. Libowitz, Hydridy kovů, Academic Press, NY a Londýn, (1968)
externí odkazy
 Média související s Hydridy na Wikimedia Commons
Média související s Hydridy na Wikimedia Commons
