Indiplon - Indiplon
 | |
| Klinické údaje | |
|---|---|
| Trasy z správa | Ústní |
| ATC kód |
|
| Právní status | |
| Právní status |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.133.676 |
| Chemické a fyzikální údaje | |
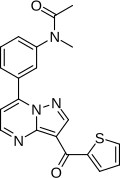
| Vzorec | C20H16N4Ó2S |
| Molární hmotnost | 376.43 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Indiplon (HOSPODA a USAN ) je nonbenzodiazepin, hypnotický sedativní který byl vyvinut ve dvou formulacích - formulace s okamžitým uvolňováním pro nástup spánku a verze s modifikovaným uvolňováním (nazývaná také řízené nebo prodloužené uvolňování) pro údržbu spánku.
Režim akce
Indiplon funguje tak, že zvyšuje účinek inhibičního neurotransmiteru GABA, stejně jako většina ostatních sedativ bez benzodiazepinů. Primárně se váže na α1 podjednotky GABAA receptory v mozku.[1]
Dějiny
Indiplon byl objeven v Lederle Laboratories (který získal později Wyeth ) v 80. letech a nazýval se CL 285 489.[2]:454 V roce 1998 ji Lederle spolu s dalšími rané stadii drogové licence licencoval DOV Pharmaceutical, startup vytvořený bývalými zaměstnanci Lederle, a Dov exkluzivně sublicencoval svá práva na drogu Neurokrinní biologické vědy ve stejném roce.[2] V roce 2002 Neurocrine uzavřel dohodu se společností Pfizer o vývoji této drogy.[2]
Indiplon byl původně naplánován na vydání v roce 2007, kdy Sanofi-Aventis „populární hypnotikum zolpidem ztratil patentová práva ve Spojených státech a stal se tak dostupným jako mnohem levnější generikum. V roce 2002 Neurokrinní biologické vědy uzavřel dohodu s Pfizer na společný trh indiplonu v USA v obchodě v hodnotě potenciálních 400 mil. USD.[3] Po vydání a neschválitelný dopis pro 15 mg formulaci s řízeným uvolňováním a an schválitelný dopis s ustanoveními pro verzi 5 mg a 10 mg s okamžitým uvolňováním FDA v květnu 2006,[4] Pfizer ukončila svůj vztah s neurokrinem.[5] Cena akcií společnosti Neurocrine klesla u zpráv o 60%.[6]
Po opětovném odeslání FDA v prosinci 2007 považován za neurokrinní nová aplikace léku (NDA) „schválen“ ve formulacích 5 a 10 mg,[7] požadovala však nové studie jako předpoklad ke schválení, včetně klinické studie u starších osob, studie bezpečnosti srovnávající nežádoucí účinky s účinky obdobně prodávaných léků a preklinické studie zkoumající bezpečnost indiplonu ve třetím trimestru těhotenství.[8]
Po dopise FDA z roku 2007 se Neurocrine rozhodl ukončit veškerý klinický a marketingový vývoj Indiplonu ve Spojených státech.[7][8]
Reference
- ^ Petroski RE, Pomeroy JE, Das R, Bowman H, Yang W, Chen AP, Foster AC (duben 2006). „Indiplon je vysoce afinitní pozitivní alosterický modulátor se selektivitou pro receptory GABAA obsahující podjednotku alfa1“ (PDF). The Journal of Pharmacology and Experimental Therapeutics. 317 (1): 369–77. doi:10.1124 / jpet.105.096701. PMID 16399882. S2CID 46510829.
- ^ A b C Neubauer DN (2010). „Indiplon“. In Monti JS, Pandi-Perumal SR, Möhler H (eds.). GABA a spánek: Molekulární, funkční a klinické aspekty. Springer Science & Business Media. 453–464. ISBN 9783034602266.
- ^ „Neurokrinní biologie v San Diegu zaznamenají za dva dny druhý velký úděl“. Bláznivý blázen. 18. června 2010.
- ^ „Neurokrinní noční můra FDA“. TheStreet.com. 16. května 2006.
- ^ „Pfizer Drops Neurocrine Deal“. TheStreet.com. 22. června 2006.
- ^ „Cena neurokrinních akcií klesá o 60 procent: smíšená recenze FDA týkající se prášku na spaní Indiplon by mohla ohrozit partnerství Pfizer-Neurocrine“. Peníze CNN. 15. května 2006.
- ^ A b „Neurokrin přijímá schválitelný dopis pro kapsle Indiplon s dalšími údaji o bezpečnosti a účinnosti požadovanými FDA“ (Tisková zpráva). Neurocrine Biosciences, Inc. 2007-12-13. Citováno 2007-12-13.
- ^ A b „Další projekty potrubí“. Neurokrinní. 16. února 2012. Archivováno od originálu dne 2012-02-17. Citováno 2014-06-24.
