Ethanolamin - Ethanolamine
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC 2-aminoethan-1-ol[1] | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.004.986 |
| Číslo ES |
|
| KEGG | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C2H7NÓ | |
| Molární hmotnost | 61.084 g · mol−1 |
| Vzhled | bezbarvá kapalina |
| Zápach | Nepříjemný amoniak - jako zápach |
| Hustota | 1.0117 g / cm3 |
| Bod tání | 10,3 ° C (50,5 ° F; 283,4 K) |
| Bod varu | 170 ° C (338 ° F; 443 K) |
| Mísitelný | |
| Tlak páry | 64 Pa (20 ° C)[2] |
| Kyselost (strK.A) | 9.50[3] |
Index lomu (nD) | 1.4539 (20 ° C)[4] |
| Nebezpečí | |
| Bezpečnostní list | Sigma[5] |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H302, H312, H332, H314, H335, H412[5] | |
| P261, P273, P305 + 351 + 338, P303 + 361 + 353[5] | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 85 ° C (185 ° F; 358 K) (uzavřený kelímek) |
| 410 ° C (770 ° F; 683 K) | |
| Výbušné limity | 5.5–17% |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) |
|
| NIOSH (Limity expozice USA zdraví): | |
PEL (Dovolený) | PEL: 3 ppm (6 mg / m3)[6] |
REL (Doporučeno) |
|
IDLH (Okamžité nebezpečí) | 30 ppm[6] |
| Související sloučeniny | |
Související sloučeniny | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Ethanolamin (2-aminoethanol, monoethanolamin, ETAnebo MEA) je organická chemická sloučenina se vzorcem HOCH2CH2NH2 (C2H7NE). Molekula je bifunkční, obsahující obě a primární amin a a primární alkohol. Ethanolamin je a bezbarvý, viskózní kapalný s zápach připomínající amoniak.[8] Jeho deriváty jsou v přírodě velmi rozšířené; např., lipidy, tak jako předchůdce různých N-acetylethanolaminy (NAE), které modulují několik zvíře a rostlina fyziologický procesy, jako je osivo klíčení, rostlinný patogen interakce, chloroplast vývoj a kvetoucí,[9] stejně jako předchůdce v kombinaci s kyselina arachidonová (C20H32Ó2; 20:4, ω-6 ), za vzniku endokanabinoidu Anandamid (AEA: C22H37NE2; 20: 4, ω-6).[10]
Ethanolaminy zahrnují skupinu aminoalkoholy. Třída antihistaminika je identifikován jako ethanolaminy, což zahrnuje karbinoxamin, klemastin, dimenhydrinát, Chlorfenoxamin, difenhydramin a doxylamin.[11]
Průmyslová produkce
Monoethanolamin se vyrábí zpracováním ethylenoxid s vodným amoniak; reakce také produkuje diethanolamin a triethanolamin. Poměr produktů lze regulovat pomocí stechiometrie reaktantů.[12]
Biochemie
Ethanolamin je biosyntetizovaný dekarboxylací serin:[13]
- HOCH2CH (CO2H) NH2 → HOCH2CH2NH2 + CO2
Ethanolamin je druhou nejhojnější skupinou fosfolipidy látky nalezené v biologické membrány (zejména prokaryoty); např., fosfatidylethanolamin. Používá se také v molekulách posla, jako je palmitoylethanolamid, který má vliv na receptory CB1.[14]
Aplikace
Ethanolamin se běžně nazývá monoethanolamin nebo MEA, aby se odlišil od diethanolamin (DEA) a triethanolamin (ČAJ). Používá se jako surovina při výrobě čistící prostředky, emulgátory, leštidla, léčiva, inhibitory koroze a chemické meziprodukty.[8]
Například reakce ethanolaminu s amoniak dává ethylendiamin, předchůdce běžně používaných chelatační činidlo, EDTA.[12]
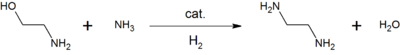
Čištění proudu plynu
Stejně jako ostatní aminy je monoethanolamin a slabá základna a tato vlastnost se využívá při jeho použití při čištění plynu. Monoethanolaminy mohou vydrhovat emise spalin ze spalovaného uhlí, spaleného metanu a spalovaného bioplynu oxid uhličitý (CO.)2) velmi efektivně. Monoethanolaminové čištění snižuje klimatická změna a může učinit historický uhelný a bioplynový průmysl modernějším, zdravějším a prodejnějším. Z právního hlediska je to zvláště důležité pro Pařížská dohoda. MEA čištění oxidem uhličitým se také používá k regeneraci vzduchu na ponorkách.
Řešení MEA v voda se používají jako praní proudu plynu kapalný v amine treaters. Například k odstranění se používá vodný MEA oxid uhličitý (CO.)2) a sirovodík (H2S) z různých proudů plynu; např., spalin a kyselý zemní plyn.[15] MEA ionizuje rozpuštěný kyselé sloučeniny, což je dělá polární a podstatně více rozpustný.
MEA čisticí roztoky lze recyklovat prostřednictvím regenerační jednotky. Při zahřátí uvolní MEA, protože je poměrně slabá báze, rozpuštěný H2S nebo CO2 plyn vedoucí k čistému roztoku MEA.[12][16]
Jiná použití
Ve farmaceutických formulacích se MEA používá primárně pro pufrování nebo přípravu emulzí. MEA může být použit jako regulátor pH v kosmetice.[17]
Je to injekční sklerosant jako možnost léčby symptomatických hemoroidů. 2 až 5 ml ethanolamin-oleátu lze injikovat do sliznice těsně nad hemoroidy, aby způsobily ulceraci a fixaci sliznice, čímž zabrání sestupu hemoroidů z análního kanálu.
Je také přísadou do čisticí kapaliny pro automobily čelní skla. [18]
amin regulující pH
Ethanolamin se často používá k alkalizaci vody v parních cyklech elektráren, včetně jaderných elektrárny s tlakovodní reaktory. Tato alkalizace se provádí za účelem kontroly koroze kovových součástí. ETA (nebo někdy podobný organický amin; např. morfolin ) je vybrán, protože se nehromadí v parních generátorech (kotlech) a štěrbiny kvůli jeho těkavosti, ale spíše se distribuuje relativně rovnoměrně po celý parní cyklus. V takové aplikaci je ETA klíčovou přísadou tzv. „All-volatile treatment“ vody (AVT).[Citace je zapotřebí ]
Reference
- ^ A b Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. str. 649, 717. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Například název „ethanolamin“, který je stále široce používán, je špatně vytvořen kvůli přítomnosti dvou přípon; nejde o alternativu k preferovanému názvu IUPAC, „2-aminoethan-1-ol“.
- ^ „Bezpečnostní list etanolaminu“ (PDF). Acros Organics. Archivovány od originál (PDF) dne 15.7.2011.
- ^ Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- ^ R.E. Reitmeier; V. Sivertz; H. V. Tatar (1940). "Některé vlastnosti monoethanolaminu a jeho vodných roztoků". Journal of the American Chemical Society. 62 (8): 1943–1944. doi:10.1021 / ja01865a009.
- ^ A b C Sigma-Aldrich Co., Ethanolamin. Citováno 2018-05-24.
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0256". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ "Ethanolamin". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b Matthias Frauenkron, Johann-Peter Melder, Günther Ruider, Roland Rossbacher, Hartmut Höke (2002). "Ethanolamines a Propanolamines". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a10_001. ISBN 3527306730.CS1 maint: používá parametr autoři (odkaz)
- ^ Coutinho, Bruna G .; Mevers, Emily; Schaefer, Amy L .; Pelletier, Dale A .; Harwood, Caroline S.; Clardy, Jon; Greenberg, E. Peter (2018-09-25). „Bakteriální signální systém reagující na rostliny snímá derivát ethanolaminu“. Sborník Národní akademie věd Spojených států amerických. 115 (39): 9785–9790. doi:10.1073 / pnas.1809611115. ISSN 0027-8424. PMC 6166808. PMID 30190434.
- ^ Marzo, V. Di; Petrocellis, L. De; Sepe, N .; Buono, A. (1996-06-15). „Biosyntéza anandamidu a příbuzných acylethanolamidů v myších makrofágech J774 a buňkách neuroblastomu N18“. Biochemical Journal. 316 (Pt 3): 977–84. doi:10.1042 / bj3160977. PMC 1217444. PMID 8670178.
- ^ Toxicita při kašli, nachlazení a alergii na eMedicína
- ^ A b C Klaus Weissermel; Hans-Jürgen Arpe; Charlet R. Lindley; Stephen Hawkins (2003). „Kapitola 7. Oxidační produkty ethylenu“. Průmyslová organická chemie. Wiley-VCH. str. 159–161. ISBN 3-527-30578-5.
- ^ „Archivovaná kopie“. Archivovány od originál dne 21. 8. 2012. Citováno 2015-08-09.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Calignano, A; La Rana, G; Piomelli, D (2001). "Antinociceptivní aktivita endogenního amidu mastné kyseliny, palmitylethanolamidu". European Journal of Pharmacology. 419 (2–3): 191–8. doi:10.1016 / S0014-2999 (01) 00988-8. PMID 11426841.
- ^ Úrovně navádění v případě nouze a kontinuální expozice pro vybrané kontaminanty ponorky. 2007. doi:10.17226/11170. ISBN 978-0-309-09225-8.
- ^ "Ethanolamin". Správa bezpečnosti a ochrany zdraví při práci. Archivovány od originál dne 03.05.2013. Citováno 2008-05-11.
- ^ F. Carrasco (2009). „Ingredientes Cosméticos“. Diccionario de Ingredientes Cosméticos 4ª vyd. www.imagenpersonal.net. p. 306. ISBN 978-84-613-4979-1.
- ^ Federální bezpečnostní normy pro motorová vozidla


