Alkohol - Alcohol


v chemie, alkohol je organická sloučenina který nese alespoň jeden hydroxyl funkční skupina (-OH) vázaný na a nasycený uhlík atom.[2] Termín alkohol původně odkazoval na primární alkohol ethanol (ethylalkohol), což je používá se jako droga a je hlavním alkoholem přítomným v alkoholické nápoje. Důležitá třída alkoholů, z toho methanolu a ethanol jsou nejjednodušší členy, zahrnuje všechny sloučeniny, pro které je obecný vzorec CnH2n + 1ACH. Jednoduché monoalkoholy, které jsou předmětem tohoto článku, zahrnují primární (RCH2OH), sekundární (R.2CHOH) a terciární (R3COH) alkoholy.
Přípona -ol se objeví v Chemický název IUPAC všech látek, kde hydroxylová skupina je funkční skupina s nejvyšší prioritou. Pokud je ve sloučenině skupina s vyšší prioritou, předpona hydroxy- se používá v jeho IUPAC název. Přípona -ol v názvech jiných než IUPAC (například paracetamol nebo cholesterol ) také obvykle označuje, že látkou je alkohol. Mnoho látek, které obsahují hydroxylové funkční skupiny (zejména cukry, jako např glukóza a sacharóza ) mají jména, která neobsahují ani příponu -ol, ani předpona hydroxy-.
Dějiny
Destilace alkoholu pravděpodobně vznikl v civilizaci údolí Indu již v roce 2000 př. n. l. Obyvatelé Indie užívali alkoholický nápoj zvaný Sura vyrobený z fermentované rýže, ječmene, jaggery a květiny stromu madhyaka.[3] Destilace alkoholu byla islámským chemikům známa již v osmém století.[4][5]
The Arab chemik, al-Kindi, jednoznačně popsal destilaci vína v pojednání nazvaném „Kniha chemie parfémů a destilací“.[6][7][8]
The Peršan lékař a polymath, Muhammad ibn Zakariya al-Razi objevil alkohol jako chemickou sloučeninu.[9][10]
Nomenklatura
Etymologie
Slovo „alkohol“ pochází z arabštiny kohl (arabština: الكحل, romanized: al-kuḥl), prášek používaný jako oční linka.[11] Al- je arabština určitý člen, ekvivalentní the v angličtině. Alkohol byl původně použit pro velmi jemný prášek vyráběný společností sublimace přírodního minerálu stibnite tvořit trisulfid antimonitý Sb
2S
3. Bylo to považováno za podstatu nebo „ducha“ tohoto minerálu. Byl použit jako antiseptický, oční linky a kosmetický. Význam alkoholu byl rozšířen na destilované látky obecně a poté se zúžil na ethanol, když „lihoviny“ byly synonymem pro tvrdý alkohol.[12]
Bartoloměj Traheron, v jeho 1543 překladu Jan z Viga, zavádí toto slovo jako termín používaný „barbarskými“ autory pro „jemný prášek“. Vigo napsal: „Barbarští auktoři používají alkohol, nebo (jak jsem fynde to napodobuje) alkohol, pro nejjemnější jemné poudre.“[13]
1657 Lexikon Chymicum, William Johnson, glosuje slovo jako „antimonium sive stibium“.[14] V širším smyslu se toto slovo začalo vztahovat na jakoukoli tekutinu získanou destilací, včetně „alkoholu z vína“, destilované esence vína. Libavius v Alchymie (1594) odkazuje na „vini alkohol vel vinum alcalisatum“. Johnson (1657) alkohol vini jako „quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat.“ Význam slova se omezil na „duch vína“ (chemická látka známá dnes jako ethanol ) v 18. století a byl rozšířen na třídu látek tzv. „alkoholy“ v moderní chemii po roce 1850.[13]
Termín ethanol byl vynalezen v roce 1892 spojením tohoto slova etan s koncovkou „-ol“ na „alkohol“.[15]
Systematické názvy
Názvosloví IUPAC se používá ve vědeckých publikacích a kde je důležitá přesná identifikace látky, zejména v případech, kdy relativní složitost molekuly nezpůsobí, že by byl takový systematický název nepraktický. Při pojmenování jednoduchých alkoholů ztratí název alkanového řetězce terminál E a přidá příponu -ol, např., jako v „ethanolu“ z názvu alkanového řetězce „ethan“.[16] V případě potřeby je poloha hydroxylové skupiny indikována číslem mezi alkanovým názvem a -ol: propan-1-ol pro CH
3CH
2CH
2ACH, propan-2-ol pro CH
3CH (OH) CH
3. Pokud je přítomna skupina s vyšší prioritou (například aldehyd, keton nebo karboxylová kyselina ), pak předpona hydroxy-se používá,[16] např. jako v 1-hydroxy-2-propanonu (CH
3C (O) CH
2ACH).[17]
| CH3–CH2–CH2-ACH |  |  |  | 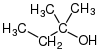 |
 | 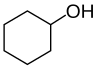 | 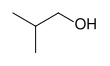 | ||
| n-propylalkohol, propan-1-ol, nebo 1-propanol | isopropylalkohol, propan-2-ol, nebo 2-propanol | cyklohexanol | isobutylalkohol, 2-methylpropan-1-ol, nebo 2-methyl-l-propanol | tert-ylalkohol, 2-methylbutan-2-ol nebo 2-methyl-2-butanol |
| Primární alkohol | Sekundární alkohol | Sekundární alkohol | Primární alkohol | Terciární alkohol |
V případech, kdy je OH funkční skupina navázána na sp2 uhlík na aromatický kruh molekula je známá jako a fenol a je pojmenován podle pravidel IUPAC pro pojmenování fenolů.[18]
Běžná jména
V jiných méně formálních kontextech se alkohol často nazývá názvem odpovídající alkylové skupiny, za kterým následuje slovo „alkohol“, např. methyl alkohol, ethyl alkohol. Propyl alkohol může být n-propylalkohol nebo isopropylalkohol, v závislosti na tom, zda je hydroxylová skupina navázána na koncový nebo střední uhlík na přímce propan řetěz. Jak je popsáno pod systematickým pojmenováním, pokud má přednost jiná skupina na molekule, alkoholová část je často indikována pomocí předpony „hydroxy-“.[19]
Alkoholy se poté klasifikují na primární, sekundární (sek-, s-) a terciární (tert-, t-), na základě počtu atomů uhlíku připojených k atomu uhlíku, který nese hydroxyl funkční skupina. (Příslušné číselné zkratky 1 °, 2 ° a 3 ° se také někdy používají v neformálním nastavení.[20]) Primární alkoholy mají obecný vzorec RCH2ACH. Nejjednodušší primární alkohol je methanol (CH3OH), pro kterou R = H, a další je ethanol, pro který R = CH3, methylová skupina. Sekundární alkoholy jsou ty ve formě RR'CHOH, z nichž nejjednodušší je 2-propanol (R = R '= CH3). Pro terciární alkoholy je obecná forma RR'R "COH. Nejjednodušší příklad je terc-butanol (2-methylpropan-2-ol), kde každý z R, R 'a R "je CH3. V těchto zkratkách představují R, R 'a R " substituenty, alkyl nebo jiné připojené, obecně organické skupiny.
V archaické nomenklatuře mohou být alkoholy pojmenovány jako deriváty methanolu, přičemž jako koncovka je použit „-karbinol“. Například (CH3)3COH lze pojmenovat trimethylkarbinol.
| Typ | Vzorec | IUPAC název | Běžné jméno |
|---|---|---|---|
| Monohydrát alkoholy | CH3ACH | Metanol | Alkohol ze dřeva |
| C2H5ACH | Ethanol | Alkohol | |
| C3H7ACH | Propan-2-ol | Isopropylalkohol, Tření alkoholu | |
| C4H9ACH | Butan-1-ol | Butanol, Butylalkohol | |
| C5H11ACH | Pentan-1-ol | Pentanol, Amylalkohol | |
| C16H33ACH | Hexadekan-1-ol | Cetyl alkohol | |
| Vícesytné alkoholy | C2H4(ACH)2 | Ethan-1,2-diol | Ethylenglykol |
| C3H6(ACH)2 | Propan-1,2-diol | Propylenglykol | |
| C3H5(ACH)3 | Propan-1,2,3-triol | Glycerol | |
| C4H6(ACH)4 | Butan-l, 2,3,4-tetraol | Erythritol, Threitol | |
| C5H7(ACH)5 | Pentan-1,2,3,4,5-pentol | Xylitol | |
| C6H8(ACH)6 | hexan-l, 2,3,4,5,6-hexol | Mannitol, Sorbitol | |
| C7H9(ACH)7 | Heptan-l, 2,3,4,5,6,7-heptol | Volemitol | |
| Nenasycený alifatický alkoholy | C3H5ACH | Prop-2-en-1-ol | Allylalkohol |
| C10H17ACH | 3,7-dimethylocta-2,6-dien-l-ol | Geraniol | |
| C3H3ACH | Prop-2-yn-1-ol | Propargylalkohol | |
| Alicyklické alkoholy | C6H6(ACH)6 | Cyklohexan-l, 2,3,4,5,6-hexol | Inositol |
| C10H19ACH | 5-Methyl-2- (propan-2-yl) cyklohexan-1-ol | Mentol |
Aplikace
Alkoholy mají dlouhou historii nesčetného použití. U jednoduchých monoalkoholů, které jsou předmětem tohoto článku, jsou nejdůležitější průmyslové alkoholy následující:[22]
- methanolu, zejména k výrobě formaldehyd a jako přísada do paliva
- ethanol, hlavně pro alkoholické nápoje, přísady do paliv, rozpouštědla
- 1-propanol, 1-butanol a isobutylalkohol pro použití jako rozpouštědlo a předchůdce rozpouštědel
- Alkoholy C6 – C11 používané pro změkčovadla, např. v polyvinyl chlorid
- mastný alkohol (C12 – C18), prekurzory čistící prostředky
Metanol je nejběžnějším průmyslovým alkoholem, s přibližně 12 miliony tun / rok vyrobenými v roce 1980. Kombinovaná kapacita ostatních alkoholů je přibližně stejná a je rozdělena zhruba rovnoměrně.[22]
Toxicita
Pokud jde o akutní toxicitu, jednoduché alkoholy mají nízkou akutní toxicitu. Dávky několika mililitrů jsou tolerovány. Pro pentanoly, hexanoly, oktanoly a delší alkoholy, LD50 rozmezí od 2–5 g / kg (potkani, orálně). Metanol a ethanol jsou méně akutně toxické. Všechny alkoholy mírně dráždí pokožku.[22]
Metabolismus methanolu (a ethylenglykolu) je ovlivněn přítomností ethanolu, který má vyšší afinitu k jaterní alkohol dehydrogenáza. Tímto způsobem bude methanol vylučován neporušený močí.[23][24][25]
Fyzikální vlastnosti
Obecně platí, že hydroxylová skupina vyrábí alkoholy polární. Tyto skupiny se mohou tvořit Vodíkové vazby jeden druhému a většině ostatních sloučenin. Vzhledem k přítomnosti polárních OH alkoholů jsou více rozpustné ve vodě než jednoduché uhlovodíky. Metanol, ethanol a propanol jsou mísitelný ve vodě. Butanol, se čtyř uhlíkovým řetězcem, je mírně rozpustný.
Kvůli vodíkové vazby, alkoholy mívají vyšší teploty varu než srovnatelné uhlovodíky a ethery. Bod varu alkoholového ethanolu je 78,29 ° C, ve srovnání s 69 ° C pro uhlovodíky hexan a 34,6 ° C pro diethylether.
Výskyt v přírodě
Jednoduché alkoholy se v přírodě vyskytují široce. Ethanol je nejvýznamnější, protože je produktem fermentace, hlavní cesty výroby energie. Ostatní jednoduché alkoholy se tvoří pouze ve stopových množstvích. Složitější alkoholy jsou však všudypřítomné, což se projevuje u cukrů, některých aminokyselin a mastných kyselin.
Výroba
Zieglerovy a oxo procesy
V Zieglerův proces, lineární alkoholy se vyrábějí z ethylenu a triethylaluminium následuje oxidace a hydrolýza.[22] Idealizovaná syntéza 1-oktanol je ukázáno:
- Al (C.2H5)3 + 9 ° C2H4 → Al (C.8H17)3
- Al (C.8H17)3 + 3 O + 3 H2O → 3 HOC8H17 + Al (OH)3
Tento proces generuje řadu alkoholů, které jsou odděleny destilace.
Mnoho vyšších alkoholů vyrábí společnost hydroformylace alkenů s následnou hydrogenací. Při aplikaci na terminální alken, jak je běžné, se obvykle získá lineární alkohol:[22]
- RCH = CH2 + H2 + CO → RCH2CH2CHO
- RCH2CH2CHO + 3 H2 → RCH2CH2CH2ACH
Takové procesy dávají mastné alkoholy, které jsou užitečné pro prací prostředky.
Hydratační reakce
Některé nízkomolekulární alkoholy průmyslového významu se vyrábějí přidáním vody k alkenům. Tímto obecným způsobem se vyrábí ethanol, isopropanol, 2-butanol a terc-butanol. Jsou použity dvě implementace, přímá a nepřímá metoda. Přímá metoda se vyhýbá tvorbě stabilních meziproduktů, obvykle za použití kyselých katalyzátorů. Při nepřímé metodě se alken převádí na sulfátový ester, který se následně hydrolyzuje. Přímý hydratace použitím ethylen (hydratace ethylenu )[26] nebo jiné alkeny z praskání frakcí destilovaného ropa.
Hydratace se také průmyslově používá k výrobě diolu ethylenglykol z ethylenoxid.
Biologické cesty
Ethanol se získá kvašení použitím glukóza vyrobené z cukru z hydrolýza z škrob za přítomnosti kvasinek a teploty nižší než 37 ° C za vzniku ethanolu. Například takový proces může pokračovat převodem sacharóza enzymem invertáza na glukózu a fruktóza, pak přeměna glukózy komplexem enzymů zymase na ethanol a oxid uhličitý.
Několik druhů benigních bakterií ve střevě používá kvašení jako forma anaerobní metabolismus. Tento metabolické reakce produkuje ethanol jako odpadní produkt. Lidské tělo tedy obsahuje určité množství alkoholu endogenně produkovaného těmito bakteriemi. Ve výjimečných případech to může stačit ksyndrom auto-pivovaru „ve kterém se vyrábí omamné množství alkoholu.[27][28][29]
Jako ethanol, butanol lze vyrobit fermentačními procesy. Je známo, že kvasinky Saccharomyces produkují tyto vyšší alkoholy při teplotách nad 24 ° C. Bakterie Clostridium acetobutylicum může se živit celulóza vyrábět butanol v průmyslovém měřítku.[30]
Střídání
Hlavní alkylhalogenidy reagovat s vodným NaOH nebo KOH hlavně na primární alkoholy v nukleofilní alifatická substituce. (Sekundární a zejména terciární alkylhalogenidy místo toho poskytnou produkt eliminace (alken)). Grignardova činidla reagovat s karbonyl skupiny na sekundární a terciární alkoholy. Související reakce jsou Barbierova reakce a Nozaki-Hiyamova reakce.
Snížení
Aldehydy nebo ketony jsou snížena s borohydrid sodný nebo lithiumaluminiumhydrid (po kyselém zpracování). Další redukcí aluminiumisopropyláty je Redukce Meerwein-Ponndorf-Verley. Noyoriho asymetrická hydrogenace je asymetrická redukce β-ketoesterů.
Hydrolýza
Alkenes zapojit se do katalyzované kyseliny hydratační reakce za použití koncentrované kyseliny sírové jako katalyzátoru, který poskytuje obvykle sekundární nebo terciární alkoholy. The hydroborace-oxidace a redukce oxidace kyslíkem alkenů je spolehlivější v organické syntéze. Alkeny reagují s NBS a vodou reakce tvorby halohydrinu. Miny lze převést na diazoniové soli, které se poté hydrolyzují.
Ukazuje se tvorba sekundárního alkoholu redukcí a hydratací:
Reakce
Deprotonace
S pKA kolem 16–19 let jsou obecně o něco slabší kyseliny než voda. Se silnými základy, jako je hydrid sodný nebo sodík tvoří se soli volala alkoxidy, s obecným vzorcem R Ó− M+.
- 2 R-OH + 2 NaH → 2 R-O−Na+ + 2 H2
- 2 R-OH + 2 Na → 2 R-O−Na+ + H2
Kyselost alkoholů je silně ovlivněna solvatace. V plynné fázi jsou alkoholy kyselější než ve vodě.[31]
Nukleofilní substituce
Skupina OH není dobrá opouštějící skupina v nukleofilní substituce neutrální alkoholy při těchto reakcích nereagují. Pokud je však kyslík nejprve protonován za vzniku R-OH2+odcházející skupina (voda ) je mnohem stabilnější a může dojít k nukleofilní substituci. Například terciární alkoholy reagují s kyselina chlorovodíková vyrábět terciární alkylhalogenidy, Kde hydroxylová skupina se nahrazuje a chlór atom od unimolekulární nukleofilní substituce. Pokud mají reagovat primární nebo sekundární alkoholy kyselina chlorovodíková, aktivátor, jako je chlorid zinečnatý je potřeba. Alternativně lze převod provést přímo pomocí thionylchlorid.[1]

Alkoholy mohou být rovněž převedeny na alkylbromidy za použití kyselina bromovodíková nebo bromid fosforitý, například:
- 3 R-OH + PBr3 → 3 RBr + H3PO3
V Barton-McCombieho odkysličení alkohol je deoxygenován na alkanu s tributylcín hydrid nebo a trimethylboran -vodní komplex v a radikální substituce reakce.
Dehydratace
Atom kyslíku zatím má osamělé páry nevázaných elektronů, které ji slabě vykreslují základní v přítomnosti silných kyselin, jako je kyselina sírová. Například s methanolem:
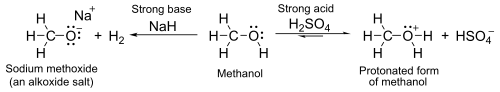
Po ošetření silnými kyselinami procházejí alkoholy E1 eliminační reakce k výrobě alkeny. Reakce se obecně řídí Zaitsevovo pravidlo, kde se uvádí, že se tvoří nejstabilnější (obvykle nejvíce substituovaný) alken. Terciární alkoholy se snadno vylučují těsně nad pokojovou teplotou, ale primární alkoholy vyžadují vyšší teplotu.
Toto je diagram kyselinou katalyzované dehydratace ethanolu na produkci ethylen:

Řízenější eliminační reakce vyžaduje vytvoření xanthátový ester.
Protonolýza
Terciární alkoholy reagují se silnými kyselinami za vzniku karbokationtů. Reakce souvisí s jejich dehydratací, např. isobutylen z terc-butylalkoholu. Zahrnuje speciální druh dehydratační reakce trifenylmetanol a zejména jeho aminem substituované deriváty. Při reakci s kyselinou tyto alkoholy ztrácejí vodu za vzniku stabilních karbokationtů, což jsou komerční barviva.[32]

Esterifikace
Alkohol a karboxylové kyseliny reagovat tzv Fischerova esterifikace. Reakce obvykle vyžaduje a katalyzátor, jako je koncentrovaná kyselina sírová:
- R-OH + R'-CO2H → R'-CO2R + H2Ó
Podobným způsobem se připravují i jiné typy esterů - například tosyl (tosylátové) estery se připravují reakcí alkoholu s p-toluensulfonyl chlorid v pyridinu.
Oxidace
Primární alkoholy (R-CH2OH) lze oxidovat buď na aldehydy (R-CHO) nebo do karboxylové kyseliny (R-CO.)2H). Oxidace sekundárních alkoholů (R.1R2CH-OH) obvykle končí na keton (R.1R2C = O) fáze. Terciární alkoholy (R.1R2R3C-OH) jsou odolné vůči oxidaci.
Přímý oxidace primárních alkoholů na karboxylové kyseliny normálně probíhá přes odpovídající aldehyd, který je transformován přes aldehydhydrát (R-CH (OH)2) reakcí s vodou, než může být dále oxidován na karboxylovou kyselinu.
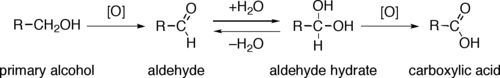
Reagencie užitečné pro transformaci primárních alkoholů na aldehydy jsou obvykle také vhodné pro oxidace sekundárních alkoholů na ketony. Tyto zahrnují Collinsovo činidlo a Dess-Martinův periodinan. Přímou oxidaci primárních alkoholů na karboxylové kyseliny lze provádět za použití manganistan draselný nebo Jonesovo činidlo.
Viz také
Poznámky
- ^ „alkoholy“. Zlatá kniha IUPAC. Citováno 16. prosince 2013.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “Alkoholy ". doi:10.1351 / goldbook.A00204
- ^ Dhawendra Kumar (11. května 2012). Genomika a zdraví v rozvojovém světě. Oxford University Press. p. 1128. ISBN 9780199705474.
- ^ Al-Hassani, Salim; Abattouy, Mohammed. „Příchod vědecké chemie“. Muslimské dědictví. Citováno 17. května 2018.
- ^ Curzon, George Nathaniel (7. července 2010). „Historie alkoholu v islámu“. Coming Anarchy. Citováno 17. května 2018.
- ^ Forbes, R. J. (1970). Krátká historie umění destilace. Vydavatelé Brill. p. 87. ISBN 978-9004006171.
- ^ Multhauf, Robert (1966). Počátky chemie. Londýn. 204–6.
- ^ Hill, Donald Routledge (1993). Islámská věda a inženýrství. Edinburgh University Press. ISBN 9780748604555.
- ^ Modanlou, H. D. (2008). „Pocta Zakariya Razi (865 - 925 nl), íránskému průkopníkovi“. Archivy íránské medicíny. PubMed. 11 (6): 673–7. PMID 18976043.
- ^ „Destilace - od doby bronzové po dnešek“.
- ^ Harper, Douglas. "Alkohol". Etymonline. MaoningTech. Citováno 17. května 2018.
- ^ Lohninger, H. (21. prosince 2004). „Etymologie slova“ Alkohol"". Encyklopedie VIAS. Citováno 17. května 2018.
- ^ A b „alkohol, n.“. OED online. Oxford University Press. 15. listopadu 2016.
- ^ Johnson, William (1652). Lexikon Chymicum.
- ^ Armstrong, Henry E. (8. července 1892). „Příspěvky do mezinárodního systému nomenklatury. Nomenklatura cykloidů“. Proc. Chem. Soc. 8 (114): 128. doi:10.1039 / PL8920800127.
Protože ol indikuje derivát OH, nezdá se žádný důvod, proč by jednoduché slovo kyselina nemělo znamenat karboxyl a proč al by nemělo znamenat COH; názvy ethanol ethanal a kyselina ethanová nebo jednoduše kyselina etanová by pak znamenaly pro OH, COH a COOH deriváty etanu.
- ^ A b William Reusch. „Alkoholy“. VirtualText z organické chemie. Archivovány od originál dne 19. září 2007. Citováno 14. září 2007.
- ^ Organická chemie Nomenklatura IUPAC. Alkoholy Pravidlo C-201.
- ^ Pravidlo C-203: Názvosloví organické chemie: Fenoly
- ^ „Jak pojmenovat organické sloučeniny podle pravidel IUPAC“. www.chem.uiuc.edu. ODDĚLENÍ CHEMIE NA UNIVERZITĚ ILLINOIS. Citováno 14. listopadu 2016.
- ^ Reusch, William. „Nomenklatura alkoholů“. chemwiki.ucdavis.edu/. Citováno 17. března 2015.
- ^ „Globální zpráva o stavu alkoholu 2004“ (PDF). Citováno 28. listopadu 2010.
- ^ A b C d E Falbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter. „Alkoholy, alifatické“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a01_279..
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM (30. září 2009). „Námořník se slepotou a zmatkem“. BMJ. 339: b3929. doi:10.1136 / bmj.b3929. PMID 19793790. S2CID 6367081.
- ^ Zimmerman HE, Burkhart KK, Donovan JW (1999). „Otrava ethylenglykolem a metanolem: diagnostika a léčba“. Journal of Emergency Nursing. 25 (2): 116–20. doi:10.1016 / S0099-1767 (99) 70156-X. PMID 10097201.
- ^ Lobert S (2000). "Otrava ethanolem, isopropanolem, methanolem a ethylenglykolem". Sestra pro kritickou péči. 20 (6): 41–7. doi:10,4037 / ccn2000.20.6.41. PMID 11878258.
- ^ Lodgsdon J.E. (1994). „Ethanol“. V Kroschwitzu J.I. (vyd.). Encyclopedia of Chemical Technology. 9 (4. vydání). New York: John Wiley & Sons. p. 820. ISBN 978-0-471-52677-3.
- ^ P. Geertinger MD; J. Bodenhoff; K. Helweg-Larsen; A. Lund (1. září 1982). "Endogenní produkce alkoholu střevní fermentací při náhlé smrti dítěte". Zeitschrift für Rechtsmedizin. Springer-Verlag. 89 (3): 167–172. doi:10.1007 / BF01873798. PMID 6760604. S2CID 29917601.
- ^ Logan BK, Jones AW (červenec 2000). „Endogenní„ auto-pivovarnický syndrom “ethanolu jako obranná výzva řízení pod vlivem alkoholu“. Medicína, věda a právo. 40 (3): 206–15. doi:10.1177/002580240004000304. PMID 10976182. S2CID 6926029.
- ^ Cecil Adams (20. října 2006). „Určený opilý: Dokážete se opít, aniž byste skutečně pili alkohol?“. Straight Dope. Citováno 27. února 2013.
- ^ Zverlov, W; Berezina, O; Velikodvorskaya, GA; Schwarz, WH (srpen 2006). „Bakteriální výroba acetonu a butanolu průmyslovou fermentací v Sovětském svazu: využití hydrolyzovaného zemědělského odpadu pro biorafinérii“. Aplikovaná mikrobiologie a biotechnologie. 71 (5): 587–97. doi:10.1007 / s00253-006-0445-z. PMID 16685494. S2CID 24074264.
- ^ Smith, Michael B .; March, Jerry (2007), Pokročilá organická chemie: reakce, mechanismy a struktura (6. vydání), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Gessner, Thomas; Mayer, Udo (2000). "Triarylmethan a diarylmethanová barviva". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a27_179.
Reference
- Metcalf, Allan A. (1999). Svět tolika slovy. Houghton Mifflin. ISBN 0-395-95920-9.
externí odkazy
- Alkohol (ethanol) na Periodická tabulka videí (University of Nottingham)



