Bromaceton - Bromoacetone
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC 1-Brompropan-2-on | |
| Ostatní jména Bromaceton 1-Brom-2-propanon α-bromaceton Acetonylbromid Acetylmethylbromid Brommethylmethylketon Monobromaceton Martonite BA UN 1569 | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.009.027 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3H5BrÓ | |
| Molární hmotnost | 136.976 g · mol−1 |
| Vzhled | Bezbarvá kapalina |
| Hustota | 1,634 g / cm3 |
| Bod tání | -36,5 ° C (-33,7 ° F; 236,7 K) |
| Bod varu | 137 ° C (279 ° F; 410 K) |
| Tlak páry | 1,1 kPa (20 ° C) |
| Nebezpečí | |
| Bezpečnostní list | Bezpečnostní listy v MOP |
| Bod vzplanutí | 51,1 ° C (124,0 ° F; 324,2 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
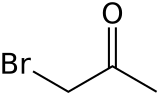
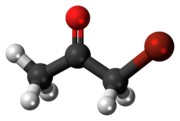
Bromaceton je organická sloučenina s vzorec CH3CÓ CH2Br. Tato bezbarvá kapalina je a slzotvorný prostředek a předchůdce jiného organické sloučeniny.
Výskyt V přírodě
Bromaceton je přirozeně přítomen (méně než 1%) v esenciální olej a Mořská řasa (Asparagopsis taxiformis ) z okolí Havajské ostrovy.[2]
Syntéza
Bromaceton je komerčně dostupný, někdy stabilizovaný pomocí oxid hořečnatý. Poprvé to bylo popsáno v 19. století a připisováno N. Sokolowskému.[3]

Bromaceton se připravuje kombinací bróm a aceton,[4] s katalytickou kyselinou. Stejně jako u všech ketonů, acetonu enolizuje v přítomnosti kyselin nebo zásad. Alfa uhlík pak prochází elektrofilní substituce s bromem. Hlavním problémem této metody je nadměrná bromace, která vede k di- a tribrominovaným produktům. Pokud je přítomna základna, bromoform místo toho získává haloformová reakce.[5]
Aplikace
Bylo použito v první světová válka jako chemická zbraň, volala BA Brity a B-Stoff (Weisskreuz ) Němci. Vzhledem ke své toxicitě se již nepoužívá jako prostředek k potlačení nepokojů. Bromaceton je univerzální činidlo v organická syntéza. Je to například předchůdce hydroxyaceton reakcí s vodným hydroxidem sodným.[6]
Viz také
Reference
- ^ Index společnosti Merck, 11. vydání, 1389
- ^ Burreson, B. J .; Moore, R.E .; Roller, P. P. (1976). „Těkavé halogenové sloučeniny v řase Asparagopsis taxiformis (Rhodophyta) ". Journal of Agricultural and Food Chemistry. 24 (4): 856–861. doi:10.1021 / jf60206a040.
- ^ Wagner, G. (1876). „Sitzung der russischen chemischen Gesellschaft am 7./19. October 1876“. Berichte der Deutschen Chemischen Gesellschaft. 9 (2): 1687–1688. doi:10.1002 / cber.187600902196.
- ^ Levene, P. A. (1930). "Bromaceton". Organické syntézy. 10: 12.; Kolektivní objem, 2, str. 88
- ^ Reusch, W. (05.05.2013). „Karbonylová reaktivita“. Virtuální učebnice organické chemie. Michiganská státní univerzita. Archivovány od originál dne 21.06.2010. Citováno 2007-10-27.
- ^ Levene, P. A .; Walti, A. (1930). "Acetol". Organické syntézy. 10: 1.; Kolektivní objem, 2, str. 5
