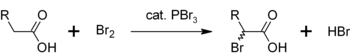Tribromid fosforitý - Phosphorus tribromide - Wikipedia
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Tribromid fosforitý | |
| Ostatní jména bromid fosforitý, bromid fosforitý, tribromfosfin | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.253 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| PBr3 | |
| Molární hmotnost | 270,69 g / mol |
| Vzhled | čirá, bezbarvá kapalina |
| Hustota | 2,852 g / cm3 |
| Bod tání | -41,5 ° C (-42,7 ° F; 231,7 K) |
| Bod varu | 173,2 ° C (343,8 ° F; 446,3 K) |
| rychlý hydrolýza | |
Index lomu (nD) | 1.697 |
| Viskozita | 0,001302 Pas |
| Struktura | |
| trigonální pyramidální | |
| Nebezpečí | |
| Bezpečnostní list | Vidět: datová stránka |
Klasifikace EU (DSD) (zastaralý) | |
| R-věty (zastaralý) | R14, R34, R37 |
| S-věty (zastaralý) | (S1 / 2), S26, S45 |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | fluorid fosforitý chlorid fosforitý jodid fosforitý |
jiný kationty | bromid dusíku bromid arsenitý bromid antimonitý |
Související sloučeniny | pentabromid fosforečný fosforoxybromid |
| Stránka s doplňkovými údaji | |
| Index lomu (n), Dielektrická konstanta (εr), atd. | |
Termodynamické data | Fázové chování pevná látka - kapalina - plyn |
| UV, IR, NMR, SLEČNA | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tribromid fosforitý je bezbarvá kapalina se vzorcem PBr3. Kapalina výpary ve vlhkém vzduchu kvůli hydrolýza a má pronikavý zápach. Používá se v laboratoři pro konverzi alkoholy na alkylbromidy.
Příprava
PBr3 se připravuje zpracováním červený fosfor s bróm. Používá se přebytek fosforu, aby se zabránilo tvorbě PBr5:[1][2]
- 2 P + 3 Br2 → 2 PBr3
Protože reakce je vysoce exotermická, často se provádí v přítomnosti ředidla, jako je PBr3.
Reakce
Podobně jako tribromid fosforitý PCl3 a PF3, má obě vlastnosti a Lewisova základna a a Lewisova kyselina. Například s Lewisovou kyselinou, jako je bromid boritý tvoří stabilní adukty 1: 1, jako je Br3B · PBr3. Současně PBr3 může reagovat jako elektrofil nebo Lewisova kyselina v mnoha jejích reakcích, například s aminy.
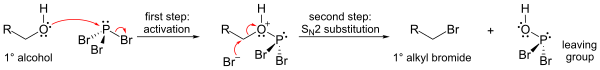
Nejdůležitější reakce PBr3 je s alkoholy, kde nahrazuje ACH skupina s atomem bromu za vzniku alkylbromid. Mohou být přeneseny všechny tři bromidy.
- PBr3 + 3 ROH → 3 RBr + HP (O) (OH)2
Mechanismus (zobrazený pro primární alkohol) zahrnuje tvorbu esteru fosforu (za vzniku dobře odstupující skupiny), následovaný SN2 střídání.
Kvůli S.N2 substituční krok, reakce obecně funguje dobře primární a sekundární alkoholy, ale pro terciární alkoholy selže. Pokud je centrum reagujícího uhlíku chirální, reakce obvykle nastává s inverze konfigurace na alkoholu alfa uhlík, jak je u S obvykléN2 reakce.
Při podobné reakci PBr3 také převádí karboxylové kyseliny na acylbromidy.
- PBr3 + 3 RCOOH → 3 RCOBr + HP (O) (OH)2
Aplikace
Hlavní použití pro bromid fosforitý je pro konverzi primární nebo sekundární alkoholy na alkylbromidy,[3] jak je popsáno výše. PBr3 obvykle poskytuje vyšší výnosy než kyselina bromovodíková a vyhýbá se problémům s karbokace přeskupení - například rovnoměrné neopentyl bromid může být vyroben z alkoholu v 60% výtěžku.[4]
Další použití pro PBr3 je jako katalyzátor pro a-bromaci karboxylové kyseliny. Ačkoli se acylbromidy ve srovnání s acylchloridy, používají se jako meziprodukty v Hell-Volhard-Zelinsky halogenace.[5]Zpočátku PBr3 reaguje s karboxylovou kyselinou za vzniku acylbromidu, který je reaktivnější vůči bromaci. Celkový proces lze vyjádřit jako
V komerčním měřítku se bromid fosforitý používá při výrobě léčiva jako alprazolam, methohexital a fenoprofen. Je to také silný hasicí prostředek pod názvem PhostrEx.
Opatření
PBr3 uvolňuje žíravé HBr, je toxický a prudce reaguje s vodou a alkoholy.
- PBr3 + 3 H2O → H3PO3 + 3 HBr
V reakcích, které produkují kyselina fosforitá jako vedlejší produkt, při zpracování destilací, mějte na paměti, že se může rozložit na asi 160 ° C fosfin které mohou při kontaktu se vzduchem způsobit výbuch.[3]
Reference
- ^ J. F. Gay, R. N. Maxson "Phosphorus (III) Bromide" Anorganic Syntheses, 1947, sv. 2, 147 a násl. doi:10.1002 / 9780470132333.ch43
- ^ Burton, T. M .; Degerping, E. F. (1940). "Příprava acetylbromidu". Journal of the American Chemical Society. 62 (1): 227. doi:10.1021 / ja01858a502.
- ^ A b Harrison, G. C .; Diehl, H. (1955). „β-ethoxyethylbromid“. Organické syntézy.; Kolektivní objem, 3, str. 370
- ^ Wade, L. G. Jr. (2005). Organická chemie (6. vydání). Upper Saddle River, NJ, USA: Pearson / Prentice Hall. p. 477.
- ^ Wade, L. G. Jr. (2005). Organická chemie (6. vydání). Upper Saddle River, NJ, USA: Pearson / Prentice Hall. p. 1051.
Další čtení
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Lide, D. R., ed. (1990). Příručka chemie a fyziky (71. vydání). Ann Arbor, MI: CRC Press. ISBN 978-0849304712.
- March, J. (1992). Pokročilá organická chemie (4. vydání). New York: Wiley. p.723. ISBN 978-0471601807.
- Stecher, P. G., ed. (1960). Index společnosti Merck (7. vydání). Rahway, NJ, USA: Merck & Co.
- Holmes, R. R. (1960). „Zkoumání základní povahy trihalogenidů fosforu, arsenu a antimonu“. Journal of Anorganic and Nuclear Chemistry. 12 (3–4): 266–275. doi:10.1016/0022-1902(60)80372-7.