Amidin - Amidine
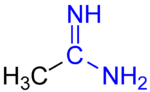
Amidiny jsou organické sloučeniny s funkční skupinou RC (NR) NR2, kde R skupiny mohou být stejné nebo různé. Jsou iminovými deriváty amidů (RC (O) NR2). Nejjednodušší amidin je formamidin, HC (= NH) NH2.
Mezi příklady amidinů patří:
Příprava
Běžnou cestou k primárním amidinům je Pinnerova reakce. Reakcí nitrilu s alkoholem v přítomnosti kyseliny se získá iminoether. Zpracováním výsledné sloučeniny amoniakem se potom dokončí přeměna na amidin.[1] Namísto použití Bronstedovy kyseliny podporují Lewisovy kyseliny, jako je chlorid hlinitý, přímou aminaci nitrilů.[2] Jsou také generovány aminací imidoylchlorid.[3]Rovněž se připravují přidáním organolithných činidel k diiminům a následnou protonací nebo alkylací.
Dimethylformamidacetal reaguje s primárními aminy za vzniku amidinů:[4]
- Mě2NC (H) (OMe)2 + RNH2 → Já2NC (O) NHR + 2 MeOH
Vlastnosti a aplikace
Amidiny jsou mnohem bazičtější než amidy a patří mezi nejsilnější nenabité / odborové organizace[5] základny.[6]
Protonace nastává u sp2 hybridizovaný dusík. K tomu dochází, protože kladný náboj lze delokalizovat na oba atomy dusíku. Výsledný kationtový druh je znám jako amidinium ion[7] a má identické délky vazeb C-N.

Několik léků nebo kandidátů na léky obsahuje amidinové substituenty. Mezi příklady patří antiprotozoální látky Imidocarb, insekticid amitraz , antihelmintikum tribendimidin, a xylamidin, antagonista na 5HT2A receptoru.[8]
Formamidinium (viz níže) může reagovat s halogenidem kovu za vzniku absorpce světla polovodičový materiál v perovskitové solární články. Kationty nebo halogenidy formamidinia (FA) mohou částečně nebo úplně nahradit Methylamoniumhalogenidy při vytváření vrstev absorbujících perovskit ve fotovoltaických zařízeních.
Nomenklatura
Formálně jsou amindiny třídou oxokyseliny. Oxokyselina, ze které je amidin odvozen, musí být ve formě R.nE (= O) OH, kde R je a substituent. The -OH skupina se nahrazuje znakem - NH2 skupina a = O. skupina je nahrazena =NR, poskytující amidiny obecnou strukturu RnE (= NR) NR2.[9][10][11] Pokud je mateřskou oxokyselinou a karboxylová kyselina, výsledný amidin je a karboxamidin nebo karboximidamid (IUPAC název). Karboxamidiny jsou často označovány jednoduše jako amidiny, protože jsou nejčastěji se vyskytujícím typem amidinu organická chemie.
Deriváty
Formamidiniové kationty

Pozoruhodná podtřída amidiniových iontů je formamidinium kationty; což lze vyjádřit chemickým vzorcem [R.
2N-CH = NR
2+
. Deprotonace z toho dává stabilní karbeny což lze vyjádřit chemickým vzorcem R
2N − C: −NR
2.[12][13]
Amidinátové soli

Amidinátová sůl má obecnou strukturu M.+[RNRCNR]− a lze k nim přistupovat reakcí a karbodiimid s organokovovou sloučeninou, jako je methyl lithium.[15] Používají se široce jako ligandy v organokovových komplexech.
Viz také
- Guanidiny - podobná skupina sloučenin, kde je centrální uhlík vázán na tři dusíky.
- Imidazoliny obsahují cyklický amidin.
Reference
- ^ A. W. Dox (1928). "Acetamidin hydrochlorid". Organické syntézy. 8: 1. doi:10.15227 / orgsyn.008.0001.
- ^ "N-Fenylbenzamidin ". Organické syntézy. 36: 64. 1956. doi:10.15227 / orgsyn.036.0064.
- ^ Arthur C. Hontz, E. C. Wagner (1951). „N, N-difenylbenzamidin“. Organické syntézy. 31: 48. doi:10.15227 / orgsyn.031.0048.
- ^ Daniel A. Dickman; Michael Boes; Albert I. Meyers (1989). „(S) -N, N-dimethyl-N '- (l-terc-butoxy-3-methyl-2-butyl) formamidin". Organické syntézy. 67: 52. doi:10.15227 / orgsyn.067.0052.
- ^ Roche VF. Zlepšení porozumění studentům farmacie a dlouhodobé uchování acidobazické chemie. American Journal of Pharmaceutical Education. 2007; 71 (6): 122.
- ^ Clayden; Greeves; Warren (2001). Organická chemie. Oxfordský univerzitní tisk. str.202. ISBN 978-0-19-850346-0.
- ^ Schrader, Thomas; Hamilton, Andrew D., eds. (2005). Funkční syntetické receptory. Wiley-VCH. str. 132. ISBN 3-527-30655-2.
- ^ Greenhill, John V .; Lue, Ping (1993). 5 Amidiny a guanidiny v medicinální chemii. Pokrok v medicinální chemii. 30. 203–326. doi:10.1016 / S0079-6468 (08) 70378-3. ISBN 9780444899897. PMID 7905649.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “amidiny ". doi:10.1351 / goldbook.A00267
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “karboxamidiny ". doi:10.1351 / goldbook.C00851
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “sulfinamidiny ". doi:10.1351 / goldbook.S06107
- ^ Olše, Roger W .; Blake, Michael E .; Bufali, Simone; Butts, Craig P .; Orpen, A. Guy; Schütz, Jan; Williams, Stuart J. (2001). "Příprava tetraalkylformamidiniových solí a příbuzných druhů jako prekurzorů stabilních karbenů". Journal of the Chemical Society, Perkin Transactions 1 (14): 1586–1593. doi:10.1039 / B104110J.
- ^ Edward C. Taylor; Wendell A. Ehrhart; M. Kawanisi (1966). "Formamidin acetát". Organické syntézy. 46: 39. doi:10.15227 / orgsyn.046.0039.
- ^ Keaton, Richard J .; Jayaratne, Kumudini C .; Henningsen, David A .; Koterwas, Lisa A .; Sita, Lawrence R. (2001). „Dramatické posílení aktivit pro živé polymerace Ziegler-Natta zprostředkované„ exponovanými “iniciátory zirkoniumacetamidinátu: Isospecifická živá polymerizace vinylcyklohexanu“. Journal of the American Chemical Society. 123 (25): 6197–6198. doi:10.1021 / ja0057326. PMID 11414862.
- ^ Ulrich, Henri (2007). Chemie a technologie karbodiimidů. Chichester, Anglie: John Wiley & Sons. ISBN 9780470065105.
