Chemická sloučenina - Chemical compound

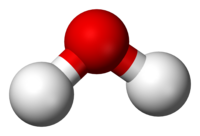
A chemická sloučenina je chemická látka složený z mnoha identických molekuly (nebo molekulární entity ) složen z atomy od více než jednoho živel drží pohromadě chemické vazby. A molekula skládající se z atomů pouze jednoho prvku proto není sloučenina.
Existují čtyři typy sloučenin, v závislosti na tom, jak jsou jednotlivé atomy drženy pohromadě:
- molekuly drží pohromadě kovalentní vazby
- iontové sloučeniny drží pohromadě iontové vazby
- intermetalické sloučeniny drží pohromadě kovové vazby
- určitý komplexy drží pohromadě koordinovat kovalentní vazby.
A chemický vzorec určuje počet atomů každého prvku v molekule sloučeniny pomocí standardních zkratek pro chemické prvky a číselných dolní indexy. Například a voda molekula má vzorec H2O označující dva vodík atomy vázané k jednomu kyslík atom. Mnoho chemikálie sloučeniny mají jedinečný Číslo CAS identifikátor přidělený Služba Chemical Abstracts. Celosvětově bylo pro výrobu a použití registrováno více než 350 000 chemických sloučenin (včetně směsí chemikálií).[1]
Sloučeninu lze převést na jinou chemickou látku interakcí s druhou látkou pomocí a chemická reakce. V tomto procesu mohou být vazby mezi atomy přerušeny v jedné nebo v obou interagujících látkách a mohou vznikat nové vazby.
Definice
Jakákoli látka skládající se ze dvou nebo více různých druhů atomy (chemické prvky ) pevně stechiometrický poměr lze nazvat a chemická sloučenina; koncept je nejsnadněji pochopitelný, když se vezme v úvahu čistý chemické substance.[2]:15 [3][4] Z jejich složení ze stálých podílů dvou nebo více typů atomů vyplývá, že lze chemické sloučeniny převádět pomocí chemická reakce, na sloučeniny nebo látky, z nichž každá má méně atomů.[5] Poměr každého prvku ve sloučenině je vyjádřen v poměru v jeho chemickém vzorci.[6] A chemický vzorec je způsob vyjádření informací o podílech atomů, které tvoří konkrétní chemickou sloučeninu, za použití standardních zkratek pro chemické prvky, a dolní indexy k označení počtu zúčastněných atomů. Například, voda se skládá ze dvou atomy vodíku spojený s jedním kyslík atom: chemický vzorec je H2O. V případě nestechiometrické sloučeniny, proporce mohou být reprodukovatelné s ohledem na jejich přípravu a dávat fixní proporce jejich dílčích prvků, ale proporce, které nejsou integrální [např. pro hydrid palladnatý, PdHX (0,02
Chemické sloučeniny mají jedinečné a definované chemická struktura drží pohromadě v definovaném prostorovém uspořádání pomocí chemické vazby. Chemické sloučeniny mohou být molekulární sloučeniny držené pohromadě kovalentní vazby, soli drží pohromadě iontové vazby, intermetalické sloučeniny drží pohromadě kovové vazby nebo podmnožina chemické komplexy které drží pohromadě koordinovat kovalentní vazby.[8] Čistý chemické prvky nejsou obecně považovány za chemické sloučeniny, pokud nesplňují požadavek na dva nebo více atomů, i když se často skládají z molekul složených z více atomů (například v rozsivková molekula H2, nebo polyatomová molekula S8, atd.).[8] Mnoho chemikálie sloučeniny mají jedinečný číselný identifikátor přiřazený Služba Chemical Abstracts (CAS): jeho Číslo CAS.
Mezi chemickými sloučeninami, které vyžadují pevné poměry, existují různé a někdy nekonzistentní látky odlišující nomenklaturu, které zahrnují skutečně nestechiometrické příklady. Mnoho pevných chemických látek - například mnoho silikátové minerály —Jsou to chemické látky, ale nemají jednoduché vzorce, které odrážejí chemickou vazbu prvků k sobě ve stanovených poměrech; i tak tyto krystalický látky se často nazývají „nestechiometrické sloučeniny "Je možné tvrdit, že spíše než s chemickými sloučeninami souvisejí, protože variabilita jejich složení je často způsobena buď přítomností cizích prvků zachycených v krystalové struktuře jinak známé pravda chemická sloučenina, nebo v důsledku narušení struktury ve srovnání se známou sloučeninou, ke kterému dochází v důsledku přebytku deficitu základních prvků na místech v její struktuře; takové nestechiometrické látky tvoří většinu kůra a plášť ze země. Jiné sloučeniny považované za chemicky identické mohou mít různá množství těžkého nebo lehkého izotopy prvků, což mírně mění hmotnostní poměr prvků.
Typy
Molekuly
Molekula je elektricky neutrální skupina dvou nebo více atomů držených pohromadě chemickými vazbami.[9][10][11][12][13] Molekula může být homonukleární, to znamená, že se skládá z atomů jednoho chemického prvku, stejně jako se dvěma atomy v kyslík molekula (O.2); nebo může být heteronukleární, chemická sloučenina složená z více než jednoho prvku, jako u voda (dva atomy vodíku a jeden atom kyslíku; H2Ó).
Iontové sloučeniny
Iontová sloučenina je chemická sloučenina složená z ionty drží pohromadě elektrostatické síly nazval iontová vazba. Sloučenina je celkově neutrální, ale skládá se z pozitivně nabitých iontů nazývaných kationty a záporně nabité ionty anionty. Ty mohou být jednoduché ionty tak jako sodík (Na+) a chlorid (Cl−) v chlorid sodný nebo polyatomické druhy jako amonný (NH+
4) a uhličitan (CO2−
3) ionty v uhličitan amonný. Jednotlivé ionty v iontové sloučenině mají obvykle několik nejbližších sousedů, takže se nepovažují za součást molekul, ale za součást spojité trojrozměrné sítě, obvykle v krystalická struktura.
Iontové sloučeniny obsahující bazické ionty hydroxid (ACH−) nebo kysličník (Ó2−) jsou klasifikovány jako báze. Iontové sloučeniny bez těchto iontů jsou také známé jako soli a mohou být vytvořeny acidobazické reakce. Iontové sloučeniny lze také vyrobit z jejich základních iontů pomocí vypařování Jejich solventní, srážky, zmrazení, a reakce v pevné fázi, nebo elektronový přenos reakce reaktivní kovy s reaktivními nekovy, jako např halogen plyny.
Iontové sloučeniny mají obvykle vysokou hladinu tání a body varu, a jsou tvrdý a křehký. Jako pevné látky jsou téměř vždy elektricky izolační, ale když roztavený nebo rozpuštěn stávají se vysoce vodivý, protože ionty jsou mobilizovány.
Intermetalické sloučeniny
Intermetalická sloučenina je typ kovový slitina která tvoří uspořádanou sloučeninu v pevné fázi mezi dvěma nebo více kovovými prvky. Intermetalika je obecně tvrdá a křehká s dobrými vysokoteplotními mechanickými vlastnostmi.[14][15][16] Mohou být klasifikovány jako stechiometrické nebo nestechiometické intermetalické sloučeniny.[14]
Komplexy
Koordinační komplex se skládá z centrálního atomu nebo iontu, kterým obvykle je kovový a nazývá se koordinační centruma okolní pole vázaných molekul nebo iontů, které jsou zase známé jako ligandy nebo komplexotvorné látky.[17][18][19] Mnoho sloučenin obsahujících kovy, zejména sloučeniny z přechodné kovy, jsou koordinační komplexy.[20] Koordinační komplex, jehož středem je atom kovu, se nazývá kovový komplex prvku d bloku.
Lepení a síly
Sloučeniny jsou drženy pohromadě prostřednictvím různých typů vazeb a sil. Rozdíly v typech vazeb ve sloučeninách se liší podle typů prvků přítomných ve sloučenině.
Londýnské disperzní síly jsou nejslabší silou ze všech mezimolekulární síly. Jsou to dočasné atraktivní síly, které se tvoří, když elektrony ve dvou sousedních atomech jsou umístěny tak, že vytvářejí dočasný dipól. Kromě toho jsou za kondenzaci zodpovědné rozptylové síly v Londýně nepolární látky do kapalin a dále zmrazovat do pevného stavu v závislosti na tom, jak nízká je teplota prostředí.[21]
A kovalentní vazba, známý také jako molekulární vazba, zahrnuje sdílení elektronů mezi dvěma atomy. Primárně k tomuto typu vazby dochází mezi prvky, které na sebe padají blízko sebe periodická tabulka prvků, přesto je to pozorováno mezi některými kovy a nekovy. To je způsobeno mechanismem tohoto typu vazby. Prvky, které na periodické tabulce padají blízko sebe, mají tendenci mít podobné elektronegativity, což znamená, že mají podobnou afinitu k elektronům. Protože žádný z prvků nemá silnější afinitu k darování nebo získávání elektronů, způsobuje to, že prvky sdílejí elektrony, takže oba prvky mají stabilnější oktet.
Iontové vazby nastane, když valenční elektrony jsou zcela přeneseny mezi prvky. Na rozdíl od kovalentní vazby vytváří tato chemická vazba dva opačně nabité ionty. Kovy v iontové vazbě obvykle ztrácejí své valenční elektrony a stávají se kladně nabitými kation. Nekov získá kovy z kovu, čímž se nekov stane záporně nabitým anion. Jak je uvedeno, iontové vazby se vyskytují mezi donorem elektronů, obvykle kovem, a akceptorem elektronů, který má tendenci být nekovový.[22]
Vodíková vazba nastane, když a atom vodíku navázaný na elektronegativní atom tvoří elektrostatický spojení s jiným elektronegativním atomem prostřednictvím interakčních dipólů nebo nábojů.[23][24][25][26]
Reakce
Sloučeninu lze převést na jiné chemické složení interakcí s druhou chemickou sloučeninou pomocí a chemická reakce. V tomto procesu jsou vazby mezi atomy přerušeny v obou interagujících sloučeninách a potom jsou vazby reformovány tak, že mezi atomy vznikají nové asociace. Tuto reakci lze schematicky popsat jako AB + CD → AD + CB, kde A, B, C a D jsou každý jedinečný atom; a AB, AD, CD a CB jsou každá jedinečná sloučenina.
Viz také
Reference
- ^ Wang, Zhanyun; Walker, Glen W .; Muir, Derek C. G .; Nagatani-Yoshida, Kakuko (2020-01-22). „Směrem ke globálnímu porozumění chemickému znečištění: první komplexní analýza národních a regionálních chemických zásob“. Věda o životním prostředí a technologie. 54 (5): 2575–2584. doi:10.1021 / acs.est.9b06379. PMID 31968937.
- ^ Whitten, Kenneth W .; Davis, Raymond E .; Peck, M. Larry (2000), Obecná chemie (6. vydání), Fort Worth, TX: Saunders College Publishing / Harcourt College Publishers, ISBN 978-0-03-072373-5
- ^ Brown, Theodore L .; LeMay, H. Eugene; Bursten, Bruce E .; Murphy, Catherine J .; Woodward, Patrick (2013), Chemistry: The Central Science (3. vyd.), Frenchs Forest, NSW: Pearson / Prentice Hall, str. 5–6, ISBN 9781442559462
- ^ Hill, John W .; Petrucci, Ralph H .; McCreary, Terry W .; Perry, Scott S. (2005), Obecná chemie (4. vydání), Upper Saddle River, NJ: Pearson / Prentice Hall, str. 6, ISBN 978-0-13-140283-6, archivováno od původního dne 2009-03-22
- ^ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemie (1. vyd.), Upper Saddle River, NJ: Pearson / Prentice Hall, str.36, ISBN 978-0-13-251210-7
- ^ "Chemická sloučenina". ScienceDaily. Archivováno od originálu dne 2017-09-13. Citováno 2017-09-13.
- ^ Manchester, F. D .; San-Martin, A .; Pitre, J. M. (1994). "Systém H-Pd (vodík-palladium)". Journal of Phase Equilibria. 15: 62–83. doi:10.1007 / BF02667685. Fázový diagram pro systém Palladium-vodík
- ^ A b Atkins, Peter; Jones, Loretta (2004). Chemical Principles: The Quest for Insight. W.H. Freemane. ISBN 978-0-7167-5701-6.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “Molekula ". doi:10.1351 / zlatá kniha.M04002
- ^ Ebbin, Darrell D. (1990). Obecná chemie (3. vyd.). Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- ^ Brown, T.L .; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemie - ústřední věda (9. vydání). New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- ^ Chang, Raymond (1998). Chemie (6. vydání). New York: McGraw Hill. ISBN 978-0-07-115221-1.
- ^ Zumdahl, Steven S. (1997). Chemie (4. vydání). Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- ^ A b Askeland, Donald R .; Wright, Wendelin J. "11-2 Intermetalické sloučeniny". Věda a inženýrství materiálů (Sedmé vydání). Boston, MA. 387–389. ISBN 978-1-305-07676-1. OCLC 903959750.
- ^ Panel pro vývoj intermetalické slitiny, komise pro technické a technické systémy (1997). Vývoj intermetalické slitiny: hodnocení programu. Národní akademie Press. p. 10. ISBN 0-309-52438-5. OCLC 906692179.
- ^ Soboyejo, W. O. (2003). „1.4.3 Intermetallics“. Mechanické vlastnosti konstrukčních materiálů. Marcel Dekker. ISBN 0-8247-8900-8. OCLC 300921090.
- ^ Lawrance, Geoffrey A. (2010). Úvod do koordinační chemie. Wiley. doi:10.1002/9780470687123. ISBN 9780470687123.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “komplex ". doi:10.1351 / goldbook.C01203
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “koordinační entita ". doi:10.1351 / goldbook.C01330
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ „London Dispersion Forces“. www.chem.purdue.edu. Archivováno od originálu dne 2017-01-13. Citováno 2017-09-13.
- ^ „Iontové a kovalentní dluhopisy“. Chemistry LibreTexts. 2013-10-02. Archivováno od originálu dne 2017-09-13. Citováno 2017-09-13.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “vodíková vazba ". doi:10.1351 / zlatá kniha.H02899
- ^ "Vodíkové vazby". chemistry.elmhurst.edu. Archivováno od originálu 2016-11-19. Citováno 2017-10-28.
- ^ "Vazba vodíku". www.chem.purdue.edu. Archivováno z původního dne 08.08.2011. Citováno 2017-10-28.
- ^ "intermolekulární vazba - vodíkové vazby". www.chemguide.co.uk. Archivováno od originálu 2016-12-19. Citováno 2017-10-28.
Další čtení
- Robert Siegfried (2002), Od prvků k atomům: historie chemického složení, Americká filozofická společnost, ISBN 978-0-87169-924-4
