Lipidová dvojvrstva - Lipid bilayer


The lipidová dvojvrstva (nebo fosfolipidová dvojvrstva) je tenký polární membrána ze dvou vrstev lipid molekuly. Tyto membrány jsou ploché listy, které tvoří souvislou bariéru kolem všech buňky. The buněčné membrány téměř všech organismy a mnoho viry jsou vyrobeny z lipidové dvojvrstvy, stejně jako jaderná membrána obklopující buněčné jádro, a membrány z membránově vázané organely v cele. Lipidová dvojvrstva je bariéra, která udržuje ionty, bílkoviny a další molekuly tam, kde jsou potřeba, a brání jim v difúzi do oblastí, kde by neměly být. Lipidové dvojvrstvy se k této roli ideálně hodí, i když jich je jen několik nanometry na šířku,[1] protože jsou nepropustné pro většinu rozpustných ve vodě (hydrofilní ) molekuly. Dvojvrstvy jsou zvláště nepropustné pro ionty, což umožňuje buňkám regulovat koncentrace solí a pH transportem iontů přes jejich membrány pomocí tzv. proteinů iontová čerpadla.
Biologické dvojvrstvy se obvykle skládají z amfifilní fosfolipidy které mají hydrofilní fosfátovou hlavu a hydrofobní ocas skládající se ze dvou řetězců mastných kyselin. Fosfolipidy s určitými hlavovými skupinami mohou měnit povrchovou chemii dvojvrstvy a mohou například sloužit jako signály i jako „kotvy“ pro další molekuly v membránách buněk.[2] Stejně jako hlavy mohou i ocasy lipidů ovlivnit vlastnosti membrány, například stanovením fáze dvojvrstvy. Dvojvrstva může přijmout pevnou látku gel fázový stav při nižších teplotách, ale podstoupit fázový přechod do a tekutý stav při vyšších teplotách a chemické vlastnosti ocasů lipidů ovlivňují, při jaké teplotě k tomu dojde. Balení lipidů uvnitř dvojvrstvy také ovlivňuje její mechanické vlastnosti, včetně odolnosti proti roztahování a ohýbání. Mnoho z těchto vlastností bylo studováno pomocí umělých „modelových“ dvojvrstev vyráběných v laboratoři. Vezikuly vyrobené modelovými dvojvrstvy byly také klinicky použity k dodání léků.
Biologické membrány typicky zahrnují několik typů molekul jiných než fosfolipidy. Obzvláště důležitým příkladem ve zvířecích buňkách je cholesterol, což pomáhá posílit dvojvrstvu a snížit její propustnost. Cholesterol také pomáhá regulovat aktivitu určitých látek integrální membránové proteiny. Integrované membránové proteiny fungují, když jsou začleněny do lipidové dvojvrstvy, a jsou pevně přidržovány k lipidové dvojvrstvě pomocí prstencová lipidová skořápka. Protože dvojvrstvy definují hranice buňky a jejích oddílů, jsou tyto membránové proteiny zapojeny do mnoha intra- a mezibuněčných signálních procesů. Některé druhy membránových proteinů se účastní procesu fúze dvou dvojvrstev dohromady. Tato fúze umožňuje spojení dvou odlišných struktur jako v akrozomová reakce v době oplodnění z vejce podle a spermie, nebo záznam a virus do buňky. Protože lipidové dvojvrstvy jsou v tradičním mikroskopu křehké a neviditelné, jsou výzvou ke studiu. Experimenty na dvojvrstvách často vyžadují pokročilé techniky jako elektronová mikroskopie a mikroskopie atomové síly.
Struktura a organizace
Když jsou fosfolipidy vystaveny vodě, jsou samo-sestavit do dvouvrstvého listu s hydrofobními ocasy směřujícími ke středu listu. Výsledkem tohoto uspořádání jsou dva „letáky“, z nichž každý je jednou molekulární vrstvou. Střed této dvojvrstvy neobsahuje téměř žádnou vodu a vylučuje podobné molekuly cukry nebo soli, které se rozpouštějí ve vodě. Proces montáže je řízen interakcemi mezi hydrofobními molekulami (také nazývanými hydrofobní účinek ). Zvýšení interakcí mezi hydrofobními molekulami (způsobující shlukování hydrofobních oblastí) umožňuje molekulám vody, aby se navzájem volněji vázaly, což zvyšuje entropii systému. Tento složitý proces zahrnuje nekovalentní interakce jako van der Waalsovy síly, elektrostatický a Vodíkové vazby.
Průřezová analýza

Lipidová dvojvrstva je ve srovnání se svými bočními rozměry velmi tenká. Pokud byla typická savčí buňka (průměr ~ 10 mikrometrů) zvětšena na velikost melounu (~ 1 ft / 30 cm), lipidová dvojvrstva tvořící plazmatická membrána bude asi tak silný jako kousek kancelářského papíru. Přestože je dvojvrstva tlustá jen několik nanometrů, skládá se v průřezu z několika odlišných chemických oblastí. Tyto oblasti a jejich interakce s okolní vodou byly v posledních několika desetiletích charakterizovány pomocí rentgenová reflektometrie,[4] rozptyl neutronů[5] a nukleární magnetická rezonance techniky.
První oblastí na obou stranách dvojvrstvy je hydrofilní hlavní skupina. Tato část membrány je zcela hydratovaná a má obvykle tloušťku přibližně 0,8 - 0,9 nm. v fosfolipid dvojvrstvy fosfát Skupina se nachází v této hydratované oblasti, přibližně 0,5 nm mimo hydrofobní jádro.[6] V některých případech se hydratovaná oblast může rozšířit mnohem dále, například v lipidech s velkým proteinem nebo dlouhým řetězcem cukru naroubovaným do hlavy. Jedním běžným příkladem takové úpravy v přírodě je lipopolysacharid plášť na bakteriální vnější membráně,[7] který pomáhá zadržovat vodní vrstvu kolem bakterie aby se zabránilo dehydrataci.

Vedle hydratované oblasti je mezilehlá oblast, která je hydratována pouze částečně. Tato mezní vrstva má tloušťku přibližně 0,3 nm. Na této krátké vzdálenosti koncentrace vody klesne z 2M na straně hlavní skupiny na téměř nulovou na straně ocasu (jádra).[8][9] Hydrofobní jádro dvojvrstvy má obvykle tloušťku 3–4 nm, ale tato hodnota se mění podle délky řetězce a chemie.[4][10] Tloušťka jádra se také významně mění s teplotou, zejména v blízkosti fázového přechodu.[11]
Asymetrie
U mnoha přirozeně se vyskytujících dvojvrstev je složení letáků vnitřní a vnější membrány odlišné. V člověku červené krvinky, vnitřní (cytoplazmatický) leták se skládá převážně z fosfatidylethanolamin, fosfatidylserin a fosfatidylinositol a jeho fosforylované deriváty. Naproti tomu vnější (extracelulární) leták je založen na fosfatidylcholin, sfingomyelin a různé glykolipidy.[12][13] V některých případech je tato asymetrie založena na tom, kde jsou lipidy vytvářeny v buňce, a odráží jejich počáteční orientaci.[14] Biologické funkce lipidové asymetrie jsou nedokonale pochopeny, i když je zřejmé, že se používá v několika různých situacích. Například když buňka prochází apoptóza, fosfatidylserin - normálně lokalizovaný v cytoplazmatickém letáku - se přenáší na vnější povrch: Tam je rozpoznán makrofág který pak aktivně uklízí umírající buňku.
Asymetrie lipidů vzniká, alespoň z části, ze skutečnosti, že většina fosfolipidů je syntetizována a zpočátku vložena do vnitřní monovrstvy: ty, které tvoří vnější monovrstvu, jsou poté transportovány z vnitřní monovrstvy třídou enzymů nazývaných flippázy.[15][16] Další lipidy, jako je sfingomyelin, se zdají být syntetizovány na vnějším letáku. Flippázy jsou členy větší rodiny lipidových transportních molekul, která zahrnuje také floppázy, které přenášejí lipidy v opačném směru, a scramblasy, které náhodně rozdělují lipidy mezi lipidové dvojvrstvy (jako v apoptotických buňkách). V každém případě, jakmile je stanovena lipidová asymetrie, obvykle se nerozptýlí rychle, protože spontánní klopný pohyb lipidů mezi letáky je extrémně pomalý.[17]
Tuto asymetrii je možné napodobit v laboratoři na modelových dvouvrstvých systémech. Některé typy velmi malých umělých váček se automaticky vytvoří mírně asymetrické, i když mechanismus, kterým je tato asymetrie generována, se velmi liší od mechanismu v buňkách.[18] Využitím dvou různých jednovrstev v Langmuir-Blodgett depozice[19] nebo kombinace Langmuir-Blodgett a depozice ruptury vezikul[20] je také možné syntetizovat asymetrickou rovinnou dvojvrstvu. Tato asymetrie může být v průběhu času ztracena, protože lipidy v podporovaných dvojvrstevách mohou být náchylné k převrácení.[21]
Fáze a fázové přechody

Při dané teplotě může lipidová dvojvrstva existovat buď v kapalné nebo gelové (pevné) fázi. Všechny lipidy mají charakteristickou teplotu, při které přecházejí (tají) z gelu do kapalné fáze. V obou fázích je zabráněno lipidovým molekulám v klopení přes dvojvrstvu, ale u dvojvrstev v kapalné fázi si daný lipid vymění místa se sousedem milionkrát za sekundu. Tento náhodná procházka výměna umožňuje lipidům šířit a tak bloudit po povrchu membrány.[22] Na rozdíl od dvojvrstev v kapalné fázi mají lipidy v dvojvrstvě gelové fáze menší pohyblivost.
Fázové chování lipidových dvojvrstev je do značné míry určeno silou atraktivního Van der Waals interakce mezi sousedními lipidovými molekulami. Lipidy s dlouhým ocasem mají větší plochu, na které mohou interagovat, což zvyšuje sílu této interakce a v důsledku toho snižuje mobilitu lipidů. Takže při dané teplotě bude lipid s krátkým ocasem tekutější než jinak identický lipid s dlouhým ocasem.[10] Teplota přechodu může být také ovlivněna stupeň nenasycení lipidových ocasů. Nenasycený dvojná vazba může způsobit zlom v alkanu řetěz, což narušuje lipidový obal. Toto narušení vytváří uvnitř dvojvrstvy další volný prostor, který umožňuje další flexibilitu v sousedních řetězcích.[10] Příklad tohoto účinku lze v každodenním životě zaznamenat, protože máslo, které má velké procento nasycených tuků, je pevné při pokojové teplotě, zatímco rostlinný olej, který je většinou nenasycený, je tekutý.
Většina přírodních membrán je složitá směs různých lipidových molekul. Pokud jsou některé ze složek při dané teplotě kapalné, zatímco jiné jsou v gelové fázi, mohou tyto dvě fáze koexistovat v prostorově oddělených oblastech, spíše jako ledovec plovoucí v oceánu. Tato fázová separace hraje v biochemických jevech zásadní roli, protože membránové komponenty, jako jsou proteiny, se mohou rozdělit do jedné nebo druhé fáze[23] a tak být lokálně koncentrované nebo aktivované. Jednou z obzvláště důležitých součástí mnoha systémů se smíšenou fází je cholesterol, který moduluje propustnost dvouvrstvy, mechanickou pevnost a biochemické interakce.
Povrchová chemie
Zatímco lipidové ocasy primárně modulují chování dvouvrstvé fáze, je to hlavní skupina, která určuje chemii povrchu dvouvrstvy. Většina přírodních dvojvrstev se skládá převážně z fosfolipidy, ale sfingolipidy a steroly jako cholesterol jsou také důležité součásti.[24] Z fosfolipidů je nejběžnější hlavní skupina fosfatidylcholin (PC), což představuje přibližně polovinu fosfolipidů ve většině savčích buněk.[25] PC je zwitterionický hlavní skupina, protože má záporný náboj na fosfátové skupině a kladný náboj na aminu, ale protože tyto místní náboje jsou v rovnováze, žádný čistý náboj.
V různé míře jsou také přítomny další čelní skupiny, které mohou zahrnovat fosfatidylserin (PS) fosfatidylethanolamin (PE) a fosfatidylglycerol (PG). Tyto alternativní hlavní skupiny často udělují specifickou biologickou funkčnost, která je vysoce závislá na kontextu. Například přítomnost PS na obličeji extracelulární membrány erytrocyty je marker buňky apoptóza,[26] zatímco PS v růstová deska vezikuly jsou nezbytné pro nukleace z hydroxyapatit krystaly a následná mineralizace kostí.[27][28] Na rozdíl od PC nese některé z dalších hlavních skupin síťový náboj, který může změnit elektrostatické interakce malých molekul s dvojvrstvou.[29]
Biologické role
Zadržení a oddělení
Primární úlohou lipidové dvojvrstvy v biologii je oddělení vodný oddělení z jejich okolí. Bez nějaké formy bariéry vymezující „já“ od „ne-já“ je těžké dokonce definovat pojem organismus nebo život. Tato bariéra má formu lipidové dvojvrstvy ve všech známých formách života s výjimkou několika druhů archaea které využívají speciálně upravenou lipidovou monovrstvu.[7] Dokonce bylo navrženo, že úplně první forma života mohla být jednoduchá lipidový váček s prakticky jeho jediným biosyntetický schopnost být výrobou více fosfolipidy.[30] Rozdělovací schopnost lipidové dvojvrstvy je založena na skutečnosti, že hydrofilní molekuly nemohou snadno přejít hydrofobní dvouvrstvé jádro, jak je uvedeno v části Transport přes dvojvrstvu níže. Jádro, mitochondrie a chloroplasty mají dvě lipidové dvojvrstvy, zatímco jiné subcelulární struktury jsou obklopeny jedinou lipidovou dvojvrstvou (jako je plazmatická membrána, endoplazmatická síťka, Golgiho aparát a lysozomy). Vidět Organelle.[31]
Prokaryotes mít pouze jednu lipidovou dvojvrstvu - buněčná membrána (také známý jako plazmatická membrána). Mnoho prokaryot má také a buněčná stěna, ale buněčná stěna se skládá z bílkoviny nebo dlouhý řetěz sacharidy, ne lipidy. V porovnání, eukaryoty mít řadu organely včetně jádro, mitochondrie, lysozomy a endoplazmatické retikulum. Všechny tyto subcelulární oddíly jsou obklopeny jednou nebo více lipidovými dvojvrstvy a společně typicky tvoří většinu dvouvrstvé oblasti přítomné v buňce. V játrech hepatocyty například plazmatická membrána tvoří pouze dvě procenta z celkové dvouvrstvé oblasti buňky, zatímco endoplazmatické retikulum obsahuje více než padesát procent a mitochondrie dalších třicet procent.[32]

Signalizace
Pravděpodobně nejznámější forma buněčné signalizace je synaptický přenos, přičemž nervový impuls, který dosáhl konce jednoho neuron je přenášen do sousedního neuronu uvolněním neurotransmitery. Tento přenos je možný působením synaptické vezikuly nabité neurotransmitery, které mají být uvolněny. Tyto vezikuly pojistka s buněčnou membránou na presynaptickém konci a uvolnit její obsah ven z buňky. Obsah pak difunduje přes synapse k postsynaptickému terminálu.
Lipidové dvojvrstvy se také podílejí na přenosu signálu prostřednictvím své role domova integrální membránové proteiny. Jedná se o extrémně širokou a důležitou třídu biomolekul. Odhaduje se, že až třetina člověka proteom jsou membránové proteiny.[33] Některé z těchto proteinů jsou spojeny s vnějškem buněčné membrány. Příkladem toho je CD59 protein, který identifikuje buňky jako „vlastní“ a tím inhibuje jejich zničení imunitním systémem. The HIV virus se vyhýbá imunitní systém částečně roubováním těchto proteinů z hostitelské membrány na svůj vlastní povrch.[32] Alternativně některé membránové proteiny pronikají celou cestou přes dvojvrstvu a slouží k přenosu jednotlivých signálních událostí z vnějšku dovnitř buňky. Nejběžnější třídou tohoto typu bílkovin je Receptor spojený s G proteinem (GPCR). GPCR jsou zodpovědné za velkou část schopnosti buňky vnímat své okolí a kvůli této důležité roli je přibližně 40% všech moderních léků zaměřeno na GPCR.[34]
Kromě procesů zprostředkovaných proteiny a roztoky je také možné, aby se lipidové dvojvrstvy přímo účastnily signalizace. Klasickým příkladem toho je fosfatidylserin - spuštěno fagocytóza. Normálně je fosfatidylserin asymetricky distribuován v buněčné membráně a je přítomen pouze na vnitřní straně. Během programované buněčné smrti protein nazývaný a scramblase ekvilibruje tuto distribuci a zobrazuje fosfatidylserin na extracelulární dvojvrstvé ploše. Přítomnost fosfatidylserinu poté spouští fagocytózu k odstranění mrtvé nebo umírající buňky.
Charakterizační metody

Lipidová dvojvrstva je velmi obtížně studovatelná struktura, protože je tak tenká a křehká. I přes tato omezení byly za posledních sedmdesát let vyvinuty desítky technik, které umožňují zkoumání jeho struktury a funkce.
Elektrická měření
Elektrická měření jsou přímým způsobem, jak charakterizovat důležitou funkci dvojvrstvy: její schopnost oddělit se a zabránit toku iontů v roztoku. Aplikováním napětí na dvojvrstvu a měřením výsledného proudu se odpor dvojvrstvy je stanovena. Tato odolnost je obvykle poměrně vysoká (108 Ohm-cm2 nebo více) [35] protože hydrofobní jádro je nepropustné pro nabité druhy. Přítomnost dokonce několika otvorů v měřítku nanometrů vede k dramatickému nárůstu proudu.[36] Citlivost tohoto systému je taková, že dokonce i aktivita jednotlivce iontové kanály lze vyřešit.[37]
Fluorescenční mikroskopie

Elektrická měření neposkytují skutečný obraz, jako je zobrazení mikroskopem. Lipidové dvojvrstvy nelze v tradičním mikroskopu vidět, protože jsou příliš tenké. Aby vědci viděli dvojvrstvy, často používají fluorescenční mikroskopie. Vzorek je excitován jednou vlnovou délkou světla a pozorován na jiné vlnové délce, takže budou vidět pouze fluorescenční molekuly se shodným excitačním a emisním profilem. Přírodní lipidové dvojvrstvy nejsou fluorescenční, proto se používá barvivo, které se váže na požadované molekuly ve dvojvrstvě. Rozlišení je obvykle omezeno na několik stovek nanometrů, mnohem menší než typická buňka, ale mnohem větší než tloušťka lipidové dvojvrstvy.
Elektronová mikroskopie
Elektronová mikroskopie nabízí obrázek s vyšším rozlišením. V elektronový mikroskop paprsek zaostření elektrony interaguje spíše se vzorkem než se světelným paprskem jako v tradiční mikroskopii. Ve spojení s technikami rychlého zmrazení se elektronová mikroskopie také používá ke studiu mechanismů inter- a intracelulárního transportu, například k prokázání, že exocytotický vezikuly jsou prostředky pro chemické uvolňování při synapse.[38]
Spektroskopie nukleární magnetické rezonance
31P-NMR (nukleární magnetická rezonance) spektroskopie je široce používán pro studium fosfolipidových dvojvrstev a biologických membrán v nativních podmínkách. Analýza[39] z 31P-NMR spektra lipidů by mohla poskytnout širokou škálu informací o balení lipidové dvojvrstvy, fázových přechodech (gelová fáze, fyziologická fáze tekutých krystalů, fáze zvlnění, nevrstvé fáze), orientace / dynamika skupin lipidových hlav a elastické vlastnosti čistého lipidu dvojvrstvy a v důsledku vazby proteinů a dalších biomolekul.
Mikroskopie atomové síly

Nová metoda ke studiu lipidových dvojvrstev je Mikroskopie atomové síly (AFM). Spíše než použití paprsku světla nebo částic, velmi malý naostřený hrot skenuje povrch fyzickým kontaktem s dvojvrstvou a pohybuje se po ní, jako jehla gramofonu. AFM je slibná technika, protože má potenciál zobrazovat s nanometrovým rozlišením při pokojové teplotě a dokonce i pod vodou nebo fyziologickým pufrem, což jsou podmínky nezbytné pro přirozené chování dvojvrstvy. S využitím této schopnosti se AFM používá ke zkoumání dynamického chování dvouvrstev, včetně tvorby transmembránových pórů (děr)[40] a fázové přechody v podporovaných dvojvrstvách.[41] Další výhodou je, že AFM nevyžaduje fluorescenční nebo izotopový značení lipidů, protože hrot sondy interaguje mechanicky s dvojvrstvým povrchem. Z tohoto důvodu může stejný sken zobrazovat lipidy i související proteiny, někdy dokonce s rozlišením jedné molekuly.[40][42] AFM může také zkoumat mechanickou povahu lipidových dvojvrstev.[43]
Duální polarizační interferometrie
Lipidové dvojvrstvy vykazují vysokou hladinu dvojlom kde index lomu v rovině dvojvrstvy se liší od indexu lomu až o 0,1 index lomu Jednotky. To bylo použito k charakterizaci stupně řádu a narušení použití dvojvrstev duální polarizační interferometrie porozumět mechanismům interakce bílkovin.
Kvantově chemické výpočty
Lipidové dvojvrstvy jsou komplikované molekulární systémy s mnoha stupni volnosti. Tedy atomistická simulace membrány a zejména ab initio výpočty jeho vlastností jsou obtížné a výpočetně nákladné. Kvantově chemické výpočty byly nedávno úspěšně provedeny pro odhad dipól a kvadrupól momenty lipidových membrán.[44]
Transport přes dvojvrstvu
Pasivní difúze
Většina polární molekuly mají nízkou rozpustnost v uhlovodík jádro lipidové dvojvrstvy a v důsledku toho mají nízké koeficienty propustnosti napříč dvojvrstvou. Tento účinek je zvláště výrazný u nabitých druhů, které mají ještě nižší koeficienty propustnosti než neutrální polární molekuly.[45] Anionty obvykle mají vyšší rychlost difúze přes dvojvrstvy než kationty.[46][47] Ve srovnání s ionty mají molekuly vody ve skutečnosti relativně velkou propustnost přes dvojvrstvu, o čemž svědčí osmotický otok. Když se buňka nebo vezikul s vysokou vnitřní koncentrací soli umístí do roztoku s nízkou koncentrací soli, nabobtná a nakonec praskne. Takový výsledek by nebyl pozorován, pokud by voda nemohla relativně snadno projít dvojvrstvou. Anomálně velká propustnost vody přes dvojvrstvy stále není zcela objasněna a nadále je předmětem aktivní debaty.[48] Malé nenabité nepolární molekuly difundují přes lipidové dvojvrstvy mnohem řádově rychleji než ionty nebo voda. To platí jak pro tuky, tak pro organická rozpouštědla chloroform a éter. Bez ohledu na jejich polární charakter difundují větší molekuly pomaleji přes lipidové dvojvrstvy než malé molekuly.[49]

Ionové pumpy a kanály
S iontovými přechody nalezenými v buněčných a subcelulárních membránách v přírodě se zabývají dvě speciální třídy bílkovin - iontové kanály a iontová čerpadla. Čerpadla i kanály jsou integrální membránové proteiny které procházejí dvojvrstvou, ale jejich role jsou zcela odlišné. Ionové pumpy jsou proteiny, které vytvářejí a udržují chemické přechody využitím externího zdroje energie k pohybu iontů proti koncentračnímu gradientu do oblasti vyšší chemický potenciál. Zdroj energie může být ATP, jako je tomu v případě Na+-K+ ATPáza. Alternativně může být zdrojem energie jiný chemický gradient, který je již na místě, jako v Ca.2+/ Na+ antiporter. Buňky jsou schopné regulovat působením iontových pump pH přes čerpání protonů.
Na rozdíl od iontových čerpadel iontové kanály nevytvářejí chemické přechody, ale spíše je rozptylují, aby mohly vykonávat práci nebo vysílat signál. Pravděpodobně nejznámějším a nejlépe studovaným příkladem je napěťově řízený Na+ kanál, který umožňuje vedení akční potenciál podél neurony. Všechny iontové pumpy mají nějaký druh spouštěcího nebo „hradlového“ mechanismu. V předchozím příkladu to bylo elektrické zkreslení, ale jiné kanály lze aktivovat navázáním molekulárního agonisty nebo prostřednictvím konformační změny v jiném blízkém proteinu.[50]

Endocytóza a exocytóza
Některé molekuly nebo částice jsou příliš velké nebo příliš hydrofilní, aby prošly lipidovou dvojvrstvou. Další molekuly by mohly projít dvojvrstvou, ale musí být transportovány rychle v tak velkém počtu, že transport typu kanálu je nepraktický. V obou případech mohou být tyto typy nákladu přesunuty přes buněčnou membránu fúze nebo nadějně vezikuly. Když se vezikul produkuje uvnitř buňky a fúzuje s plazmatickou membránou, aby uvolnil svůj obsah do extracelulárního prostoru, je tento proces známý jako exocytóza. V opačném procesu se oblast buněčné membrány prohloubí dovnitř a nakonec se odštípne a uzavře část extracelulární tekutiny, aby ji transportovala do buňky. Endocytóza a exocytóza spoléhají na fungování velmi odlišného molekulárního aparátu, ale oba procesy jsou úzce propojeny a nemohou bez sebe fungovat. Primárním mechanismem této vzájemné závislosti je velké množství lipidového materiálu.[51] V typické buňce bude oblast dvouvrstvy ekvivalentní celé plazmatické membráně procházet cyklem endocytózy / exocytózy asi za půl hodiny.[52] Pokud by se tyto dva procesy navzájem nevyvažovaly, buňka by se buď nafoukla ven na nezvládnutelnou velikost, nebo by během krátké doby úplně vyčerpala svou plazmatickou membránu.

Exocytóza u prokaryot: Membránová vezikulární exocytóza, populárně známý jako obchodování s membránovými váčky, proces nositel Nobelovy ceny (rok 2013), je tradičně považován za výsadu eukaryotický buňky.[53] Tento mýtus byl však rozbit s odhalením, že nanovesicles, populárně známý jako vezikuly bakteriální vnější membrány, vydané gramnegativní mikroby, translokují bakteriální signální molekuly do hostitelských nebo cílových buněk[54] provádět více procesů ve prospěch vylučujícího mikrobu, např invaze hostitelských buněk[55] a interakce mikrobů a prostředí obecně.[56]
Elektroporace
Elektroporace je rychlé zvýšení propustnosti dvouvrstvy vyvolané aplikací velkého umělého elektrického pole přes membránu. Experimentálně se elektroporace používá k zavedení hydrofilních molekul do buněk. Je to obzvláště užitečná technika pro velké vysoce nabité molekuly, jako jsou DNA, který by nikdy pasivně nedifundoval přes hydrofobní dvouvrstvé jádro.[57] Z tohoto důvodu je elektroporace jednou z klíčových metod transfekce stejně jako bakteriální proměna. Bylo dokonce navrženo, že elektroporace je výsledkem Blesk stávky mohou být přirozeným mechanismem horizontální přenos genů.[58]
Toto zvýšení propustnosti primárně ovlivňuje transport iontů a jiných hydratovaných druhů, což naznačuje, že mechanismem je vytvoření vodou naplněných otvorů v membráně v měřítku nm. Ačkoli elektroporace a dielektrický rozpad oba vyplývají z aplikace elektrického pole, zapojené mechanismy jsou zásadně odlišné. Při dielektrickém rozpadu je bariérový materiál ionizován a vytváří vodivou cestu. Materiální změna má tedy chemickou povahu. Naproti tomu během elektroporace lipidové molekuly nejsou chemicky měněny, ale jednoduše posouvají polohu, čímž otevírají póry, které působí jako vodivá cesta přes dvojvrstvu, protože je naplněna vodou.
Mechanika

Lipidové dvojvrstvy jsou dostatečně velké struktury, aby měly některé mechanické vlastnosti kapalin nebo pevných látek. Plošný modul komprese KA, modul ohybu Kba okrajová energie , lze je použít k jejich popisu. Pevné lipidové dvojvrstvy mají také a tažný modul, ale jako každá kapalina, modul smyku je pro dvojvrstvy kapaliny nulový. Tyto mechanické vlastnosti ovlivňují fungování membrány. K.A a K.b ovlivnit schopnost proteinů a malých molekul vložit se do dvojvrstvy,[59][60] a bylo prokázáno, že dvouvrstvé mechanické vlastnosti mění funkci mechanicky aktivovaných iontových kanálů.[61] Mechanické vlastnosti dvojvrstvy také určují, jaké typy napětí buňka vydrží bez roztržení. Přestože se lipidové dvojvrstvy mohou snadno ohýbat, většina se před protržením nedokáže natáhnout o více než několik procent.[62]
Jak je uvedeno v části Struktura a organizace, hydrofobní přitažlivost lipidových ocasů ve vodě je primární silou, která drží lipidové dvojvrstvy pohromadě. Modul pružnosti dvojvrstvy je tedy primárně určen tím, kolik další oblasti je vystaveno vodě, když jsou molekuly lipidů roztaženy od sebe.[63] Není překvapením, vzhledem k tomuto chápání zapojených sil, které studie ukázaly, že K.A se silně liší osmotický tlak[64] ale jen slabě s délkou ocasu a nenasyceností.[10] Protože zapojené síly jsou tak malé, je obtížné experimentálně určit K.A. Většina technik vyžaduje sofistikovanou mikroskopii a velmi citlivé měřicí zařízení.[43][65]
Na rozdíl od K.A, což je měřítko toho, kolik energie je potřeba k protažení dvojvrstvy, K.b je míra množství energie potřebné k ohnutí nebo ohnutí dvojvrstvy. Formálně je modul ohybu definován jako energie potřebná k deformaci membrány z jejího vnitřního zakřivení na jiné zakřivení. Vnitřní zakřivení je definováno poměrem průměru skupiny hlavy k průměru skupiny ocasu. U dvoustranných PC lipidů je tento poměr téměř jeden, takže vnitřní zakřivení je téměř nulové. Pokud má konkrétní lipid příliš velkou odchylku od nulového vnitřního zakřivení, nevytvoří dvojvrstvu a místo toho vytvoří další fáze, jako je micely nebo obrácené micely. Přidání malé hydrofilní molekuly jako sacharóza do smíšeného lipidu lamelární liposomy vyrobený z tylakoidních membrán bohatých na galaktolipidy destabilizuje dvojvrstvy micelární fáze.[66] Typicky K.b není měřena experimentálně, ale je počítána z měření KA a tloušťka dvouvrstvy, protože tyto tři parametry spolu souvisejí.
je míra toho, kolik energie je zapotřebí k vystavení okraje dvojvrstvy vodě roztržením dvojvrstvy nebo vytvořením díry v ní. Původem této energie je skutečnost, že vytvoření takového rozhraní vystavuje část lipidových ocasů vodě, ale přesná orientace těchto hraničních lipidů není známa. Existují určité důkazy, že mohou existovat jak hydrofobní (ocasy rovné), tak hydrofilní (hlavy zakřivené kolem) póry.[67]
Fúze

Fúze je proces, kterým se spojují dvě lipidové dvojvrstvy, což vede k jedné propojené struktuře. Pokud tato fúze proběhne úplně oběma letáky obou dvojvrstev, vytvoří se most naplněný vodou a roztoky obsažené v dvojvrstvách se mohou míchat. Alternativně, pokud je do procesu fúze zapojen pouze jeden leták z každé dvojvrstvy, jsou dvojvrstvy označeny jako hemifuzní. Fúze se účastní mnoha buněčných procesů, zejména v eukaryoty, protože eukaryotická buňka je značně rozdělena lipidovými dvouvrstvými membránami. Exocytóza, oplodnění z vejce podle aktivace spermií a přeprava odpadních produktů do lysozom je několik z mnoha eukaryotických procesů, které se spoléhají na nějakou formu fúze. Dokonce i vstup patogenů může být řízen fúzí, jak mnoho potaženo dvojvrstvou vrstvou viry mají vyhrazené fúzní proteiny pro získání vstupu do hostitelské buňky.
V procesu fúze existují čtyři základní kroky.[25] Nejprve se musí zúčastněné membrány agregovat a přibližovat se k sobě v rozmezí několika nanometrů. Zadruhé, dvě dvojvrstvy musí přijít do velmi těsného kontaktu (během několika angstromů). K dosažení tohoto těsného kontaktu musí být oba povrchy alespoň částečně dehydratovány, protože běžně přítomná vázaná povrchová voda způsobuje silné odpuzování dvojvrstev. Přítomnost iontů, zejména dvojmocných kationtů, jako je hořčík a vápník, silně ovlivňuje tento krok.[68][69] Jednou z kritických rolí vápníku v těle je regulace fúze membrány. Zatřetí, v jednom bodě mezi dvěma vrstvami musí vzniknout destabilizace, která lokálně narušuje jejich struktury. Přesná povaha tohoto zkreslení není známa. Jedna teorie spočívá v tom, že mezi dvěma vrstvami musí vzniknout vysoce zakřivená „stopka“.[70] Zastánci této teorie se domnívají, že vysvětluje, proč fosfatidylethanolamin, vysoce zakřivený lipid, podporuje fúzi.[71] Nakonec v posledním kroku fúze tento bodový defekt roste a složky dvou dvojvrstev se mísí a difundují pryč z místa kontaktu.
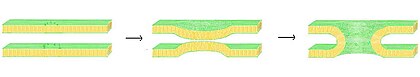

The situation is further complicated when considering fusion in vivo since biological fusion is almost always regulated by the action of membrane-associated proteins. The first of these proteins to be studied were the viral fusion proteins, which allow an enveloped virus to insert its genetic material into the host cell (enveloped viruses are those surrounded by a lipid bilayer; some others have only a protein coat). Eukaryotický cells also use fusion proteins, the best-studied of which are the SNAREs. SNARE proteins are used to direct all vezikulární intracellular trafficking. Despite years of study, much is still unknown about the function of this protein class. In fact, there is still an active debate regarding whether SNAREs are linked to early docking or participate later in the fusion process by facilitating hemifusion.[73]
In studies of molecular and cellular biology it is often desirable to artificially induce fusion. Přidání polyethylenglykol (PEG) causes fusion without significant aggregation or biochemical disruption. This procedure is now used extensively, for example by fusing B-buňky s myelom buňky.[74] The resulting “hybridom ” from this combination expresses a desired protilátka as determined by the B-cell involved, but is immortalized due to the melanoma component. Fusion can also be artificially induced through elektroporace in a process known as electrofusion. It is believed that this phenomenon results from the energetically active edges formed during electroporation, which can act as the local defect point to nucleate stalk growth between two bilayers.[75]
Model systems
Lipid bilayers can be created artificially in the lab to allow researchers to perform experiments that cannot be done with natural bilayers. They can also be used in the field of Syntetická biologie, to define the boundaries of artificial cells. These synthetic systems are called model lipid bilayers. There are many different types of model bilayers, each having experimental advantages and disadvantages. They can be made with either synthetic or natural lipids. Among the most common model systems are:
- Black lipid membranes (BLM)
- Supported lipid bilayers (SLB)
- Tethered Bilayer Lipid Membranes (t-BLM)
- Vezikuly
- Droplet Interface Bilayers (DIBs)
Komerční aplikace
To date, the most successful commercial application of lipid bilayers has been the use of liposomy for drug delivery, especially for cancer treatment. (Note- the term “liposome” is in essence synonymous with “váček ” except that vesicle is a general term for the structure whereas liposome refers to only artificial not natural vesicles) The basic idea of liposomal drug delivery is that the drug is encapsulated in solution inside the liposome then injected into the patient. These drug-loaded liposomes travel through the system until they bind at the target site and rupture, releasing the drug. In theory, liposomes should make an ideal drug delivery system since they can isolate nearly any hydrophilic drug, can be grafted with molecules to target specific tissues and can be relatively non-toxic since the body possesses biochemical pathways for degrading lipids.[76]
The first generation of drug delivery liposomes had a simple lipid composition and suffered from several limitations. Circulation in the bloodstream was extremely limited due to both renal clearing and fagocytóza. Refinement of the lipid composition to tune fluidity, surface charge density, and surface hydration resulted in vesicles that adsorb fewer proteins from sérum and thus are less readily recognized by the imunitní systém.[77] The most significant advance in this area was the grafting of polyethylenglykol (PEG) onto the liposome surface to produce “stealth” vesicles, which circulate over long times without immune or renal clearing.[78]
The first stealth liposomes were passively targeted at nádor papírové kapesníky. Because tumors induce rapid and uncontrolled angiogeneze they are especially “leaky” and allow liposomes to exit the bloodstream at a much higher rate than normal tissue would.[79] Poslední dobou[když? ] work has been undertaken to graft protilátky or other molecular markers onto the liposome surface in the hope of actively binding them to a specific cell or tissue type.[80] Some examples of this approach are already in clinical trials.[81]
Another potential application of lipid bilayers is the field of biosenzory. Since the lipid bilayer is the barrier between the interior and exterior of the cell, it is also the site of extensive signal transduction. Researchers over the years have tried to harness this potential to develop a bilayer-based device for clinical diagnosis or bioterrorism detection. Progress has been slow in this area and, although a few companies have developed automated lipid-based detection systems, they are still targeted at the research community. These include Biacore (now GE Healthcare Life Sciences), which offers a disposable chip for utilizing lipid bilayers in studies of binding kinetics[82] and Nanion Inc., which has developed an automated patch clamping Systém.[83] Other, more exotic applications are also being pursued such as the use of lipid bilayer membrane pores for Sekvenování DNA by Oxford Nanolabs. To date, this technology has not proven commercially viable.
A supported lipid bilayer (SLB) as described above has achieved commercial success as a screening technique to measure the permeability of drugs. Tento parallel Artificial membrane permeability Assay PAMPA technique measures the permeability across specifically formulated lipid cocktail(s) found to be highly correlated with Caco-2 kultury,[84][85] the gastrointestinální trakt,[86] hematoencefalická bariéra[87] and skin.[88]
Dějiny
By the early twentieth century scientists had come to believe that cells are surrounded by a thin oil-like barrier,[89] but the structural nature of this membrane was not known. Two experiments in 1925 laid the groundwork to fill in this gap. By measuring the kapacita z červená krvinka solutions, Hugo Fricke determined that the cell membrane was 3.3 nm thick.[90]
Although the results of this experiment were accurate, Fricke misinterpreted the data to mean that the cell membrane is a single molecular layer. Prof. Dr. Evert Gorter[91] (1881–1954) and F. Grendel of Leiden University approached the problem from a different perspective, spreading the erythrocyte lipids as a monolayer on a Langmuir-Blodgett trough. When they compared the area of the monolayer to the surface area of the cells, they found a ratio of two to one.[92] Later analyses showed several errors and incorrect assumptions with this experiment but, serendipitously, these errors canceled out and from this flawed data Gorter and Grendel drew the correct conclusion- that the cell membrane is a lipid bilayer.[25]
This theory was confirmed through the use of elektronová mikroskopie na konci 50. let. Although he did not publish the first electron microscopy study of lipid bilayers[93] J. David Robertson was the first to assert that the two dark electron-dense bands were the headgroups and associated proteins of two apposed lipid monolayers.[94][95] In this body of work, Robertson put forward the concept of the “unit membrane.” This was the first time the bilayer structure had been universally assigned to all cell membranes as well as organela membrány.
Around the same time, the development of model membranes confirmed that the lipid bilayer is a stable structure that can exist independent of proteins. By “painting” a solution of lipid in organic solvent across an aperture, Mueller and Rudin were able to create an artificial bilayer and determine that this exhibited lateral fluidity, high electrical resistance and self-healing in response to puncture,[96] all of which are properties of a natural cell membrane. O pár let později, Alec Bangham showed that bilayers, in the form of lipid vesicles, could also be formed simply by exposing a dried lipid sample to water.[97] This was an important advance, since it demonstrated that lipid bilayers form spontaneously via self assembly and do not require a patterned support structure.
In 1977, a totally synthetic bilayer membrane was prepared by Kunitake and Okahata, from a single organic compound, didodecyldimethylammonium bromide.[98] It clearly shows that the bilayer membrane was assembled by the van der Waalsova interakce.
Viz také
- Category: surfactants
- Membrane biophysics
- Lipid polymorphism
- Lipidomika
Reference
- ^ Andersen, Olaf S.; Koeppe, II, Roger E. (June 2007). "Bilayer Thickness and Membrane Protein Function: An Energetic Perspective". Roční přehled biofyziky a biomolekulární struktury. 36 (1): 107–130. doi:10.1146/annurev.biophys.36.040306.132643. PMID 17263662.
- ^ Divecha, Nullin; Irvine, Robin F (27 January 1995). "Phospholipid signaling". Buňka. 80 (2): 269–278. doi:10.1016/0092-8674(95)90409-3. PMID 7834746.
- ^ Mashaghi et al. Hydration strongly affects the molecular and electronic structure of membrane phospholipids. 136, 114709 (2012)"The Journal of Chemical Physics". Archivovány od originál dne 15. května 2016. Citováno 17. května 2012.
- ^ A b Lewis BA, Engelman DM (May 1983). "Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles". J. Mol. Biol. 166 (2): 211–7. doi:10.1016/S0022-2836(83)80007-2. PMID 6854644.
- ^ Zaccai G, Blasie JK, Schoenborn BP (January 1975). "Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes". Proc. Natl. Acad. Sci. USA. 72 (1): 376–380. Bibcode:1975PNAS...72..376Z. doi:10.1073/pnas.72.1.376. PMC 432308. PMID 16592215.
- ^ Nagle JF, Tristram-Nagle S (November 2000). "Structure of lipid bilayers". Biochim. Biophys. Acta. 1469 (3): 159–95. doi:10.1016/S0304-4157(00)00016-2. PMC 2747654. PMID 11063882.
- ^ A b Parker J, Madigan MT, Brock TD, Martinko JM (2003). Brock biology of microorganisms (10. vydání). Englewood Cliffs, N.J: Prentice Hall. ISBN 978-0-13-049147-3.
- ^ Marsh D (July 2001). "Polarity and permeation profiles in lipid membranes". Proc. Natl. Acad. Sci. USA. 98 (14): 7777–82. Bibcode:2001PNAS...98.7777M. doi:10.1073/pnas.131023798. PMC 35418. PMID 11438731.
- ^ Marsh D (December 2002). "Membrane water-penetration profiles from spin labels". Eur. Biophys. J. 31 (7): 559–62. doi:10.1007/s00249-002-0245-z. PMID 12602343.
- ^ A b C d Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E (July 2000). "Effect of chain length and unsaturation on elasticity of lipid bilayers". Biophys. J. 79 (1): 328–39. Bibcode:2000BpJ....79..328R. doi:10.1016/S0006-3495(00)76295-3. PMC 1300937. PMID 10866959.
- ^ Trauble H, Haynes DH (1971). "The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition". Chem. Phys. Lipidy. 7 (4): 324–35. doi:10.1016/0009-3084(71)90010-7.
- ^ Bretscher MS (1 March 1972). "Asymmetrical Lipid Bilayer Structure for Biological Membranes". Příroda nová biologie. 236 (61): 11–12. doi:10.1038/newbio236011a0. PMID 4502419.
- ^ Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL (October 1973). "The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy". Biochim. Biophys. Acta. 323 (2): 178–93. doi:10.1016/0005-2736(73)90143-0. PMID 4356540.
- ^ Bell RM, Ballas LM, Coleman RA (1 March 1981). "Lipid topogenesis". J. Lipid Res. 22 (3): 391–403. PMID 7017050.
- ^ Bretscher MS (August 1973). "Membrane structure: some general principles". Věda. 181 (4100): 622–629. Bibcode:1973Sci...181..622B. doi:10.1126/science.181.4100.622. PMID 4724478.
- ^ Rothman JE, Kennedy EP (May 1977). "Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly". Proc. Natl. Acad. Sci. USA. 74 (5): 1821–5. Bibcode:1977PNAS...74.1821R. doi:10.1073/pnas.74.5.1821. PMC 431015. PMID 405668.
- ^ Kornberg RD, McConnell HM (March 1971). "Inside-outside transitions of phospholipids in vesicle membranes". Biochemie. 10 (7): 1111–20. doi:10.1021/bi00783a003. PMID 4324203.
- ^ Litman BJ (July 1974). "Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles". Biochemie. 13 (14): 2844–8. doi:10.1021/bi00711a010. PMID 4407872.
- ^ Crane JM, Kiessling V, Tamm LK (February 2005). "Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy". Langmuir. 21 (4): 1377–88. doi:10.1021/la047654w. PMID 15697284.
- ^ Kalb E, Frey S, Tamm LK (January 1992). "Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers". Biochim. Biophys. Acta. 1103 (2): 307–16. doi:10.1016/0005-2736(92)90101-Q. PMID 1311950.
- ^ Lin WC, Blanchette CD, Ratto TV, Longo ML (January 2006). "Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study". Biophys. J. 90 (1): 228–37. Bibcode:2006BpJ....90..228L. doi:10.1529/biophysj.105.067066. PMC 1367021. PMID 16214871.
- ^ Berg, Howard C. (1993). Random walks in biology (Extended Paperback ed.). Princeton, NJ: Princeton University Press. ISBN 978-0-691-00064-0.
- ^ Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K (September 2001). "Partitioning of Thy-1, GM1, and cross-linked phospholipid analogs into lipid rafts reconstituted in supported model membrane monolayers". Proc. Natl. Acad. Sci. USA. 98 (19): 10642–7. Bibcode:2001PNAS...9810642D. doi:10.1073/pnas.191168698. PMC 58519. PMID 11535814.
- ^ Alberts, Bruce (2017). "Chapter 10: Membrane Structures". Molekulární biologie buňky. Věnec věnec. ISBN 9781317563747.
- ^ A b C Yeagle, Philip (1993). The membranes of cells (2. vyd.). Boston: Academic Press. ISBN 978-0-12-769041-4.
- ^ Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM (July 1998). "The role of phosphatidylserine in recognition of apoptotic cells by phagocytes". Smrt buňky se liší. 5 (7): 551–62. doi:10.1038/sj.cdd.4400404. PMID 10200509.
- ^ Anderson HC, Garimella R, Tague SE (January 2005). "The role of matrix vesicles in growth plate development and biomineralization". Přední. Biosci. 10 (1–3): 822–37. doi:10.2741/1576. PMID 15569622.
- ^ Eanes ED, Hailer AW (January 1987). "Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes". Calcif. Tissue Int. 40 (1): 43–8. doi:10.1007/BF02555727. PMID 3103899.
- ^ Kim J, Mosior M, Chung LA, Wu H, McLaughlin S (July 1991). "Binding of peptides with basic residues to membranes containing acidic phospholipids". Biophys. J. 60 (1): 135–48. Bibcode:1991BpJ....60..135K. doi:10.1016/S0006-3495(91)82037-9. PMC 1260045. PMID 1883932.
- ^ Koch AL (1984). "Primeval cells: possible energy-generating and cell-division mechanisms". J. Mol. Evol. 21 (3): 270–7. Bibcode:1985JMolE..21..270K. doi:10.1007/BF02102359. PMID 6242168.
- ^ "5.1 Cell Membrane Structure | Life Science | University of Tokyo". Archivovány od originál dne 22. února 2014. Citováno 10. listopadu 2012.
- ^ A b Alberts, Bruce (2002). Molekulární biologie buňky (4. vydání). New York: Garland Science. ISBN 978-0-8153-4072-0.
- ^ Martelli PL, Fariselli P, Casadio R (2003). "An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins". Bioinformatika. 19 (Suppl 1): i205–11. doi:10.1093/bioinformatics/btg1027. PMID 12855459.
- ^ Filmore D (2004). "It's A GPCR World". Moderní objev drog. 11: 24–9.
- ^ Montal M, Mueller P (December 1972). "Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties". Proc. Natl. Acad. Sci. 69 (12): 3561–6. Bibcode:1972PNAS...69.3561M. doi:10.1073/pnas.69.12.3561. PMC 389821. PMID 4509315.
- ^ Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV (April 2001). "Voltage-induced nonconductive pre-pores and metastable single pores in unmodified planar lipid bilayer". Biophys. J. 80 (4): 1829–36. Bibcode:2001BpJ....80.1829M. doi:10.1016/S0006-3495(01)76153-X. PMC 1301372. PMID 11259296.
- ^ Neher E, Sakmann B (April 1976). "Single-channel currents recorded from membrane of denervated frog muscle fibres". Příroda. 260 (5554): 799–802. Bibcode:1976Natur.260..799N. doi:10.1038/260799a0. PMID 1083489.
- ^ Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L (May 1979). "Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release". J. Cell Biol. 81 (2): 275–300. doi:10.1083/jcb.81.2.275. PMC 2110310. PMID 38256.
- ^ Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS (June 2006). "Modeling of 31P-NMR spectra of magnetically oriented phospholipid liposomes: A new analytical solution". Solid State Nucl Magn Reson. 29 (4): 305–311. doi:10.1016/j.ssnmr.2005.10.009. PMID 16298110.[mrtvý odkaz ]
- ^ A b C Roiter, Yuri; Ornatska, Maryna; Rammohan, Aravind R.; Balakrishnan, Jitendra; Heine, David R.; Minko, Sergiy (2008). "Interaction of Nanoparticles with Lipid Membrane". Nano dopisy. 8 (3): 941–944. Bibcode:2008NanoL...8..941R. doi:10.1021/nl080080l. PMID 18254602.
- ^ Tokumasu F, Jin AJ, Dvorak JA (2002). "Lipid membrane phase behavior elucidated in real time by controlled environment atomic force microscopy". J. Electron Micros. 51 (1): 1–9. doi:10.1093/jmicro/51.1.1. PMID 12003236.
- ^ Richter RP, Brisson A (2003). "Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy". Langmuir. 19 (5): 1632–40. doi:10.1021/la026427w.
- ^ A b Steltenkamp S, Müller MM, Deserno M, Hennesthal C, Steinem C, Janshoff A (July 2006). "Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy". Biophys. J. 91 (1): 217–26. Bibcode:2006BpJ....91..217S. doi:10.1529/biophysj.106.081398. PMC 1479081. PMID 16617084.
- ^ Alireza Mashaghi et al., Hydration strongly affects the molecular and electronic structure of membrane phospholipids. J. Chem. Phys. 136, 114709 (2012) "The Journal of Chemical Physics". Archivovány od originál dne 15. května 2016. Citováno 17. května 2012.
- ^ Chakrabarti AC (1994). "Permeability of membranes to amino acids and modified amino acids: mechanisms involved in translocation". Aminokyseliny. 6 (3): 213–29. doi:10.1007/BF00813743. PMID 11543596.
- ^ Hauser H, Phillips MC, Stubbs M (October 1972). "Ion permeability of phospholipid bilayers". Příroda. 239 (5371): 342–4. Bibcode:1972Natur.239..342H. doi:10.1038/239342a0. PMID 12635233.
- ^ Papahadjopoulos D, Watkins JC (September 1967). "Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals". Biochim. Biophys. Acta. 135 (4): 639–52. doi:10.1016/0005-2736(67)90095-8. PMID 6048247.
- ^ Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW (January 1996). "Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness". Biophys. J. 70 (1): 339–48. Bibcode:1996BpJ....70..339P. doi:10.1016/S0006-3495(96)79575-9. PMC 1224932. PMID 8770210.
- ^ Xiang TX, Anderson BD (June 1994). "The relationship between permeant size and permeability in lipid bilayer membranes". J. Membr. Biol. 140 (2): 111–22. doi:10.1007/bf00232899. PMID 7932645.
- ^ Gouaux E, Mackinnon R (December 2005). "Principles of selective ion transport in channels and pumps". Věda. 310 (5753): 1461–5. Bibcode:2005Sci...310.1461G. doi:10.1126/science.1113666. PMID 16322449.
- ^ Gundelfinger ED, Kessels MM, Qualmann B (February 2003). "Temporal and spatial coordination of exocytosis and endocytosis". Nat. Rev. Mol. Cell Biol. 4 (2): 127–39. doi:10.1038/nrm1016. PMID 12563290.
- ^ Steinman RM, Brodie SE, Cohn ZA (March 1976). "Membrane flow during pinocytosis. A stereologic analysis". J. Cell Biol. 68 (3): 665–87. doi:10.1083/jcb.68.3.665. PMC 2109655. PMID 1030706.
- ^ YashRoy R.C. (1999) 'Exocytosis in prokaryotes' and its role in salmonella invaze. ICAR NEWS - A Science and Technology Newsletter, (Oct-Dec) vol. 5(4), page 18.https://www.researchgate.net/publication/230822402_'Exocytosis_in_prokaryotes'_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy R C (1993) Electron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms. Ind Jl of Anim Sci 63, 99-102.https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- ^ YashRoy R.C. (1998) Discovery of vesicular exocytosis in prokaryotes and its role in Salmonella invaze. Současná věda, sv. 75(10), pp. 1062-1066.https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
- ^ YashRoy RC (1998). "Exocytosis from gram negative bacteria for Salmonella invasion of chicken ileal epithelium". Indian Journal of Poultry Science. 33 (2): 119–123.
- ^ Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH (1982). "Gene transfer into mouse lyoma cells by electroporation in high electric fields". EMBO J.. 1 (7): 841–5. doi:10.1002/j.1460-2075.1982.tb01257.x. PMC 553119. PMID 6329708.
- ^ Demanèche S, Bertolla F, Buret F, et al. (Srpen 2001). "Laboratory-scale evidence for lightning-mediated gene transfer in soil". Appl. Environ. Microbiol. 67 (8): 3440–4. doi:10.1128/AEM.67.8.3440-3444.2001. PMC 93040. PMID 11472916.
- ^ Garcia ML (July 2004). "Ion channels: gate expectations". Příroda. 430 (6996): 153–5. Bibcode:2004Natur.430..153G. doi:10.1038/430153a. PMID 15241399.
- ^ McIntosh TJ, Simon SA (2006). "Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins". Annu. Biophys. Biomol. Struct. 35 (1): 177–98. doi:10.1146/annurev.biophys.35.040405.102022. PMID 16689633.
- ^ Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA (July 2004). "Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers". Příroda. 430 (6996): 235–40. Bibcode:2004Natur.430..235S. doi:10.1038/nature02743. PMID 15241420.
- ^ Hallett FR, Marsh J, Nickel BG, Wood JM (February 1993). "Mechanical properties of vesicles. II. A model for osmotic swelling and lysis". Biophys. J. 64 (2): 435–42. Bibcode:1993BpJ....64..435H. doi:10.1016/S0006-3495(93)81384-5. PMC 1262346. PMID 8457669.
- ^ Boal, David H. (2001). Mechanics of the cell. Cambridge, Velká Británie: Cambridge University Press. ISBN 978-0-521-79681-1.
- ^ Rutkowski CA, Williams LM, Haines TH, Cummins HZ (June 1991). "The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy". Biochemie. 30 (23): 5688–96. doi:10.1021/bi00237a008. PMID 2043611.
- ^ Evans E, Heinrich V, Ludwig F, Rawicz W (October 2003). "Dynamic tension spectroscopy and strength of biomembranes". Biophys. J. 85 (4): 2342–50. Bibcode:2003BpJ....85.2342E. doi:10.1016/S0006-3495(03)74658-X. PMC 1303459. PMID 14507698.
- ^ YashRoy R.C. (1994) Destabilisation of lamellar dispersion of thylakoid membrane lipids by sucrose. Biochimica et Biophysica Acta, sv. 1212, pp. 129-133.https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- ^ Weaver JC, Chizmadzhev YA (1996). "Theory of electroporation: A review". Biochemistry and Bioenergetics. 41 (2): 135–60. doi:10.1016/S0302-4598(96)05062-3.
- ^ Papahadjopoulos D, Nir S, Düzgünes N (April 1990). "Molecular mechanisms of calcium-induced membrane fusion". J. Bioenerg. Biomembr. 22 (2): 157–79. doi:10.1007/BF00762944. PMID 2139437.
- ^ Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR (November 1986). "Divalent cation induced fusion and lipid lateral segregation in phosphatidylcholine-phosphatidic acid vesicles". Biochemie. 25 (22): 6978–87. doi:10.1021/bi00370a600. PMID 3801406.
- ^ Markin VS, Kozlov MM, Borovjagin VL (October 1984). "On the theory of membrane fusion. The stalk mechanism". Gen. Physiol. Biophys. 3 (5): 361–77. PMID 6510702.
- ^ Chernomordik LV, Kozlov MM (2003). "Protein-lipid interplay in fusion and fission of biological membranes". Annu. Biochem. 72 (1): 175–207. doi:10.1146/annurev.biochem.72.121801.161504. PMID 14527322.
- ^ Georgiev, Danko D.; Glazebrook, James F. (2007). "Subneuronal processing of information by solitary waves and stochastic processes". In Lyshevski, Sergey Edward (ed.). Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. str.17 –1–17–41. doi:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.
- ^ Chen YA, Scheller RH (February 2001). "SNARE-mediated membrane fusion". Nat. Rev. Mol. Cell Biol. 2 (2): 98–106. doi:10.1038/35052017. PMID 11252968.
- ^ Köhler G, Milstein C (August 1975). "Continuous cultures of fused cells secreting antibody of predefined specificity". Příroda. 256 (5517): 495–7. Bibcode:1975Natur.256..495K. doi:10.1038/256495a0. PMID 1172191.
- ^ Jordan, Carol A.; Neumann, Eberhard; Sowershi mason, Arthur E. (1989). Electroporation and electrofusion in cell biology. New York: Plenum Press. ISBN 978-0-306-43043-5.
- ^ Immordino ML, Dosio F, Cattel L (2006). "Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential". Int J Nanomed. 1 (3): 297–315. doi:10.2217/17435889.1.3.297. PMC 2426795. PMID 17717971.
- ^ Chonn A, Semple SC, Cullis PR (15 September 1992). "Association of blood proteins with large unilamellar liposomes in vivo. Relation to circulation lifetimes". J. Biol. Chem. 267 (26): 18759–65. PMID 1527006.
- ^ Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD (1997). "Stealth liposomes: from theory to product". Pokročilé recenze dodávek drog. 24 (2–3): 165–77. doi:10.1016/S0169-409X(96)00456-5.
- ^ Maeda H, Sawa T, Konno T (July 2001). "Mechanism of tumor-targeted delivery of macromolecular drugs, including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS". J Ovládací uvolnění. 74 (1–3): 47–61. doi:10.1016/S0168-3659(01)00309-1. PMID 11489482.
- ^ Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF (1999). "Cellular trafficking and cytotoxicity of anti-CD19-targeted liposomal doxorubicin in B lymphoma cells". Journal of Liposome Research. 9 (2): 199–228. doi:10.3109/08982109909024786.
- ^ Matsumura Y, Gotoh M, Muro K, et al. (Březen 2004). "Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer". Ann. Oncol. 15 (3): 517–25. doi:10.1093/annonc/mdh092. PMID 14998859.
- ^ [1]. Biacore Inc. Retrieved Feb 12, 2009.
- ^ Nanion Technologies. Automated Patch Clamp. Retrieved Feb 28, 2010. (PDF)
- ^ Bermejo, M.; Avdeef, A.; Ruiz, A.; Nalda, R.; Ruell, J. A.; Tsinman, O.; González, I.; Fernández, C.; Sánchez, G.; Garrigues, T. M.; Merino, V. (2004). "PAMPA--a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones". European Journal of Pharmaceutical Sciences. 21 (4): 429–41. doi:10.1016/j.ejps.2003.10.009. PMID 14998573.
- ^ Avdeef, A.; Artursson, P.; Neuhoff, S.; Lazorova, L.; Gråsjö, J.; Tavelin, S. (2005). "Caco-2 permeability of weakly basic drugs predicted with the double-sink PAMPA pKa(flux) method". European Journal of Pharmaceutical Sciences. 24 (4): 333–49. doi:10.1016/j.ejps.2004.11.011. PMID 15734300.
- ^ Avdeef, A.; Nielsen, P. E.; Tsinman, O. (2004). "PAMPA--a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates". European Journal of Pharmaceutical Sciences. 22 (5): 365–74. doi:10.1016/j.ejps.2004.04.009. PMID 15265506.
- ^ Dagenais, C.; Avdeef, A.; Tsinman, O.; Dudley, A.; Beliveau, R. (2009). "P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model". European Journal of Pharmaceutical Sciences. 38 (2): 121–37. doi:10.1016/j.ejps.2009.06.009. PMC 2747801. PMID 19591928.
- ^ Sinkó, B.; Kökösi, J.; Avdeef, A.; Takács-Novák, K. (2009). "A PAMPA study of the permeability-enhancing effect of new ceramide analogues". Chemie a biologická rozmanitost. 6 (11): 1867–74. doi:10.1002/cbdv.200900149. PMID 19937821.
- ^ Loeb J (December 1904). "The recent development of Biology". Věda. 20 (519): 777–786. Bibcode:1904Sci....20..777L. doi:10.1126/science.20.519.777. PMID 17730464.
- ^ Fricke H (1925). "The electrical capacity of suspensions with special reference to blood". Journal of General Physiology. 9 (2): 137–52. doi:10.1085/jgp.9.2.137. PMC 2140799. PMID 19872238.
- ^ Dooren LJ, Wiedemann LR (1986). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of European Journal of Pediatrics. 145 (5): 329. doi:10.1007/BF00439232. PMID 3539619.
- ^ Gorter E, Grendel F (1925). "On bimolecular layers of lipids on the chromocytes of the blood". Journal of Experimental Medicine. 41 (4): 439–43. doi:10.1084/jem.41.4.439. PMC 2130960. PMID 19868999.
- ^ Sjöstrand FS, Andersson-Cedergren E, Dewey MM (April 1958). "The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle". J. Ultrastruct. Res. 1 (3): 271–87. doi:10.1016/S0022-5320(58)80008-8. PMID 13550367.
- ^ Robertson JD (1960). "The molecular structure and contact relationships of cell membranes". Prog. Biophys. Mol. Biol. 10: 343–418. PMID 13742209.
- ^ Robertson JD (1959). "The ultrastructure of cell membranes and their derivatives". Biochem. Soc. Symp. 16: 3–43. PMID 13651159.
- ^ Mueller P, Rudin DO, Tien HT, Wescott WC (June 1962). "Reconstitution of cell membrane structure in vitro and its transformation into an excitable system". Příroda. 194 (4832): 979–80. Bibcode:1962Natur.194..979M. doi:10.1038/194979a0. PMID 14476933.
- ^ Bangham, A. D.; Horne, R. W. (1964). "Negative Staining of Phospholipids and Their Structural Modification by Surface-Active Agents As Observed in the Electron Microscope". Journal of Molecular Biology. 8 (5): 660–668. doi:10.1016/S0022-2836(64)80115-7. PMID 14187392.
- ^ Kunitake T (1977). "A totally synthetic bilayer membrane". J. Am. Chem. Soc. 99 (11): 3860–3861. doi:10.1021/ja00453a066.
externí odkazy
- Avanti Lipids One of the largest commercial suppliers of lipids. Technical information on lipid properties and handling and lipid bilayer preparation techniques.
- LIPIDAT An extensive database of lipid physical properties
- Structure of Fluid Lipid Bilayers Simulations and publication links related to the cross sectional structure of lipid bilayers.
- Lipid Bilayers and the Gramicidin Channel (requires Java plugin) Pictures and movies showing the results of molecular dynamics simulations of lipid bilayers.
- Structure of Fluid Lipid Bilayers, from the Stephen White laboratory at University of California, Irvine
- Animations of lipid bilayer dynamics (requires Flash plugin)


