Fas ligand - Fas ligand
Fas ligand (FasL nebo CD95 L nebo CD178) je typu II transmembránový protein který patří k faktor nekrózy nádorů (TNF) rodina. Jeho vazba na receptor indukuje apoptóza. Interakce Fas ligand / receptor hrají důležitou roli v regulaci imunitní systém a postup rakovina.
Struktura
Fas ligand nebo FasL je a homotrimerní transmembránový protein typu II exprimovaný na cytotoxické T lymfocyty. Signalizuje prostřednictvím trimerizace FasR, který překlenuje membránu „cílové“ buňky. Tato trimerizace obvykle vede k apoptóze nebo buněčné smrti.
Rozpustný ligand Fas je generován štěpením FasL vázaného na membránu v konzervovaném místě štěpení vnějším matricová metaloproteináza MMP-7.
Receptory
- FasR: Fas receptor (FasR ), nebo CD95, je nejintenzivněji studovaným členem rodiny receptorů smrti. Gen se nachází na chromozom 10 u lidí a 19 u myší. Předchozí zprávy identifikovaly až osm variant sestřihu, které jsou přeloženy do sedmi izoformy bílkoviny. Mnoho z těchto izoforem je vzácných haplotypy které jsou obvykle spojeny se stavem nemoci. Apoptóza indukující Fas receptor se nazývá izoforma 1 a je typu 1 transmembránový protein. Skládá se ze tří cystein - bohaté pseudorepeaty, transmembránová doména a doména intracelulární smrti.
- DcR3: Návnada receptor 3 (DcR3 ) je nedávno objevený návnadový receptor faktor nekrózy nádorů nadčeleď, která se váže na FasL, SVĚTLO, a TL1A. DcR3 je rozpustný receptor, který nemá žádné signální transdukce schopnosti (tedy „návnada“) a funkce, kterým je třeba zabránit FasR -FasL interakce kompetitivní vazbou na Fas ligand vázaný na membránu a jejich neaktivitou.[5]
Buněčná signalizace
Fas tvoří smrtící signální komplex (DISC) po navázání ligandu. Membránou ukotvený trimer ligandu Fas na povrchu sousední buňky způsobuje trimerizaci receptoru Fas. Tato událost je také napodobována vazbou agonistického Fas protilátka, ačkoli některé důkazy naznačují, že apoptotický signál indukovaný protilátkou je nespolehlivý při studiu Fas signalizace. Za tímto účelem bylo použito několik chytrých způsobů trimerizace protilátky pro in vitro výzkum.
Po následném doména smrti (DD) agregace je komplex receptorů internalizován prostřednictvím buněčného endozomálního aparátu. To umožňuje molekulu adaptéru Doména smrti spojená s Fas (FADD) vázat smrtící doménu Fas prostřednictvím své vlastní smrtící domény. FADD také obsahuje a doména efektoru smrti (DED) poblíž svého amino konce, což usnadňuje vazbu na DED z FADD -jako ICE (FLICE ), běžněji označované jako kaspáza-8. FLICE se poté může samo aktivovat proteolytickým štěpením na podjednotky p10 a p18, z nichž dvě tvoří aktivní heterotetramerový enzym. Aktivní kaspáza-8 je poté uvolněna z DISC do cytosolu, kde štěpí další efektorové kaspázy, což nakonec vede k degradaci DNA, tvorbě membrány a dalším znakům apoptózy.
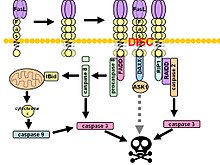
Některé zprávy naznačují, že vnější cesta Fas je dostatečná k vyvolání úplné apoptózy v určitých typech buněk prostřednictvím sestavení DISC a následné aktivace kaspázy-8. Tyto buňky se nazývají buňky typu 1 a vyznačují se neschopností antiapoptotických členů Bcl-2 rodina (jmenovitě Bcl-2 a Bcl-xL ) k ochraně před apoptózou zprostředkovanou Fas. Charakterizované buňky typu 1 zahrnují H9, CH1, SKW6.4 a SW480, přičemž všechny jsou linie lymfocytů, s výjimkou druhé, která je linie adenokarcinomu tlustého střeva.
V signální kaskádě Fas existují důkazy o přeslechu mezi vnější a vnitřní cestou. Ve většině typů buněk kaspáza-8 katalyzuje štěpení pro-apoptózy BH3 - pouze protein Nabídka do zkrácené formy, tBid. Pouze členové BH-3 z rodiny Bcl-2 zapojují výhradně antiapoptotické členy rodiny (Bcl-2, Bcl-xL), což umožňuje Bak a Bax translokovat do vnější mitochondriální membrány, čímž ji permeabilizuje a usnadňuje uvolňování pro-apoptotických proteinů, jako je cytochrom c a Smac / DIABLO, antagonista inhibitorů proteinů apoptózy (IAP ).
Rozpustný FasL je méně aktivní než jeho protějšek vázaný na membránu a neindukuje trimerizaci receptoru a DISK formace.
Funkce

Apoptóza vyvolané vazbou ligandu Fas-Fas hraje zásadní roli v regulaci imunitní systém. Mezi jeho funkce patří:
- T-buňka homeostáza: aktivace T-buňky vede k jejich expresi ligandu Fas. T buňky jsou zpočátku rezistentní na Fopem zprostředkovanou apoptózu během klonální expanze, ale postupně se stávají citlivějšími, čím déle jsou aktivovány, což nakonec vede k aktivací indukovaná buněčná smrt (AICD). Tento proces je nezbytný k prevenci nadměrné imunitní odpovědi a eliminaci autoreaktivních T-buněk. U lidí a myší se škodlivými mutacemi Fas nebo Fas ligandu se vyvine akumulace aberantních T-buněk, což vede k lymfadenopatie, splenomegalie, a lupus erythematodes.
- Cytotoxické T-buňky aktivita: Fasem indukované apoptóza a perforin cesta jsou dva hlavní mechanismy, kterými cytotoxické T lymfocyty indukují buněčnou smrt v buňkách exprimujících cizí antigeny.[6]
- Imunitní výsada: Buňky v imunitně privilegovaných oblastech, jako je rohovka nebo testy exprimujte Fas ligand a indukujte apoptózu infiltrace lymfocyty. Je to jeden z mnoha mechanismů, které tělo používá při vytváření a udržování imunitních privilegií.
- Mateřská tolerance: Fas ligand může být nápomocný při prevenci obchodování s leukocyty mezi matkou a plodem, ačkoli vadnému systému Fas-Fas ligandu dosud nebyly připisovány žádné vady těhotenství.
- Protiútok nádoru: Nádory mohou nadměrně exprimovat ligand Fas a indukovat apoptóza infiltrace lymfocyty, umožňující nádoru uniknout účinkům an imunitní odpověď.[7] Up-regulace Fas ligandu často nastává následovně chemoterapie, z nichž nádorové buňky pocházejí apoptóza odpor.
Role v nemoci
Může dojít k defektní apoptóze zprostředkované Fas onkogeneze stejně jako rezistence na léky u stávajících nádorů. Germinální mutace Fas je spojena s autoimunitní lymfoproliferativní syndrom (ALPS), dětská porucha apoptózy.
Zvýšení Fas zprostředkované signalizace bylo zapleteno do patologie s nízkým rizikem myelodysplastické syndromy (MDS)[8] a glioblastom.[9]
V poslední době byla také navržena apoptóza T buněk zprostředkovaná FasL jako imunitně-úhybný mechanismus, kterým nádory mohou potlačovat infiltraci T buněk podobně jako inhibiční imunitní kontrolní body, jako je PD-1 a CTLA-4.[10][11][12]
Klinický význam
Terapeutické zdůvodnění potlačení signalizace Fas v kontextu glioblastom a myelodysplastické syndromy (MDS) vedly k vývoji fúzního proteinu Fas asunercept (APG101 ), který je v současné době v klinickém vývoji pro tyto indikace.
Interakce
Bylo prokázáno, že ligand Fas komunikovat s:
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000117560 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000000817 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Sheikh MS, Fornace AJ (2000). „Receptory smrti a návnad a apoptóza zprostředkovaná p53“. Leukémie. 14 (8): 1509–1513. doi:10.1038 / sj.leu.2401865. PMID 10942251.
- ^ Andersen MH, Schrama D, Thor Straten P, Becker JC (2006). "Cytotoxické T buňky". J. Invest. Dermatol. 126 (1): 32–41. doi:10.1038 / sj.jid.5700001. PMID 16417215.
- ^ Igney FH, Krammer PH (2005). „Protiútok nádoru: skutečnost nebo fikce?“. Cancer Immunol. Immunother. 54 (11): 1127–1136. doi:10.1007 / s00262-005-0680-7. PMID 15889255. S2CID 19331352.
- ^ Claessens YE, Bouscary D, Dupont JM, Picard F, Melle J, Gisselbrecht S, Lacombe C, Dreyfus F, Mayeux P, Fontenay-Roupie M (2002). „Proliferace a diferenciace erytroidních progenitorů od pacientů s myelodysplastickými syndromy in vitro: důkazy apoptózy závislé na Fas“. Krev. 99 (5): 1591–601. doi:10,1182 / krev. V99.5.1594. PMID 11861273.
- ^ Tachibana O, Nakazawa H, Lampe J, Watanabe K, Kleihues P, Ohgaki H (1995). "Exprese Fas / APO-1 během progrese astrocytomů". Cancer Res. 55 (23): 5528–30. PMID 7585627.
- ^ Motz GT, Santoro SP, Wang LP, Garrabrant T, Lastra RR, Hagemann IS, Lal P, Feldman MD, Benencia F, Coukos G (2014). „Nádorový endotel FasL vytváří selektivní imunitní bariéru podporující toleranci v nádorech“. Nat Med. 20 (6): 607–15. doi:10,1038 / nm. 3541. PMC 4060245. PMID 24793239.
- ^ Zhu J, Powis de Tenbossche CG, Cané S, Colau D, van Baren N, Lurquin C, Schmitt-Verhulst AM, Liljeström P, Uyttenhove C, Van den Eynde BJ (2017). „Odolnost proti imunoterapii rakoviny zprostředkovaná apoptózou lymfocytů infiltrujících nádor“. Nat Commun. 8 (1): 1404. doi:10.1038 / s41467-017-00784-1. PMC 5680273. PMID 29123081.
- ^ Lakins MA, Ghorani E, Munir H, Martins CP, Shields JD (2018). „Fibroblasty spojené s rakovinou indukují antigenně specifické delece CD8 + T buněk k ochraně nádorových buněk“. Nat Commun. 9 (1): 948. doi:10.1038 / s41467-018-03347-0. PMC 5838096. PMID 29507342.
- ^ A b C d Gajate C, Mollinedo F (březen 2005). „Cytoskeletonem zprostředkovaný receptor smrti a koncentrace ligandu v lipidových raftech tvoří v chemoterapii rakoviny shluky podporující apoptózu“. J. Biol. Chem. 280 (12): 11641–7. doi:10,1074 / jbc.M411781200. PMID 15659383.
- ^ A b C Micheau O, Tschopp J (červenec 2003). „Indukce apoptózy zprostředkované TNF receptorem I prostřednictvím dvou sekvenčních signálních komplexů“ (PDF). Buňka. 114 (2): 181–90. doi:10.1016 / s0092-8674 (03) 00521-x. PMID 12887920. S2CID 17145731.
- ^ Parlato S, Giammarioli AM, Logozzi M, Lozupone F, Matarrese P, Luciani F, Falchi M, Malorni W, Fais S (říjen 2000). „Vazba CD95 (APO-1 / Fas) na cytoskelet aktinu prostřednictvím ezrinu v lidských T lymfocytech: nový regulační mechanismus apoptotické dráhy CD95“. EMBO J.. 19 (19): 5123–34. doi:10.1093 / emboj / 19.19.5123. PMC 302100. PMID 11013215.
- ^ A b C Ghadimi MP, Sanzenbacher R, Thiede B, Wenzel J, Jing Q, Plomann M, Borkhardt A, Kabelitz D, Janssen O (květen 2002). "Identifikace interakčních partnerů cytosolické polyprolinové oblasti ligandu CD95 (CD178)". FEBS Lett. 519 (1–3): 50–8. doi:10.1016 / s0014-5793 (02) 02709-6. PMID 12023017. S2CID 26765451.
- ^ A b Wenzel J, Sanzenbacher R, Ghadimi M, Lewitzky M, Zhou Q, Kaplan DR, Kabelitz D, Feller SM, Janssen O (prosinec 2001). „Vícenásobné interakce cytosolické polyprolinové oblasti ligandu CD95: rady pro schopnost přenosu zpětného signálu faktoru smrti“. FEBS Lett. 509 (2): 255–62. doi:10.1016 / s0014-5793 (01) 03174-x. PMID 11741599. S2CID 33084576.
- ^ Hane M, Lowin B, Peitsch M, Becker K, Tschopp J (říjen 1995). "Interakce peptidů odvozených od ligandu Fas s doménou Fyn-SH3". FEBS Lett. 373 (3): 265–8. doi:10.1016 / 0014-5793 (95) 01051-f. PMID 7589480. S2CID 24130275.
- ^ Starling GC, Bajorath J, Emswiler J, Ledbetter JA, Aruffo A, Kiener PA (duben 1997). "Identifikace aminokyselinových zbytků důležitých pro vazbu ligandu na Fas". J. Exp. Med. 185 (8): 1487–92. doi:10.1084 / jem.185.8.1487. PMC 2196280. PMID 9126929.
- ^ Schneider P, Bodmer JL, Holler N, Mattmann C, Scuderi P, Terskikh A, Peitsch MC, Tschopp J (červenec 1997). "Charakterizace interakce ligandu Fas (Apo-1, CD95)". J. Biol. Chem. 272 (30): 18827–33. doi:10.1074 / jbc.272.30.18827. PMID 9228058.
- ^ Yu KY, Kwon B, Ni J, Zhai Y, Ebner R, Kwon BS (květen 1999). „Nově identifikovaný člen nadrodiny receptoru faktoru nekrotizující nádorové nádory (TR6) potlačuje SVĚTEM zprostředkovanou apoptózu“. J. Biol. Chem. 274 (20): 13733–6. doi:10.1074 / jbc.274.20.13733. PMID 10318773.
- ^ Hsu TL, Chang YC, Chen SJ, Liu YJ, Chiu AW, Chio CC, Chen L, Hsieh SL (květen 2002). "Modulace diferenciace a zrání dendritických buněk pomocí návnadového receptoru 3". J. Immunol. 168 (10): 4846–53. doi:10,4049 / jimmunol.168.10.4846. PMID 11994433.
- ^ Pitti RM, Marsters SA, Lawrence DA, Roy M, Kischkel FC, Dowd P, Huang A, Donahue CJ, Sherwood SW, Baldwin DT, Godowski PJ, Wood WI, Gurney AL, Hillan KJ, Cohen RL, Goddard AD, Botstein D , Ashkenazi A (prosinec 1998). "Genomická amplifikace návnadového receptoru pro ligand Fas u rakoviny plic a tlustého střeva". Příroda. 396 (6712): 699–703. doi:10.1038/25387. PMID 9872321. S2CID 4427455.
Další čtení
- Choi C, Benveniste EN (leden 2004). "Fas ligand / Fas systém v mozku: regulátor imunitních a apoptotických odpovědí". Brain Res. Brain Res. Rev. 44 (1): 65–81. doi:10.1016 / j.brainresrev.2003.08.007. PMID 14739003. S2CID 46587211.
- Tolstrup M, Ostergaard L, Laursen AL, Pedersen SF, Duch M (2004). „Únik HIV / SIV z imunitního dohledu: zaměření na Nefa“. Curr. HIV Res. 2 (2): 141–51. doi:10.2174/1570162043484924. PMID 15078178.
externí odkazy
- GeneReviews / NCBI / NIH / UW záznam o autoimunitním lymfoproliferativním syndromu
- Online Mendelian Inheritance in Man (OMIM): 601859
- Fas + Ligand + Protein v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P48023 (Člen nadrodiny ligandu faktoru nekrotizující faktor 6) na PDBe-KB.