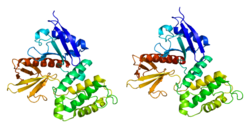Ezrin - Ezrin
Ezrin také známý jako cytovilin nebo villin-2 je protein že u lidí je kódován EZR gen.[5]
Struktura
The N-konec ezrinu obsahuje a FERM doména který se dále dělí na tři subdomény. The C-konec obsahovat ERM doména.
Funkce
The cytoplazmatický periferní protein kódované tímto genem lze fosforylovat proteinovětyrosinkináza v mikrovilli a je členem Rodina proteinů ERM. Tento protein slouží jako spojovací článek mezi plazmatickou membránou a aktin cytoskelet. Hraje klíčovou roli v adhezi, migraci a organizaci struktury povrchu buněk.[6]
N-terminální doména (nazývaná také FERM doména ) váže regulační faktor výměníku sodík-vodík (NHERF ) protein (zahrnující dalekonosný allostery ).[7] K této vazbě může dojít pouze v případě, že je ezrin v aktivním stavu. K aktivaci ezrinu dochází v synergismu dvou faktorů: 1) vazba N-terminální domény na fosfatidylinositol (4,5) bis-fosfát (PIP2 ) a 2) fosforylace threoninu T567 v C-terminální doméně.[8][9] Vazba na aktinová vlákna (přes C-konec) a na membránové proteiny (přes N-konec) stabilizuje konformaci proteinu v aktivním režimu. Membránové proteiny jako CD44 a ICAM-2 jsou nepřímými vazebnými partnery ezrinu, zatímco EBP50 (ERM vazebný protein 50) se může spojovat přímo s ezrinem.[10]
Interakce
VIL2 bylo prokázáno komunikovat s:
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000092820 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání Ensembl 89: ENSMUSG00000052397 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Gould KL, Bretscher A, Esch FS, Hunter T (prosinec 1989). „Klonování cDNA a sekvenování substrátu protein-tyrosinkinázy, ezrin, odhaluje homologii k pásmu 4.1“. EMBO J.. 8 (13): 4133–42. doi:10.1002 / j.1460-2075.1989.tb08598.x. PMC 401598. PMID 2591371.
- ^ „Entrez Gene: VIL2 villin 2 (ezrin)“.
- ^ Farago B, Li J, Cornilescu G, Callaway DJ, Bu Z (2010). „Aktivace alosterické proteinové domény v nanoměřítku odhalena neutronovou spinovou echo spektroskopií“. Biofyzikální deník. 99 (10): 3473–82. doi:10.1016 / j.bpj.2010.09.058. PMC 2980739. PMID 21081097.
- ^ Jayasundar JJ, Ju JH, He L, Liu D, Meilleur F, Zhao J, Callaway DJ, Bu Z (2012). „Otevřená konformace ezrinu vázaného na fosfatidylinositol 4,5-bisfosfát a na F-aktin odhalená rozptylem neutronů“. J. Biol. Chem. 287 (44): 37119–33. doi:10.1074 / jbc.M112.380972. PMC 3481312. PMID 22927432.
- ^ Shabardina V, Kramer C, Gerdes B, Braunger J, Cordes A, Schaefer J, Mey I, Grill D, Gerke V, Steinem C (2016). „Režim interakce ezrin-membrána jako funkce vazby PIP2 a pseudofosforylace“. Biophys. J. 110 (12): 2710–2719. doi:10.1016 / j.bpj.2016.05.009. PMC 4919509. PMID 27332129.
- ^ Ivetic A, Ridley AJ (2004). "Ezrin / radixin / moesinové proteiny a Rho GTPáza signalizace v leukocytech". Imunologie. 112 (2): 165–176. doi:10.1111 / j.1365-2567.2004.01882.x. PMC 1782489. PMID 15147559.
- ^ Serrador JM, Nieto M, Alonso-Lebrero JL, del Pozo MA, Calvo J, Furthmayr H, Schwartz-Albiez R, Lozano F, González-Amaro R, Sánchez-Mateos P, Sánchez-Madrid F (červen 1998). „CD43 interaguje s moesinem a ezrinem a reguluje jeho redistribuci na uropody T lymfocytů v kontaktech mezi buňkami“. Krev. 91 (12): 4632–44. doi:10,1182 / krev. V91.12.4632. PMID 9616160.
- ^ A b Gajate C, Mollinedo F (březen 2005). „Cytoskeletonem zprostředkovaný receptor smrti a koncentrace ligandu v lipidových raftech tvoří v chemoterapii rakoviny shluky podporující apoptózu“. J. Biol. Chem. 280 (12): 11641–7. doi:10,1074 / jbc.M411781200. PMID 15659383.
- ^ Parlato S, Giammarioli AM, Logozzi M, Lozupone F, Matarrese P, Luciani F, Falchi M, Malorni W, Fais S (říjen 2000). „Vazba CD95 (APO-1 / Fas) na cytoskelet aktinu prostřednictvím ezrinu v lidských T lymfocytech: nový regulační mechanismus apoptotické dráhy CD95“. EMBO J.. 19 (19): 5123–34. doi:10.1093 / emboj / 19.19.5123. PMC 302100. PMID 11013215.
- ^ A b C Heiska L, Alfthan K, Grönholm M, Vilja P, Vaheri A, Carpén O (srpen 1998). "Sdružení ezrinu s mezibuněčnou adhezní molekulou-1 a -2 (ICAM-1 a ICAM-2). Regulace fosfatidylinositol 4,5-bisfosfátem". J. Biol. Chem. 273 (34): 21893–900. doi:10.1074 / jbc.273.34.21893. PMID 9705328.
- ^ Serrador JM, Vicente-Manzanares M, Calvo J, Barreiro O, Montoya MC, Schwartz-Albiez R, Furthmayr H, Lozano F, Sánchez-Madrid F (březen 2002). „Nový motiv bohatý na serin v mezibuněčné adhezní molekule 3 je zásadní pro jeho subcelulární cílení zaměřené na ezrin / radixin / moesin“. J. Biol. Chem. 277 (12): 10400–9. doi:10,1074 / jbc.M110694200. PMID 11784723.
- ^ Grönholm M, Sainio M, Zhao F, Heiska L, Vaheri A, Carpén O (březen 1999). "Homotypická a heterotypická interakce neurofibromatózy 2 tumor supresorového proteinu merlin a proteinu ERM ezrin". J. Cell Sci. 112 (6): 895–904. PMID 10036239.
- ^ Gary R, Bretscher A (srpen 1995). „Ezrinova asociace zahrnuje navázání N-terminální domény na normálně maskovanou C-terminální doménu, která zahrnuje F-aktinové vazebné místo“. Mol. Biol. Buňka. 6 (8): 1061–75. doi:10,1091 / mbc.6.8.1061. PMC 301263. PMID 7579708.
- ^ Gary R, Bretscher A (listopad 1993). "Heterotypická a homotypická asociace mezi ezrinem a moesinem, dvěma domnělými membránově-cytoskeletálními spojovacími proteiny". Proc. Natl. Acad. Sci. USA. 90 (22): 10846–50. doi:10.1073 / pnas.90.22.10846. PMC 47875. PMID 8248180.
- ^ Gautreau A, Poullet P, Louvard D, Arpin M (červen 1999). „Ezrin, linker plazmatické membrány a mikrofilamentu, signalizuje přežití buněk cestou fosfatidylinositol 3-kinázy / Akt“. Proc. Natl. Acad. Sci. USA. 96 (13): 7300–5. doi:10.1073 / pnas.96.13.7300. PMC 22080. PMID 10377409.
- ^ Mykkänen OM, Grönholm M, Rönty M, Lalowski M, Salmikangas P, Suila H, Carpén O (říjen 2001). „Charakterizace lidského palladinu, proteinu spojeného s mikrofilamenty“. Mol. Biol. Buňka. 12 (10): 3060–73. doi:10,1091 / mbc. 12.10.3060. PMC 60155. PMID 11598191.
- ^ Koltzscher M, Neumann C, König S, Gerke V (červen 2003). "Vazba závislá na Ca2 + a aktivace spícího ezrinu dimerním S100P". Mol. Biol. Buňka. 14 (6): 2372–84. doi:10,1091 / mbc.E02-09-0553. PMC 194886. PMID 12808036.
- ^ Granés F, Urena JM, Rocamora N, Vilaró S (duben 2000). „Ezrin spojuje syndekan-2 s cytoskeletem“. J. Cell Sci. 113 (7): 1267–76. PMID 10704377.
- ^ Brdicková N, Brdicka T, Andera L, Spicka J, Angelisová P, Milgram SL, Horejsí V (říjen 2001). „Interakce mezi dvěma adaptorovými proteiny, PAG a EBP50: možná vazba mezi membránovými rafty a aktinovým cytoskeletem“. FEBS Lett. 507 (2): 133–6. doi:10.1016 / s0014-5793 (01) 02955-6. PMID 11684085. S2CID 12676563.
- ^ Reczek D, Berryman M, Bretscher A (říjen 1997). „Identifikace EBP50: fosfoprotein obsahující PDZ, který se asociuje se členy rodiny ezrin-radixin-moesin“. J. Cell Biol. 139 (1): 169–79. doi:10.1083 / jcb.139.1.169. PMC 2139813. PMID 9314537.
- ^ Yun CH, Lamprecht G, Forster DV, Sidor A (říjen 1998). „Regulační protein NHE3 kináza A E3KARP váže hranici epiteliálního kartáče Na + / H + výměník NHE3 a cytoskeletální protein ezrin“. J. Biol. Chem. 273 (40): 25856–63. doi:10.1074 / jbc.273.40.25856. PMID 9748260.
- ^ Sitaraman SV, Wang L, Wong M, Bruewer M, Hobert M, Yun CH, Merlin D, Madara JL (září 2002). „Receptor adenosinu 2b je přijímán na plazmatickou membránu a při stimulaci agonisty se asociuje s E3KARP a Ezrin.“. J. Biol. Chem. 277 (36): 33188–95. doi:10,1074 / jbc.M202522200. PMID 12080047.
- ^ Barreiro O, Yanez-Mo M, Serrador JM, Montoya MC, Vicente-Manzanares M, Tejedor R, Furthmayr H, Sanchez-Madrid F (červen 2002). „Dynamická interakce VCAM-1 a ICAM-1 s moesinem a ezrinem v nové endoteliální dokovací struktuře pro adherentní leukocyty“. J. Cell Biol. 157 (7): 1233–45. doi:10.1083 / jcb.200112126. PMC 2173557. PMID 12082081.
Další čtení
- Martin TA, Harrison G, Mansel RE, Jiang WG (2004). "Role komplexu CD44 / ezrin v metastázování rakoviny". Krit. Reverend Oncol. Hematol. 46 (2): 165–86. doi:10.1016 / S1040-8428 (02) 00172-5. PMID 12711360.
| Tento článek o gen na lidský chromozom 6 je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |