Chemoterapie - Chemotherapy
| Chemoterapie | |
|---|---|
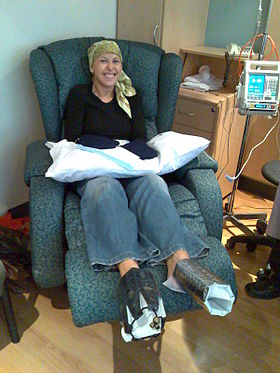 Žena, která je léčena docetaxel chemoterapie pro rakovina prsu. Na její ruce a nohy jsou umístěny chladné palčáky a studené botičky, aby se snížilo poškození nehtů. | |
| Ostatní jména | chemoterapie, CTX, CTx |
Chemoterapie (často zkráceno na chemoterapie a někdy CTX nebo CTx) je typ léčba rakoviny který používá jeden nebo více protinádorových léků (chemoterapeutická činidla ) jako součást standardizovaného režim chemoterapie. Chemoterapii lze podávat s a léčebný záměr (který téměř vždy zahrnuje kombinace léků), nebo může být zaměřen na prodloužení života nebo na zmírnit příznaky (paliativní chemoterapie). Chemoterapie je jednou z hlavních kategorií lékařského oboru, kterému se konkrétně věnuje farmakoterapie pro rakovina, který se nazývá lékařská onkologie.[1][2]
Termín chemoterapie došlo k nespecifickému použití intracelulárního jedy inhibovat mitóza (buněčné dělení) nebo vyvolat Poškození DNA, což je důvod, proč inhibice Oprava DNA může zvýšit chemoterapii.[3] Konotace slova chemoterapie vylučuje selektivnější látky, které blokují extracelulární signály (signální transdukce ). Vývoj terapií se specifickými molekulárními nebo genetickými cíli, které inhibují signály podporující růst od klasických endokrinních hormonů (především estrogeny pro rakovinu prsu a androgeny pro rakovinu prostaty) hormonální terapie. Naproti tomu další inhibice růstových signálů, jako jsou ty spojené s receptorové tyrosinkinázy jsou označovány jako cílená terapie.
Důležité je, že užívání drog (ať už chemoterapie, hormonální terapie nebo cílená léčba) představuje systémová terapie pro rakovinu v tom, že jsou zavedeny do krevního oběhu, a proto jsou v zásadě schopné řešit rakovinu v jakémkoli anatomickém místě v těle. Systémová terapie se často používá ve spojení s dalšími způsoby, které tvoří místní terapie (tj. léčba, jejíž účinnost je omezena na anatomickou oblast, kde se aplikují) na rakovinu, jako je radiační terapie, chirurgická operace nebo hypertermická terapie.
Tradiční chemoterapeutická činidla jsou cytotoxický prostřednictvím interference s buněčným dělením (mitóza), ale rakovinné buňky se velmi liší v jejich citlivosti na tyto látky. Chemoterapii lze do značné míry považovat za způsob poškození nebo stresových buněk, což může vést k buněčné smrti, pokud apoptóza je zahájeno. Lze vysledovat mnoho vedlejších účinků chemoterapie k poškození normálních buněk, které se rychle dělí a jsou tak citlivé na anti-mitotické léky: buňky v kostní dřeň, zažívací trakt a vlasové folikuly. To má za následek nejčastější vedlejší účinky chemoterapie: myelosuprese (snížená produkce krvinek, tedy také imunosuprese ), mukozitida (zánět sliznice trávicího traktu) a alopecie (ztráta vlasů). Kvůli účinku na imunitní buňky (zejména na lymfocyty) se chemoterapeutická léčiva často nacházejí v řadě nemocí, které jsou výsledkem škodlivé nadměrné aktivity imunitního systému proti sobě (tzv. autoimunita ). Tyto zahrnují revmatoidní artritida, systémový lupus erythematodes, roztroušená skleróza, vaskulitida a mnoho dalších.
Strategie léčby
V současné době existuje řada strategií při podávání chemoterapeutických léků. Chemoterapii lze podávat s a léčebný záměr nebo to může mít za cíl prodloužit život nebo zmírnit příznaky.
- Indukční chemoterapie je první linie léčby rakoviny chemoterapeutickým lékem. Tento typ chemoterapie se používá pro léčebný záměr.[1][6]:55–59
- Kombinovaná modalita chemoterapie je užívání drog s jinými léčba rakoviny, jako chirurgická operace, radiační terapie nebo hypertermická terapie.
- Konsolidační chemoterapie se podává po remisi, aby se prodloužil celkový čas bez onemocnění a zlepšilo celkové přežití. Podávaný lék je stejný jako lék, který dosáhl remise.[6]:55–59
- Intenzifikační chemoterapie je identická s konsolidační chemoterapií, ale používá se jiný lék než indukční chemoterapie.[6]:55–59
- Kombinovaná chemoterapie zahrnuje léčbu osoby řadou různých drog současně. Léky se liší mechanismem a vedlejšími účinky. Největší výhodou je minimalizace pravděpodobnosti vzniku odporu u kteréhokoli agenta. Léky lze také často používat v nižších dávkách, což snižuje toxicitu.[6]:55–59[7]:17–18[5]
- Neoadjuvant chemoterapie se podává před lokální léčbou, jako je chirurgický zákrok, a je navržena tak, aby zmenšovala primární nádor.[6]:55–59 Podává se také u rakoviny s vysokým rizikem mikrometastatického onemocnění.[8]:42
- Adjuvantní chemoterapie se podává po lokální léčbě (radioterapie nebo chirurgický zákrok). Lze jej použít, pokud existuje jen málo důkazů o rakovině, ale existuje riziko recidivy.[6]:55–59 Je také užitečný při zabíjení všech rakovinných buněk, které se rozšířily do dalších částí těla. Tyto mikrometastázy lze léčit adjuvantní chemoterapií a může snížit míru relapsu způsobenou těmito diseminovanými buňkami.[9]
- Udržovací chemoterapie je opakovaná léčba nízkými dávkami k prodloužení remise.[5][6]:55–59
- Záchranná chemoterapie nebo paliativní chemoterapie se podává bez léčebného záměru, ale pouze ke snížení nádorové zátěže a prodloužení průměrné délky života. U těchto režimů se obecně očekává lepší profil toxicity.[6]:55–59
Všechno režimy chemoterapie požadovat, aby příjemce byl schopen podstoupit léčbu. Stav výkonu se často používá jako měřítko k určení, zda osoba může podstoupit chemoterapii nebo zda je nutné snížit dávku. Protože při každém ošetření zemře jen zlomek buněk v nádoru (zlomkové zabití ) je nutné podávat opakované dávky, aby se pokračovalo ve zmenšování nádoru.[10] Současné režimy chemoterapie používají medikamentózní léčbu v cyklech, přičemž frekvence a trvání léčby jsou omezeny toxicitou.[11]
Účinnost
Účinnost chemoterapie závisí na typu rakoviny a stadiu. Celková účinnost se pohybuje od léčení u některých druhů rakoviny, jako jsou některé leukémie,[12][13] k neúčinnosti, například v některých mozkové nádory,[14] být zbytečný v ostatních, jako většina nemelanomové rakoviny kůže.[15]
Dávkování

Dávka chemoterapie může být obtížná: Pokud je dávka příliš nízká, bude proti nádoru neúčinná, zatímco při nadměrných dávkách toxicita (vedlejší efekty ) bude pro osobu, která ji přijímá, netolerovatelná.[4] Standardní metoda stanovení dávky chemoterapie je založena na vypočítané hodnotě povrch těla (BSA). BSA se obvykle počítá s matematickým vzorcem nebo a nomogram pomocí hmotnosti a výšky příjemce, spíše než přímým měřením plochy těla. Tento vzorec byl původně odvozen ve studii z roku 1916 a pokusil se převést léčivé dávky stanovené u laboratorních zvířat na ekvivalentní dávky pro člověka.[16] Studie zahrnovala pouze devět lidských subjektů.[17] Když byla v padesátých letech zavedena chemoterapie, byl vzorec BSA přijat jako oficiální standard pro dávkování chemoterapie pro nedostatek lepší možnosti.[18][19]
V poslední době byla zpochybněna platnost této metody při výpočtu jednotných dávek. Důvodem je to, že vzorec zohledňuje pouze váhu a výšku jednotlivce. Absorpce a clearance léku jsou ovlivňovány řadou faktorů, včetně věku, pohlaví, metabolismu, chorobného stavu, funkce orgánů, interakcí mezi léky, genetiky a obezity, které mají zásadní dopad na skutečnou koncentraci drogy v krevním řečišti. .[18][20][21] Výsledkem je vysoká variabilita koncentrace systémové chemoterapie u lidí, kterým byl podáván BSA, a tato variabilita byla u mnoha léků prokázána více než desetinásobně.[17][22] Jinými slovy, pokud dva lidé dostanou stejnou dávku daného léku na základě BSA, může být koncentrace tohoto léku v krvi jedné osoby 10krát vyšší nebo nižší ve srovnání s koncentrací druhé osoby.[22] Tato variabilita je typická pro mnoho chemoterapeutických léků dávkovaných BSA a, jak je ukázáno níže, byla prokázána ve studii 14 běžných chemoterapeutických léků.[17]
Výsledkem této farmakokinetické variability mezi lidmi je, že mnoho lidí nedostává správnou dávku k dosažení optimální účinnosti léčby s minimalizovanými toxickými vedlejšími účinky. Někteří lidé jsou předávkováni, zatímco jiní předávkováni.[18][20][21][23][24][25][26] Například v randomizované klinické studii výzkumníci zjistili, že 85% pacientů s metastatickým kolorektálním karcinomem léčených 5-fluorouracilem (5-FU) nedostalo optimální terapeutickou dávku, když bylo dávkováno podle standardu BSA - 68% bylo poddávkováno a 17% bylo předávkovaný.[23]
O použití BSA k výpočtu dávek chemoterapie pro lidi, kteří jsou, se vedla polemika obézní.[27] Kvůli jejich vyššímu BSA, lékaři často ze strachu před libovolně snižují dávku předepsanou vzorcem BSA předávkování.[27] V mnoha případech to může vést k suboptimální léčbě.[27]
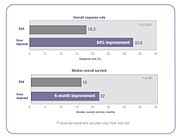
Několik klinických studií prokázalo, že když je dávkování chemoterapie individualizováno tak, aby bylo dosaženo optimální systémové expozice léčivu, jsou zlepšeny výsledky léčby a sníženy toxické vedlejší účinky.[23][25] Ve výše uvedené klinické studii 5-FU došlo u lidí, jejichž dávka byla upravena k dosažení předem stanovené cílové expozice, o 84% zlepšení míry odpovědi na léčbu a šestiměsíčního zlepšení celkového přežití (OS) ve srovnání s těmi, kteří dávkovali BSA .[23]


Ve stejné studii vyšetřovatelé srovnávali výskyt běžných toxicit stupně 3/4 asociovaných s 5-FU mezi osobami upravenými podle dávky a lidmi dávkovanými podle BSA.[23] Incidence oslabujících stupňů průjmu byla snížena z 18% ve skupině s BSA s dávkou na 4% ve skupině s upravenou dávkou a byly odstraněny závažné hematologické vedlejší účinky.[23] Kvůli snížené toxicitě byli pacienti s upravenou dávkou léčeni po delší dobu.[23] Lidé s dávkou BSA byli léčeni celkem 680 měsíců, zatímco lidé ve skupině s upravenou dávkou byli léčeni celkem 791 měsíců.[23] Dokončení léčby je důležitým faktorem pro dosažení lepších výsledků léčby.
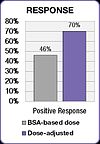
Podobné výsledky byly nalezeny ve studii zahrnující lidi s kolorektálním karcinomem, kteří byli léčeni populárními FOLFOX režim.[25] Výskyt závažného průjmu se snížil z 12% ve skupině pacientů s dávkováním BSA na 1,7% ve skupině s upravenou dávkou a výskyt závažné mukozitidy se snížil z 15% na 0,8%.[25]
Studie FOLFOX také prokázala zlepšení výsledků léčby.[25] Pozitivní odpověď se zvýšila ze 46% ve skupině s dávkováním BSA na 70% ve skupině s upravenou dávkou. Medián přežití bez progrese (PFS) a celkového přežití (OS) se ve skupině s upravenou dávkou zlepšily o šest měsíců.[25]
Jedním z přístupů, které mohou pomoci lékařům individualizovat dávkování chemoterapie, je měřit hladiny léčiva v krevní plazmě v průběhu času a upravit dávku podle vzorce nebo algoritmu tak, aby bylo dosaženo optimální expozice. Se stanovenou cílovou expozicí pro optimalizovanou účinnost léčby s minimalizovanou toxicitou lze dávkování přizpůsobit tak, aby bylo dosaženo cílové expozice a optimálních výsledků pro každou osobu. Takový algoritmus byl použit ve výše uvedených klinických studiích a vedl k významně zlepšeným výsledkům léčby.
Onkologové již individualizují dávkování některých léků proti rakovině na základě expozice. Karboplatina[28]:4 a busulfan[29][30] dávkování závisí na výsledcích krevních testů pro výpočet optimální dávky pro každou osobu. K dispozici jsou také jednoduché krevní testy pro optimalizaci dávky methotrexát,[31] 5-FU, paclitaxel, a docetaxel.[32][33]
Hladina sérového albuminu bezprostředně před podáním chemoterapie je nezávislým prognostickým prediktorem přežití u různých typů rakoviny.[34]
Typy

Alkylační činidla
Alkylační činidla jsou dnes nejstarší skupinou chemoterapeutik. Původně odvozeno od hořčičný plyn použito v první světová válka, nyní se používá mnoho typů alkylačních činidel.[4] Jsou tak pojmenovaní kvůli své schopnosti alkylovat mnoho molekul, včetně bílkoviny, RNA a DNA. Tato schopnost vázat kovalentně k DNA prostřednictvím jejich alkylová skupina je primární příčinou jejich protirakovinných účinků.[36] DNA je vyrobena ze dvou řetězců a molekuly se mohou buď vázat dvakrát na jedno vlákno DNA (intrastrand crosslink), nebo se mohou vázat jednou na oba řetězce (interstrand crosslink). Pokud se buňka pokusí replikovat zesítěnou DNA během buněčné dělení nebo se to pokusí opravit, mohou se řetězce DNA zlomit. To vede k formě programované buněčné smrti zvané apoptóza.[35][37] Alkylační činidla budou fungovat v jakémkoli bodě buněčného cyklu, a proto jsou známá jako léčiva nezávislá na buněčném cyklu. Z tohoto důvodu je účinek na buňku závislý na dávce; podíl buněk, které odumírají, je přímo úměrný dávce léčiva.[38]
Podtypy alkylačních činidel jsou dusíkaté hořčice, nitrosomočoviny, tetraziny, aziridiny,[39] cisplatiny a deriváty a neklasická alkylační činidla. Dusíkaté hořčice zahrnují mechlorethamin, cyklofosfamid, melfalan, chlorambucil, ifosfamid a busulfan. Nitrosomočoviny zahrnují N-Nitroso-N-methylmočovina (MNU), karmustin (BCNU), lomustine (CCNU) a semustine (MeCCNU), fotemustine a streptozotocin. Mezi tetraziny patří dakarbazin, mitozolomid a temozolomid. Aziridiny zahrnují thiotepa, mytomycin a diaziquon (AZQ). Cisplatina a deriváty zahrnují cisplatina, karboplatina a oxaliplatina.[36][37] Snižují funkci buněk tvorbou kovalentní vazby s amino, karboxyl, sulfhydryl, a fosfátové skupiny v biologicky důležitých molekulách.[40] Mezi neklasická alkylační činidla patří prokarbazin a hexamethylmelamin.[36][37]
Antimetabolity

Antimetabolity jsou skupina molekul, které brání syntéze DNA a RNA. Mnoho z nich má podobnou strukturu jako stavební kameny DNA a RNA. Stavební kameny jsou nukleotidy; molekula obsahující a nukleobáze, cukr a fosfátová skupina. Nukleové báze se dělí na puriny (guanin a adenin ) a pyrimidiny (cytosin, tymin a uracil ). Antimetabolity se podobají buď nukleobázím nebo nukleosidům (nukleotid bez fosfátové skupiny), ale změnily se chemické skupiny.[41] Tyto léky působí buď blokováním enzymů potřebných pro syntézu DNA, nebo zabudováním do DNA nebo RNA. Inhibicí enzymů zapojených do syntézy DNA zabraňují mitóze, protože DNA se nemůže duplikovat. Také po nesprávném zabudování molekul do DNA Poškození DNA může dojít a naprogramovaná buněčná smrt (apoptóza ) je indukován. Na rozdíl od alkylačních látek jsou antimetabolity závislé na buněčném cyklu. To znamená, že v tomto případě fungují pouze během určité části buněčného cyklu S-fáze (fáze syntézy DNA). Z tohoto důvodu při určité dávce dochází při vyšších dávkách k efektu plošin a úměrně k dalšímu odumírání buněk. Podtypy antimetabolitů jsou anti-foláty, fluoropyrimidiny, deoxynukleosidové analogy a thiopuriny.[36][41]
Mezi anti-foláty patří methotrexát a pemetrexed. Methotrexát inhibuje dihydrofolát reduktáza (DHFR), enzym, který se regeneruje tetrahydrofolát z dihydrofolát. Když je enzym inhibován methotrexátem, buněčné hladiny folátových koenzymů se snižují. Ty jsou nutné pro thymidylát a produkce purinu, které jsou nezbytné pro syntézu DNA a dělení buněk.[6]:55–59[7]:11 Pemetrexed je další antimetabolit, který ovlivňuje produkci purinu a pyrimidinu, a proto také inhibuje syntézu DNA. Primárně inhibuje enzym thymidylát syntáza, ale má také účinky na DHFR, aminoimidazolkarboxamid ribonukleotid formyltransferázu a glycinamid ribonukleotid formyltransferáza.[42] Mezi fluoropyrimidiny patří fluorouracil a kapecitabin. Fluorouracil je analog nukleobáze, který je metabolizován v buňkách za vzniku alespoň dvou aktivních produktů; 5-fluorouridinmonofosfát (FUMP) a 5-fluor-2'-deoxyuridin 5'-fosfát (fdUMP). FUMP se začleňuje do RNA a fdUMP inhibuje enzym thymidylát syntázu; oba vedou k buněčné smrti.[7]:11 Kapecitabin je a proléčivo 5-fluorouracilu, který se štěpí v buňkách za vzniku účinné látky.[43] Mezi deoxynukleosidové analogy patří cytarabin, gemcitabin, decitabin, azacitidin, fludarabin, nelarabin, kladribin, klofarabin, a pentostatin. Mezi thiopuriny patří thioguanin a merkaptopurin.[36][41]
Antimikrotubulární látky

Antimikrotubulární látky jsou rostlina -odvozené chemikálie, které zabraňují buněčnému dělení mikrotubul funkce. Mikrotubuly jsou důležitou buněčnou strukturou složenou ze dvou proteinů, α-tubulin a β-tubulin. Jsou to duté tyčinkovité struktury, které jsou mimo jiné nutné pro buněčné dělení.[44] Mikrotubuly jsou dynamické struktury, což znamená, že jsou trvale ve stavu montáže a demontáže. Vinca alkaloidy a taxany jsou dvě hlavní skupiny anti-mikrotubulárních látek, a přestože obě tyto skupiny léčiv způsobují dysfunkci mikrotubulů, jejich mechanismy působení jsou zcela opačné: Vinca alkaloidy zabraňují hromadění mikrotubulů, zatímco taxany zabraňují jejich rozložení. Tím zabraňují rakovinovým buňkám dokončit mitózu. Poté nastane zástava buněčného cyklu, která indukuje programovanou buněčnou smrt (apoptóza ).[36][45] Tyto léky mohou také ovlivnit růst krevních cév, základní proces, který nádory využívají k růstu a metastázování.[45]
Vinca alkaloidy jsou odvozeny od Madagaskarský brčál, Catharanthus roseus,[46][47] dříve známý jako Vinca rosea. Váží se na specifická místa na tubulinu a inhibují shlukování tubulinu do mikrotubulů. Originál vinca alkaloidy jsou přírodní produkty které zahrnují vinkristin a vinblastin.[48][49][50][51] Po úspěchu těchto léků, polosyntetické vinca alkaloidy byly vyrobeny: vinorelbin (používá se při léčbě nemalobuněčný karcinom plic[50][52][53]), vindesin, a vinflunin.[45] Tyto léky jsou buněčný cyklus -charakteristický. Váží se na molekuly tubulinu S-fáze a zabránit správné tvorbě mikrotubulů potřebné pro M-fáze.[38]
Taxany jsou přírodní a polosyntetické léky. První droga jejich třídy, paclitaxel, byl původně extrahován z Taxus brevifolia, tichomořský tis. Nyní tato droga a další v této třídě, docetaxel, se vyrábějí polosynteticky z chemikálie nalezené v kůře jiného tisu, Taxus baccata.
Podofylotoxin je antineoplastický lignan získané primárně z Americký mayapple (Podophyllum peltatum) a Himálajský maypple (Sinopodophyllum hexandrum). Má anti-mikrotubulární aktivitu a její mechanismus je podobný mechanismu vinca alkaloidy v tom, že se váží na tubulin a inhibují tvorbu mikrotubulů. Podophyllotoxin se používá k výrobě dvou dalších léků s různými mechanismy účinku: etoposid a teniposid.[54][55]
Inhibitory topoizomerázy

Inhibitory topoizomerázy jsou léky, které ovlivňují aktivitu dvou enzymů: topoizomeráza I a topoizomeráza II. Když se odvíjí dvouřetězcová spirála DNA, během replikace DNA nebo transkripce například sousední neotevřená DNA se větší těsněji (nadzávitnice), jako když se otevírá střed zkrouceného lana. Stres způsobený tímto účinkem částečně podporují enzymy topoizomerázy. Produkují jedno- nebo dvouvláknové zlomy do DNA, čímž snižují napětí v řetězci DNA. To umožňuje normální odvíjení DNA během replikace nebo přepis. Inhibice topoizomerázy I nebo II interferuje s oběma těmito procesy.[56][57]
Dva inhibitory topoizomerázy I, irinotekan a topotekan, jsou polosynteticky odvozeny od kamptotecin, který se získává z čínského okrasného stromu Camptotheca acuminata.[38] Léky zaměřené na topoizomerázu II lze rozdělit do dvou skupin. Jedy topoizomerázy II způsobují zvýšené hladiny enzymů vázaných na DNA. Tím se zabrání replikaci DNA a transkripce, způsobuje přerušení řetězce DNA a vede k programované buněčné smrti (apoptóza ). Mezi tyto agenty patří etoposid, doxorubicin, mitoxantron a teniposid. Druhá skupina, katalytické inhibitory, jsou léky, které blokují aktivitu topoizomerázy II, a proto zabraňují syntéze a translaci DNA, protože DNA se nemůže správně uvolnit. Tato skupina zahrnuje novobiocin, merbarone a aclarubicin, které mají také další významné mechanismy působení.[58]
Cytotoxická antibiotika
Cytotoxický antibiotika jsou různorodá skupina léků, které mají různé mechanismy účinku. Společným tématem, které sdílejí při indikaci chemoterapie, je to, že ho přerušují buněčné dělení. Nejdůležitější podskupinou je antracykliny a bleomyciny; další prominentní příklady zahrnují mitomycin C. a aktinomycin.[59]
Mezi antracykliny doxorubicin a daunorubicin byly první a byly získány z bakterie Streptomyces peucetius.[60] Deriváty těchto sloučenin zahrnují epirubicin a idarubicin. Další klinicky používané léky ve skupině s antracykliny jsou pirarubicin, aclarubicin, a mitoxantron.[61] Mezi mechanismy antracyklinů patří Interkalace DNA (molekuly se vloží mezi dva řetězce DNA), tvorba vysoce reaktivních volné radikály které poškozují mezibuněčné molekuly a inhibici topoizomerázy.[62]
Actinomycin je komplexní molekula, která interkaluje DNA a brání Syntéza RNA.[63]
Bleomycin, a glykopeptid izolovaný od Streptomyces verticillus, také interkaluje DNA, ale produkuje volné radikály které poškozují DNA. K tomu dochází, když se bleomycin váže na a ion kovu se stává chemicky redukován a reaguje s kyslík.[64][6]:87
Mitomycin je cytotoxické antibiotikum se schopností alkylovat DNA.[65]
dodávka

Většina chemoterapie je doručeno intravenózně, ačkoli řada látek může být podávána orálně (např. melfalan, busulfan, kapecitabin ). Podle nedávného (2016) systematického přehledu představují orální terapie další výzvy pro pacienty a týmy péče o udržení a podporu dodržování léčebných plánů.[66]
Existuje mnoho intravenózních metod podávání léků, známých jako vaskulární přístupová zařízení. Mezi ně patří okřídlené infuzní zařízení, periferní žilní katétr, katétr střední čáry, periferně zavedený centrální katétr (PICC), centrální žilní katétr a implantovatelný port. Zařízení mají různá použití, pokud jde o délku chemoterapie, způsob podávání a typy chemoterapeutik.[7]:94–95
V závislosti na osobě, rakovině, stadiu rakoviny, typu chemoterapie a dávce může být intravenózní chemoterapie podávána buď lůžkový nebo ambulantní základ. Pro kontinuální, časté nebo prodloužené intravenózní podávání chemoterapie mohou být chirurgicky zavedeny různé systémy do vaskulatury, aby byl zachován přístup.[7]:113–118 Běžně používané systémy jsou Hickmanova linie, Port-a-Cath a Řádek PICC. Mají nižší riziko infekce, jsou mnohem méně náchylné k flebitida nebo extravazace a eliminovat potřebu opakovaného zavádění periferních kanyl.[Citace je zapotřebí ]
Izolovaná perfuze končetin (často se používá v melanom ),[67] nebo izolovaná infuze chemoterapie do jater[68] nebo plíce byly použity k léčbě některých nádorů. Hlavním účelem těchto přístupů je podat velmi vysokou dávku chemoterapie do nádorových míst, aniž by došlo k ohromnému systémovému poškození.[69] Tyto přístupy mohou pomoci kontrolovat solitární nebo omezené metastázy, ale ze své podstaty nejsou systémové, a proto neléčí distribuované metastázy nebo mikrometastázy.
Místní chemoterapie, jako je 5-fluorouracil, se používají k léčbě některých případů nemelanomový karcinom kůže.[70]
Pokud má rakovina centrální nervový systém postižení nebo meningeální onemocnění, intratekální může být podána chemoterapie.[4]
Nepříznivé účinky
Chemoterapeutické techniky mají řadu vedlejších účinků, které závisí na typu použitých léků. Nejběžnější léky ovlivňují hlavně rychle se dělící buňky těla, jako jsou krvinky a buňky lemující ústa, žaludek a střeva. Toxicita související s chemoterapií se může objevit akutně po podání, během několika hodin nebo dnů, nebo chronicky, od týdnů do let.[6]:265
Imunosuprese a myelosuprese
Prakticky všechny chemoterapeutické režimy mohou způsobit depresi imunitní systém, často paralyzováním kostní dřeň a vedoucí k poklesu o bílé krvinky, červené krvinky, a krevní destičky.Anémie a trombocytopenie může vyžadovat krevní transfúze. Neutropenie (pokles o neutrofilní granulocyty počet pod 0,5 x 109/litr ) lze vylepšit syntetikou G-CSF (granulocyty - faktor stimulující kolonii, např. filgrastim, lenograstim ).
Velmi těžké myelosuprese, který se vyskytuje u některých režimů, téměř u celé kostní dřeně kmenové buňky (buňky, které produkují bílý a červené krvinky ) jsou zničeny, což znamená alogenní nebo autologní transplantace buněk kostní dřeně jsou nutné. (U autologních BMT jsou buňky odebrány osobě před ošetřením, rozmnoženy a poté znovu injikovány; v alogenní BMT, jejichž zdrojem je dárce.) Někteří lidé však kvůli této interferenci s kostní dření stále vyvíjejí nemoci.[Citace je zapotřebí ]
Přestože se lidem, kteří dostávají chemoterapii, doporučuje, aby si umyli ruce, vyhýbali se nemocným lidem a podnikli další kroky ke snížení infekce, přibližně 85% infekcí je způsobeno přirozeně se vyskytujícími mikroorganismy ve vlastní osobě gastrointestinální trakt (počítaje v to ústní dutina ) a kůže.[71]:130 To se může projevit jako systémové infekce, jako je sepse nebo jako lokalizovaná ohniska, jako je Herpes simplex, pásový opar nebo jiní členové Herpesviridea.[72] Riziko nemoci a smrti lze snížit užíváním běžných antibiotik, jako je chinolony nebo trimethoprim / sulfamethoxazol než se objeví horečka nebo známky infekce.[73] Chinolony vykazují účinnou profylaxi hlavně u hematologické rakoviny.[73] Obecně však lze zabránit jedné horečce u každých pěti lidí, kteří jsou po chemoterapii imunosuprimovaní a užívají antibiotika; na každých 34, kteří užívají antibiotika, lze zabránit jedné smrti.[73] Někdy se chemoterapie odkládá, protože imunitní systém je potlačen na kriticky nízkou úroveň.
v Japonsko, vláda schválila použití některých léčivé houby jako Trametes versicolor, působit proti depresi imunitního systému u lidí podstupujících chemoterapii.[74]
Neutropenická enterokolitida
Kvůli potlačení imunitního systému neutropenická enterokolitida (typhlitis) je „život ohrožující gastrointestinální komplikace chemoterapie“.[75] Typhlitis je střevní infekce, která se může projevit příznaky včetně nevolnost, zvracení, průjem, a rozšířené břicho, horečka, zimnice nebo bolest břicha a něhu.
Typhlitis je zdravotnická pohotovost. Má velmi chudé prognóza a je často fatální, pokud není rychle rozpoznán a agresivně zacházen.[76] Úspěšná léčba závisí na včasné diagnóze poskytované vysokým indexem podezření a použitím CT, nefunkční léčba pro nekomplikované případy a někdy volitelným právem hemikolektomie aby se zabránilo opakování.[76]
Gastrointestinální potíže
Nevolnost, zvracení, anorexie, průjem, břišní křeče a zácpa jsou běžné vedlejší účinky chemoterapeutických léků, které ničí rychle se dělící buňky.[77] Podvýživa a dehydratace může dojít, když příjemce nejí a nepije dostatečně, nebo když osoba často zvrací kvůli poškození trávicího traktu. To může vést k rychlému úbytku hmotnosti nebo příležitostně ke zvýšení hmotnosti, pokud člověk sní příliš mnoho ve snaze zmírnit nevolnost nebo pálení žáhy. Přírůstek hmotnosti může být také způsoben některými steroidními léky. Tyto vedlejší účinky lze často snížit nebo eliminovat pomocí antiemetikum léky. Důkazy nízké jistoty rovněž naznačují, že probiotika mohou mít preventivní a léčebný účinek na průjem související se samotnou chemoterapií a s radioterapií.[78] Nicméně vysoká index podezření je vhodné, protože průjem a nadýmání jsou také příznaky typhlitis, velmi vážný a potenciálně život ohrožující zdravotnická pohotovost to vyžaduje okamžitou léčbu.
Anémie
Anémie může být kombinovaným výsledkem způsobeným myelosupresivní chemoterapií a možnými příčinami souvisejícími s rakovinou, jako je krvácející, krvinka zničení (hemolýza ), dědičné onemocnění, dysfunkce ledvin, nutriční nedostatky nebo anémie chronických onemocnění. Léčba ke zmírnění anémie zahrnuje hormony ke zvýšení produkce krve (erytropoetin ), doplňky železa, a krevní transfuze.[79][80][81] Myelosupresivní léčba může způsobit sklon ke snadnému krvácení, což vede k anémii. Léky, které zabíjejí rychle se dělící buňky nebo krevní buňky, mohou snížit počet krevní destičky v krvi, což může mít za následek modřiny a krvácející. Může být dočasně zvýšen extrémně nízký počet krevních destiček transfuze krevních destiček a vyvíjejí se nové léky ke zvýšení počtu krevních destiček během chemoterapie.[82][83][84][85] Někdy se chemoterapie odkládá, aby se počet trombocytů obnovil.
Únava může být důsledkem rakoviny nebo její léčby a může trvat měsíce až roky po léčbě. Jednou z fyziologických příčin únavy je anémie, které mohou být způsobeny chemoterapií, chirurgická operace, radioterapie, primární a metastatické onemocnění nebo vyčerpání výživy.[86][87] Aerobní cvičení bylo zjištěno, že je prospěšné při snižování únavy u lidí s solidní nádory.[88]
Nevolnost a zvracení
Nevolnost a zvracení jsou dva z nejobávanějších vedlejších účinků léčby rakoviny u lidí s rakovinou a jejich rodin. V roce 1983 Coates a kol. zjistili, že lidé podstupující chemoterapii hodnotili nevolnost a zvracení jako první a druhý nejzávažnější vedlejší účinek. Až 20% lidí, kteří v této době dostávali vysoce emetogenní látky, odložilo nebo dokonce odmítlo potenciálně léčivou léčbu.[89] Nevolnost a zvracení vyvolané chemoterapií (CINV) jsou běžné u mnoha způsobů léčby a některých forem rakoviny. Od 90. Let několik nových tříd antiemetika byly vyvinuty a komercializovány a stávají se téměř univerzálním standardem v režimech chemoterapie a pomáhají úspěšně zvládat tyto příznaky u mnoha lidí. Účinné zprostředkování těchto nepříjemných a někdy ochromujících příznaků má za následek zvýšení kvality života příjemce a efektivnější léčebné cykly, kvůli menšímu přerušení léčby kvůli lepší toleranci a lepšímu celkovému zdraví.
Ztráta vlasů
Ztráta vlasů (alopecie) může být způsobena chemoterapií, která ničí rychle se dělící buňky; jiné léky mohou způsobit řídnutí vlasů. Nejčastěji se jedná o dočasné účinky: vlasy obvykle začnou znovu růst několik týdnů po posledním ošetření, ale někdy se změnou barvy, textury, tloušťky nebo stylu. Někdy mají vlasy tendenci kroutit se po opětovném růstu, což vede k „chemickým vlnám“. K výraznému vypadávání vlasů dochází nejčastěji u drog, jako je doxorubicin, daunorubicin, paclitaxel, docetaxel, cyklofosfamid, ifosfamid a etoposid. Trvalé ztenčení nebo vypadávání vlasů může být důsledkem některých standardních režimů chemoterapie.
Ztráta vlasů vyvolaná chemoterapií nastává neandrogenním mechanismem a může se projevit jako alopecia totalis, telogen effluvium nebo méně často alopecia areata.[90] Obvykle je spojena se systémovou léčbou kvůli vysoké mitotické rychlosti vlasových folikulů a je reverzibilnější než androgenní vypadávání vlasů,[91][92] i když mohou nastat trvalé případy.[93] Chemoterapie vyvolává vypadávání vlasů u žen častěji než u mužů.[94]
Chlazení pokožky hlavy nabízí prostředky k prevenci trvalého i dočasného vypadávání vlasů; byly však vzneseny obavy z této metody.[95][96]
Sekundární novotvar
Může dojít k rozvoji sekundární neoplazie po úspěšné chemoterapii nebo radioterapii. Nejčastější sekundární novotvar je sekundární akutní myeloidní leukémie, která se vyvíjí primárně po léčbě alkylačními látkami nebo inhibitory topoizomerázy.[97] Přeživší z dětská rakovina je více než 13krát vyšší pravděpodobnost, že sekundární novotvar během 30 let po léčbě než u běžné populace.[98] Ne všechno toto zvýšení lze připsat chemoterapii.
Neplodnost
Některé typy chemoterapie jsou gonadotoxické a mohou způsobit neplodnost.[99] Mezi chemoterapie s vysokým rizikem patří prokarbazin a další alkylační léky, jako je cyklofosfamid, ifosfamid, busulfan, melfalan, chlorambucil a chlormethin.[99] Mezi léky se středním rizikem patří doxorubicin a analogy platiny, jako je cisplatina a karboplatina.[99] Na druhou stranu terapie s nízkým rizikem gonadotoxicity zahrnují rostlinné deriváty, jako je vinkristin a vinblastin, antibiotika jako je bleomycin a daktinomycin a antimetabolity, jako je methotrexát, merkaptopurin a 5-fluoruracil.[99]
Ženská neplodnost chemoterapií se zdá být sekundární předčasné selhání vaječníků ztrátou prvotní folikuly.[100] Tato ztráta nemusí být nutně přímým účinkem chemoterapeutických látek, ale může být způsobena zvýšenou rychlostí iniciace růstu, která nahradí poškozené vyvíjející se folikuly.[100]
Lidé si mohou vybrat mezi několika způsoby zachování plodnosti před chemoterapií, včetně kryokonzervace spermatu, ovariální tkáně, oocytů nebo embryí.[101] Jelikož více než polovina pacientů s rakovinou jsou starší lidé, je tento nežádoucí účinek relevantní pouze pro menšinu pacientů. Studie ve Francii v letech 1999 až 2011 dospěla k závěru, že zmrazení embryí před podáním gonadotoxických látek ženám způsobilo zpoždění léčby v 34% případů a živé narození u 27% přeživších případů, které chtěly otěhotnět, s doba sledování se pohybuje mezi 1 a 13 lety.[102]
Mezi potenciální ochranné nebo tlumící látky patří Analogy GnRH, kde několik studií prokázalo ochranný účinek in vivo u lidí, ale některé studie žádný takový účinek neukazují. Sfingosin-1-fosfát (S1P) vykazuje podobný účinek, ale jeho mechanismus inhibice sfingomyelinová apoptotická cesta může také zasahovat do apoptóza působení chemoterapeutických léků.[103]
V chemoterapii jako a kondiční režim při transplantaci hematopoetických kmenových buněk dospěla studie lidí s podmíněným samotným cyklofosfamidem k léčbě těžké aplastické anémie k závěru, že k obnově vaječníků došlo u všech žen mladších 26 let v době transplantace, ale pouze u pěti ze 16 žen starších 26 let.[104]
Teratogenita
Chemoterapie je teratogenní v době těhotenství, zejména během první trimestr, do té míry, že potrat obvykle se doporučuje, pokud je těhotenství v tomto období zjištěno během chemoterapie.[105] Second- and third-trimester exposure does not usually increase the teratogenic risk and adverse effects on cognitive development, but it may increase the risk of various komplikace těhotenství and fetal myelosuppression.[105]
In males previously having undergone chemotherapy or radiotherapy, there appears to be no increase in genetic defects or congenital malformations in their children conceived after therapy.[105] Použití assisted reproductive technologies a micromanipulation techniques might increase this risk.[105] In females previously having undergone chemotherapy, miscarriage and congenital malformations are not increased in subsequent conceptions.[105] Kdy však oplodnění in vitro a kryokonzervace embrya is practised between or shortly after treatment, possible genetic risks to the growing oocytes exist, and hence it has been recommended that the babies be screened.[105]
Periferní neuropatie
Between 30 and 40 percent of people undergoing chemotherapy experience chemoterapií vyvolaná periferní neuropatie (CIPN), a progressive, enduring, and often irreversible condition, causing pain, tingling, numbness and sensitivity to cold, beginning in the hands and feet and sometimes progressing to the arms and legs.[106] Chemotherapy drugs associated with CIPN include thalidomid, epothilony, vinca alkaloids, taxanes, inhibitory proteazomu, and the platinum-based drugs.[106][107] Whether CIPN arises, and to what degree, is determined by the choice of drug, duration of use, the total amount consumed and whether the person already has periferní neuropatie. Though the symptoms are mainly sensory, in some cases motorické nervy a autonomní nervový systém are affected.[108] CIPN often follows the first chemotherapy dose and increases in severity as treatment continues, but this progression usually levels off at completion of treatment. The platinum-based drugs are the exception; with these drugs, sensation may continue to deteriorate for several months after the end of treatment.[109] Some CIPN appears to be irreversible.[109] Pain can often be managed with drug or other treatment but the numbness is usually resistant to treatment.[110]
Cognitive impairment
Some people receiving chemotherapy report fatigue or non-specific neurocognitive problems, such as an inability to concentrate; this is sometimes called kognitivní porucha po chemoterapii, referred to as "chemo brain" in popular and social media.[111]
Tumor lysis syndrome
In particularly large tumors and cancers with high white cell counts, jako lymfomy, teratomy, a nějaký leukémie, some people develop syndrom rozpadu nádoru. The rapid breakdown of cancer cells causes the release of chemicals from the inside of the cells. Following this, high levels of kyselina močová, draslík a fosfát are found in the blood. High levels of phosphate induce secondary hypoparathyroidism, resulting in low levels of calcium in the blood. This causes kidney damage and the high levels of potassium can cause srdeční arytmie. Although prophylaxis is available and is often initiated in people with large tumors, this is a dangerous side-effect that can lead to death if left untreated.[7]:202
Organ damage
Kardiotoxicita (heart damage) is especially prominent with the use of anthracycline drugs (doxorubicin, epirubicin, idarubicin, a liposomální doxorubicin ). The cause of this is most likely due to the production of volné radikály in the cell and subsequent Poškození DNA. Other chemotherapeutic agents that cause cardiotoxicity, but at a lower incidence, are cyklofosfamid, docetaxel a clofarabine.[112]
Hepatotoxicita (liver damage) can be caused by many cytotoxic drugs. The susceptibility of an individual to liver damage can be altered by other factors such as the cancer itself, virová hepatitida, imunosuprese a nedostatek výživy. The liver damage can consist of damage to liver cells, hepatic sinusoidal syndrome (obstruction of the veins in the liver), cholestáza (where bile does not flow from the liver to the intestine) and fibróza jater.[113][114]
Nefrotoxicita (kidney damage) can be caused by syndrom rozpadu nádoru and also due direct effects of drug clearance by the kidneys. Different drugs will affect different parts of the kidney and the toxicity may be bez příznaků (only seen on blood or urine tests) or may cause akutní poškození ledvin.[115][116]
Ototoxicita (damage to the inner ear) is a common side effect of platinum based drugs that can produce symptoms such as dizziness and závrať.[117][118] Children treated with platinum analogues have been found to be at risk for developing hearing loss.[119][120][121]
Other side-effects
Less common side-effects include red skin (erytém ), dry skin, damaged fingernails, a dry mouth (xerostomia ), zadržování vody, a sexuální impotence. Some medications can trigger alergický nebo pseudoallergic reakce.
Specific chemotherapeutic agents are associated with organ-specific toxicities, including kardiovaskulární onemocnění (např., doxorubicin ), interstitial lung disease (např., bleomycin ) and occasionally secondary neoplasm (např., MOPP therapy for Hodgkin's disease).
Syndrom ruka-noha is another side effect to cytotoxic chemotherapy.
Nutritional problems are also frequently seen in cancer patients at diagnosis and through chemotherapy treatment. Research suggests that in children and young people undergoing cancer treatment, parenterální výživa may help with this leading to weight gain and increased calorie and protein intake, when compared to enteral nutrition.[122]
Omezení
Chemotherapy does not always work, and even when it is useful, it may not completely destroy the cancer. People frequently fail to understand its limitations. In one study of people who had been newly diagnosed with incurable, stage 4 cancer, more than two-thirds of people with lung cancer and more than four-fifths of people with colorectal cancer still believed that chemotherapy was likely to cure their cancer.[123]
The hematoencefalická bariéra poses an obstacle to delivery of chemotherapy to the mozek. This is because the brain has an extensive system in place to protect it from harmful chemicals. Drug transporters can pump out drugs from the brain and brain's blood vessel cells into the mozkomíšní mok and blood circulation. These transporters pump out most chemotherapy drugs, which reduces their efficacy for treatment of brain tumors. Only small lipofilní alkylating agents jako lomustine nebo temozolomide are able to cross this blood–brain barrier.[124][125][126]
Cévy in tumors are very different from those seen in normal tissues. As a tumor grows, tumor cells furthest away from the blood vessels become low in oxygen (hypoxický ). To counteract this they then signal for new blood vessels to grow. The newly formed tumor vasculature is poorly formed and does not deliver an adequate blood supply to all areas of the tumor. This leads to issues with drug delivery because many drugs will be delivered to the tumor by the oběhový systém.[127]
Odpor
Odpor is a major cause of treatment failure in chemotherapeutic drugs. There are a few possible causes of resistance in cancer, one of which is the presence of small pumps on the surface of cancer cells that actively move chemotherapy from inside the cell to the outside. Cancer cells produce high amounts of these pumps, known as p-glykoprotein, in order to protect themselves from chemotherapeutics. Výzkum v oblasti p-glykoprotein and other such chemotherapy efflux pumps is currently ongoing. Medications to inhibit the function of p-glykoprotein are undergoing investigation, but due to toxicities and interactions with anti-cancer drugs their development has been difficult.[128][129] Another mechanism of resistance is genová amplifikace, a process in which multiple copies of a gene are produced by cancer cells. This overcomes the effect of drugs that reduce the expression of genes involved in replication. With more copies of the gene, the drug can not prevent all expression of the gene and therefore the cell can restore its proliferative ability. Cancer cells can also cause defects in the cellular pathways of apoptóza (programovaná buněčná smrt). As most chemotherapy drugs kill cancer cells in this manner, defective apoptosis allows survival of these cells, making them resistant. Many chemotherapy drugs also cause DNA damage, which can be repaired by enzymy in the cell that carry out Oprava DNA. Upregulation of these genes can overcome the DNA damage and prevent the induction of apoptosis. Mutations in genes that produce drug target proteins, such as tubulin, can occur which prevent the drugs from binding to the protein, leading to resistance to these types of drugs.[130] Drugs used in chemotherapy can induce cell stress, which can kill a cancer cell; however, under certain conditions, cells stress can induce changes in gene expression that enables resistance to several types of drugs.[131] v rakovina plic, the transcription factor NFκB is thought to play a role in resistance to chemotherapy, via inflammatory pathways.[132][133][134]
Cytotoxics and targeted therapies
Cílené terapie are a relatively new class of cancer drugs that can overcome many of the issues seen with the use of cytotoxics. They are divided into two groups: small molecule and antibodies. The massive toxicity seen with the use of cytotoxics is due to the lack of cell specificity of the drugs. They will kill any rapidly dividing cell, tumor or normal. Targeted therapies are designed to affect cellular proteins or processes that are utilised by the cancer cells. This allows a high dose to cancer tissues with a relatively low dose to other tissues. Ačkoliv vedlejší efekty are often less severe than that seen of cytotoxic chemotherapeutics, life-threatening effects can occur. Initially, the targeted therapeutics were supposed to be solely selective for one protein. Now it is clear that there is often a range of protein targets that the drug can bind. An example target for targeted therapy is the BCR-ABL1 protein produced from the Philadelphia chromozom, a genetic lesion found commonly in chronická myelogenní leukémie and in some patients with akutní lymfoblastická leukémie. Tento fusion protein has enzyme activity that can be inhibited by imatinib, a malá molekula lék.[135][136][137][138]
Mechanismus účinku

Rakovina is the uncontrolled growth of buňky coupled with zhoubný behaviour: invasion and metastáza (among other features).[139] It is caused by the interaction between genetický susceptibility and environmental factors.[140][141] These factors lead to accumulations of genetické mutace v onkogeny (genes that control the growth rate of cells) and tumor suppressor genes (genes that help to prevent cancer), which gives cancer cells their malignant characteristics, such as uncontrolled growth.[142]:93–94
In the broad sense, most chemotherapeutic drugs work by impairing mitóza (buněčné dělení ), effectively targeting fast-dividing cells. As these drugs cause damage to cells, they are termed cytotoxický. They prevent mitosis by various mechanisms including damaging DNA and inhibition of the cellular machinery involved in cell division.[38][143] One theory as to why these drugs kill cancer cells is that they induce a programmed form of cell death known as apoptóza.[144]
As chemotherapy affects cell division, tumors with high tempo růstu (jako acute myelogenous leukemia and the aggressive lymfomy, počítaje v to Hodgkinova nemoc ) are more sensitive to chemotherapy, as a larger proportion of the targeted cells are undergoing buněčné dělení kdykoliv. Malignancies with slower growth rates, such as indolent lymphomas, tend to respond to chemotherapy much more modestly.[4] Heterogeneic tumours may also display varying sensitivities to chemotherapy agents, depending on the subclonal populations within the tumor.
Cells from the imunitní systém also make crucial contributions to the antitumor effects of chemotherapy.[145] For example, the chemotherapeutic drugs oxaliplatina a cyklofosfamid can cause tumor cells to die in a way that is detectable by the immune system (called immunogenic cell death ), which mobilizes immune cells with antitumor functions.[146] Chemotherapeutic drugs that cause cancer immunogenic tumor cell death can make unresponsive tumors sensitive to immune checkpoint terapie.[147]
Jiná použití
Some chemotherapy drugs are used in diseases other than cancer, such as in autoimmune disorders,[148] a nerakovinné dyskrazie plazmatických buněk. In some cases they are often used at lower doses, which means that the side effects are minimized,[148] while in other cases doses similar to ones used to treat cancer are used. Methotrexát se používá při léčbě revmatoidní artritida (RA),[149] psoriáza,[150] ankylozující spondylitida[151] a roztroušená skleróza.[152][153] The anti-inflammatory response seen in RA is thought to be due to increases in adenosin, Který způsobuje imunosuprese; effects on immuno-regulatory cyclooxygenase -2 enzyme pathways; reduction in pro-inflammatory cytokiny; and anti-proliferative properties.[149] Although methotrexate is used to treat both multiple sclerosis and ankylosing spondylitis, its efficacy in these diseases is still uncertain.[151][152][153] Cyklofosfamid is sometimes used to treat lupus nephritis, a common symptom of systémový lupus erythematodes.[154] Dexamethason along with either bortezomib nebo melphalan is commonly used as a treatment for AL amyloidóza. Recently, bortezomid in combination with cyklofosfamid and dexamethasone has also shown promise as a treatment for AL amyloidosis. Other drugs used to treat myeloma jako lenalidomid have shown promise in treating AL amyloidosis.[155]
Chemotherapy drugs are also used in režimy kondicionování prior to bone marrow transplant (transplantace hematopoetických kmenových buněk ). Conditioning regimens are used to suppress the recipient's immune system in order to allow a transplant to engraft. Cyclophosphamide is a common cytotoxic drug used in this manner, and is often used in conjunction with celkové ozáření těla. Chemotherapeutic drugs may be used at high doses to permanently remove the recipient's bone marrow cells (myeloablative conditioning) or at lower doses that will prevent permanent bone marrow loss (non-myeloablative and reduced intensity conditioning).[156] When used in non-cancer setting, the treatment is still called "chemotherapy", and is often done in the same treatment centers used for people with cancer.
Occupational exposure and safe handling
In the 1970s, antineoplastic (chemotherapy) drugs were identified as hazardous, and the Americká společnost farmaceutů zdravotnického systému (ASHP) has since then introduced the concept of hazardous drugs after publishing a recommendation in 1983 regarding handling hazardous drugs. The adaptation of federal regulations came when the U.S. Správa bezpečnosti a ochrany zdraví při práci (OSHA) first released its guidelines in 1986 and then updated them in 1996, 1999, and, most recently, 2006.[157]
The Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH) has been conducting an assessment in the workplace since then regarding these drugs. Occupational exposure to antineoplastic drugs has been linked to multiple health effects, including infertility and possible carcinogenic effects. A few cases have been reported by the NIOSH alert report, such as one in which a female pharmacist was diagnosed with papillary transitional cell carcinoma. Twelve years before the pharmacist was diagnosed with the condition, she had worked for 20 months in a hospital where she was responsible for preparing multiple antineoplastic drugs.[158] The pharmacist didn't have any other risk factor for cancer, and therefore, her cancer was attributed to the exposure to the antineoplastic drugs, although a cause-and-effect relationship has not been established in the literature. Another case happened when a malfunction in biosafety cabinetry is believed to have exposed nursing personnel to antineoplastic drugs. Investigations revealed evidence of genotoxic biomarkers two and nine months after that exposure.
Routes of exposure
Antineoplastic drugs are usually given through intravenózní, intramuskulární, intratekální nebo podkožní správa. In most cases, before the medication is administered to the patient, it needs to be prepared and handled by several workers. Any worker who is involved in handling, preparing, or administering the drugs, or with cleaning objects that have come into contact with antineoplastic drugs, is potentially exposed to hazardous drugs. Health care workers are exposed to drugs in different circumstances, such as when pharmacists and pharmacy technicians prepare and handle antineoplastic drugs and when nurses and physicians administer the drugs to patients. Additionally, those who are responsible for disposing antineoplastic drugs in health care facilities are also at risk of exposure.[159]
Dermal exposure is thought to be the main route of exposure due to the fact that significant amounts of the antineoplastic agents have been found in the gloves worn by healthcare workers who prepare, handle, and administer the agents. Another noteworthy route of exposure is inhalation of the drugs' vapors. Multiple studies have investigated inhalation as a route of exposure, and although air sampling has not shown any dangerous levels, it is still a potential route of exposure. Ingestion by hand to mouth is a route of exposure that is less likely compared to others because of the enforced hygienic standard in the health institutions. However, it is still a potential route, especially in the workplace, outside of a health institute. One can also be exposed to these hazardous drugs through injection by needle sticks. Research conducted in this area has established that occupational exposure occurs by examining evidence in multiple urine samples from health care workers.[160]
Nebezpečí
Hazardous drugs expose health care workers to serious health risks. Many studies show that antineoplastic drugs could have many side effects on the reproductive system, such as fetal loss, congenital malformation, and infertility. Health care workers who are exposed to antineoplastic drugs on many occasions have adverse reproductive outcomes such as spontaneous abortions, stillbirths, and congenital malformations. Moreover, studies have shown that exposure to these drugs leads to menstrual cycle irregularities. Antineoplastic drugs may also increase the risk of learning disabilities among children of health care workers who are exposed to these hazardous substances.
Moreover, these drugs have karcinogenní účinky. In the past five decades, multiple studies have shown the carcinogenic effects of exposure to antineoplastic drugs. Similarly, there have been research studies that linked alkylating agents with humans developing leukemias. Studies have reported elevated risk of breast cancer, nonmelanoma skin cancer, and cancer of the rectum among nurses who are exposed to these drugs. Other investigations revealed that there is a potential genotoxický effect from anti-neoplastic drugs to workers in health care settings.[158]
Safe handling in health care settings
As of 2018, there were no occupational exposure limits set for antineoplastic drugs, i.e., OSHA or the Americká konference vládních průmyslových hygieniků (ACGIH) have not set workplace safety guidelines.[161]
Příprava
NIOSH recommends using a ventilated cabinet that is designed to decrease worker exposure. Additionally, it recommends training of all staff, the use of cabinets, implementing an initial evaluation of the technique of the safety program, and wearing protective gloves and gowns when opening drug packaging, handling vials, or labeling. When wearing osobní ochranné prostředky, one should inspect gloves for physical defects before use and always wear double gloves and protective gowns. Health care workers are also required to wash their hands with water and soap before and after working with antineoplastic drugs, change gloves every 30 minutes or whenever punctured, and discard them immediately in a chemotherapy waste container.[162]
The gowns used should be disposable gowns made of polyethylene-coated polypropylene. When wearing gowns, individuals should make sure that the gowns are closed and have long sleeves. When preparation is done, the final product should be completely sealed in a plastic bag.
The health care worker should also wipe all waste containers inside the ventilated cabinet before removing them from the cabinet. Finally, workers should remove all protective wear and put them in a bag for their disposal inside the ventilated cabinet.[159]
Správa
Drugs should only be administered using protective medical devices such as needle lists and closed systems and techniques such as priming of IV tubing by pharmacy personnel inside a ventilated cabinet. Workers should always wear personal protective equipment such as double gloves, goggles, and protective gowns when opening the outer bag and assembling the delivery system to deliver the drug to the patient, and when disposing of all material used in the administration of the drugs.[161]
Hospital workers should never remove tubing from an IV bag that contains an antineoplastic drug, and when disconnecting the tubing in the system, they should make sure the tubing has been thoroughly flushed. After removing the IV bag, the workers should place it together with other disposable items directly in the yellow chemotherapy waste container with the lid closed. Protective equipment should be removed and put into a disposable chemotherapy waste container. After this has been done, one should double bag the chemotherapy waste before or after removing one's inner gloves. Moreover, one must always wash one's hands with soap and water before leaving the drug administration site.[163]
Employee training
All employees whose jobs in health care facilities expose them to hazardous drugs must receive training. Training should include shipping and receiving personnel, housekeepers, pharmacists, assistants, and all individuals involved in the transportation and storage of antineoplastic drugs. These individuals should receive information and training to inform them of the hazards of the drugs present in their areas of work. They should be informed and trained on operations and procedures in their work areas where they can encounter hazards, different methods used to detect the presence of hazardous drugs and how the hazards are released, and the physical and health hazards of the drugs, including their reproductive and carcinogenic hazard potential. Additionally, they should be informed and trained on the measures they should take to avoid and protect themselves from these hazards. This information ought to be provided when health care workers come into contact with the drugs, that is, perform the initial assignment in a work area with hazardous drugs. Moreover, training should also be provided when new hazards emerge as well as when new drugs, procedures, or equipment are introduced.[161]
Housekeeping and waste disposal
When performing cleaning and decontaminating the work area where antineoplastic drugs are used, one should make sure that there is sufficient ventilation to prevent the buildup of airborne drug concentrations. When cleaning the work surface, hospital workers should use deactivation and cleaning agents before and after each activity as well as at the end of their shifts. Cleaning should always be done using double protective gloves and disposable gowns. After employees finish up cleaning, they should dispose of the items used in the activity in a yellow chemotherapy waste container while still wearing protective gloves. After removing the gloves, they should thoroughly wash their hands with soap and water. Anything that comes into contact or has a trace of the antineoplastic drugs, such as needles, empty vials, syringes, gowns, and gloves, should be put in the chemotherapy waste container.[164]
Spill control
A written policy needs to be in place in case of a spill of antineoplastic products. The policy should address the possibility of various sizes of spills as well as the procedure and personal protective equipment required for each size. A trained worker should handle a large spill and always dispose of all cleanup materials in the chemical waste container according to EPA regulations, not in a yellow chemotherapy waste container.[165]
Occupational monitoring
A medical surveillance program must be established. In case of exposure, occupational health professionals need to ask for a detailed history and do a thorough physical exam. They should test the urine of the potentially exposed worker by doing a urine dipstick or microscopic examination, mainly looking for blood, as several antineoplastic drugs are known to cause bladder damage.[158]
Urinary mutagenicity is a marker of exposure to antineoplastic drugs that was first used by Falck and colleagues in 1979 and uses bacterial mutagenicity assays. Apart from being nonspecific, the test can be influenced by extraneous factors such as dietary intake and smoking and is, therefore, used sparingly. However, the test played a significant role in changing the use of horizontal flow cabinets to vertical flow biological safety cabinets during the preparation of antineoplastic drugs because the former exposed health care workers to high levels of drugs. This changed the handling of drugs and effectively reduced workers’ exposure to antineoplastic drugs.[158]
Biomarkers of exposure to antineoplastic drugs commonly include urinary Platina, methotrexát, močový cyklofosfamid a ifosfamide, and urinary metabolite of 5-fluorouracil. In addition to this, there are other drugs used to measure the drugs directly in the urine, although they are rarely used. A measurement of these drugs directly in one's urine is a sign of high exposure levels and that an uptake of the drugs is happening either through inhalation or dermally.[158]
Available agents
There is an extensive list of antineoplastic agents. Several classification schemes have been used to subdivide the medicines used for cancer into several different types.[166][167]
Dějiny
První použití small-molecule drugs to treat cancer was in the early 20th century, although the specific chemicals first used were not originally intended for that purpose. Hořčičný plyn byl použit jako chemická válka agent during první světová válka and was discovered to be a potent suppressor of krvetvorba (blood production).[168] A similar family of compounds known as dusíkaté hořčice were studied further during druhá světová válka na Lékařská fakulta Yale.[169] It was reasoned that an agent that damaged the rapidly growing white blood cells might have a similar effect on cancer.[169] Therefore, in December 1942, several people with advanced lymfomy (cancers of the lymphatic system and lymph nodes) were given the drug by vein, rather than by breathing the irritating gas.[169] Their improvement, although temporary, was remarkable.[170] Concurrently, during a military operation in World War II, following a German nálet, bombardování on the Italian harbour of Bari, several hundred people were accidentally exposed to mustard gas, which had been transported there by the Spojenecké jednotky to prepare for possible retaliation in the event of German use of chemical warfare. The survivors were later found to have very low white blood cell counts.[171] After WWII was over and the reports declassified, the experiences converged and led researchers to look for other substances that might have similar effects against cancer. The first chemotherapy drug to be developed from this line of research was mustine. Since then, many other drugs have been developed to treat cancer, and drug development has exploded into a multibillion-dollar industry, although the principles and limitations of chemotherapy discovered by the early researchers still apply.[172]
Termín chemoterapie
Slovo chemoterapie without a modifier usually refers to cancer treatment, but its historical meaning was broader. The term was coined in the early 1900s by Paul Ehrlich as meaning any use of chemicals to treat any disease (chemoterapie - + -therapy ), such as the use of antibiotika (antibacterial chemotherapy).[173] Ehrlich was not optimistic that effective chemotherapy drugs would be found for the treatment of cancer.[173] The first modern chemotherapeutic agent was arsphenamin, an arsenic compound discovered in 1907 and used to treat syfilis.[174] Poté následovalo sulfonamidy (sulfa drugs) and penicilin. V dnešní používání, smysl "any treatment of disease with drugs" is often expressed with the word farmakoterapie.
Odbyt
The top 10 best-selling (in terms of revenue) cancer drugs of 2013:[175]
| Ne. | 2013 Global Sales | HOSPODA | Obchodní názvy | Marketing authorization holder | Indikace |
|---|---|---|---|---|---|
| 1 | $7.78 billion | Rituximab | Rituxan, MabThera | Roche, Pharmstandard | non-Hodgkin's lymphoma, CLL |
| 2 | $6.75 billion | Bevacizumab | Avastin | Roche | Colorectal, lung, ovarian and brain cancer |
| 3 | $6.56 billion | Trastuzumab | Herceptin | Roche | Breast, esophagus and stomach cancer |
| 4 | 4,69 miliardy $ | Imatinib | Gleevec | Novartis | Leukemia, GI cancer |
| 5 | 1,09 miliardy $ | Lenalidomid | Revlimid | Celgene, Pharmstandard | Multiple myeloma, mantle cell lymphoma |
| 6 | $2.7 billion | Pemetrexed | Alimta | Eli Lilly | Rakovina plic |
| 7 | $2.6 billion | Bortezomib | Velcade | Johnson & Johnson, Takeda, Pharmstandard | Mnohočetný myelom |
| 8 | $1.87 billion | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | Colon and head and neck cancer |
| 9 | 1,73 miliardy $ | Leuprorelin | Lupron, Eligard | AbbVie and Takeda; Sanofi and Astellas Pharma | Prostate and ovarian cancer |
| 10 | $1.7 billion | Abirateron | Zytiga | Johnson & Johnson | Rakovina prostaty |
Výzkum

Cílené terapie
Specially targeted delivery vehicles aim to increase effective levels of chemotherapy for tumor cells while reducing effective levels for other cells. This should result in an increased tumor kill or reduced toxicity or both.[176]
Konjugáty protilátka-léčivo
Konjugáty protilátka-léčivo (ADCs) comprise an protilátka, drug and a linker between them. The antibody will be targeted at a preferentially expressed protein in the tumour cells (known as a tumor antigen ) or on cells that the tumor can utilise, such as blood vessel endoteliální buňky. They bind to the tumor antigen and are internalised, where the linker releases the drug into the cell. These specially targeted delivery vehicles vary in their stability, selectivity, and choice of target, but, in essence, they all aim to increase the maximum effective dose that can be delivered to the tumor cells.[177] Reduced systemic toxicity means that they can also be used in people who are sicker, and that they can carry new chemotherapeutic agents that would have been far too toxic to deliver via traditional systemic approaches.[Citace je zapotřebí ]
The first approved drug of this type was gemtuzumab ozogamicin (Mylotarg), released by Wyeth (Nyní Pfizer ). The drug was approved to treat Akutní myeloidní leukémie, but has now been withdrawn from the market because the drug did not meet efficacy targets in further clinical trials.[178][179] Two other drugs, trastuzumab emtansin a brentuximab vedotin, are both in late clinical trials, and the latter has been granted accelerated approval for the treatment of žáruvzdorný Hodgkinův lymfom a systémové anaplastický velkobuněčný lymfom.[177]
Nanočástice
Nanočástice are 1–1000 nanometr (nm) sized particles that can promote tumor selectivity and aid in delivering low-rozpustnost léky. Nanoparticles can be targeted passively or actively. Passive targeting exploits the difference between tumor blood vessels and normal blood vessels. Blood vessels in tumors are "leaky" because they have gaps from 200 to 2000 nm, which allow nanoparticles to escape into the tumor. Active targeting uses biological molecules (protilátky, bílkoviny, DNA a receptorové ligandy ) to preferentially target the nanoparticles to the tumor cells. There are many types of nanoparticle delivery systems, such as oxid křemičitý, polymery, liposomy and magnetic particles. Nanoparticles made of magnetic material can also be used to concentrate agents at tumor sites using an externally applied magnetic field.[176] They have emerged as a useful vehicle in magnetické podávání léků for poorly soluble agents such as paclitaxel.[180]
Electrochemotherapy
Electrochemotherapy is the combined treatment in which injection of a chemotherapeutic drug is followed by application of high-voltage electric pulses locally to the tumor. The treatment enables the chemotherapeutic drugs, which otherwise cannot or hardly go through the membrane of cells (such as bleomycin and cisplatin), to enter the cancer cells. Hence, greater effectiveness of antitumor treatment is achieved.
Clinical electrochemotherapy has been successfully used for treatment of cutaneous and subcutaneous tumors irrespective of their histological origin.[181][182][183][184][185][186] The method has been reported as safe, simple and highly effective in all reports on clinical use of electrochemotherapy. Podle projektu ESOPE (Evropské standardní operační postupy pro elektrochemoterapii) byly na základě zkušeností předních evropských onkologických center pro elektrochemoterapii připraveny Standardní operační postupy (SOP) pro elektrochemoterapii.[183][187] Nedávno byly vyvinuty nové způsoby elektrochemoterapie pro léčbu vnitřních nádorů pomocí chirurgických postupů, endoskopických cest nebo perkutánních přístupů k získání přístupu do oblasti léčby.[188][189]
Hypertermická terapie
Hypertermická terapie je tepelné ošetření rakoviny, které může být mocným nástrojem při použití v kombinaci s chemoterapií (termochemoterapie) nebo ozařováním pro kontrolu různých druhů rakoviny. Teplo lze aplikovat lokálně na místo nádoru, což rozšíří krevní cévy do nádoru, což umožní vstupu více chemoterapeutických léků do nádoru. Navíc bude membrána nádorových buněk pórovitější, což dále umožní více chemoterapeutického léčiva vstoupit do nádorových buněk.
Ukázalo se také, že hypertermie pomáhá předcházet nebo zvrátit „chemorezistenci“. Rezistence na chemoterapii se někdy vyvíjí v průběhu času, jak se nádory adaptují a mohou překonat toxicitu chemoterapie. „Překonávání chemorezistence bylo v minulosti rozsáhle studováno, zejména za použití buněk rezistentních na CDDP. S ohledem na potenciální přínos, že buňky rezistentní na léky lze získat pro účinnou terapii kombinací chemoterapie s hypertermií, bylo důležité ukázat, že chemorezistence proti několika protinádorová léčiva (např. mitomycin C, antracykliny, BCNU, melfalan), včetně CDDP, lze alespoň částečně zvrátit přídavkem tepla.[190]
Ostatní zvířata
Chemoterapie se ve veterinární medicíně používá podobně jako v humánní medicíně.[191]
Viz také
- Protirakovinné léky (časopis)
- Antimikrobiální chemoterapie
- Rakovina a nevolnost
- Únava související s rakovinou
- Chemo mozek
- Režimy chemoterapie
- Cytostáza
- Experimentální léčba rakoviny
- Bezpečné zacházení s nebezpečnými drogami
- Dodávka léku
- Hypertermická terapie
- Imunoterapie
- Národní komplexní síť proti rakovině
- Radiačně indukovaný kognitivní pokles
- Radioterapie
- Viroterapie
Reference
- ^ A b Alfarouk KO, Stock CM, Taylor S, Walsh M, Muddathir AK, Verduzco D a kol. (15. července 2015). „Odolnost proti chemoterapii rakoviny: selhání odpovědi na léky z ADME na P-gp“. Cancer Cell International. 15 (1): 71. doi:10.1186 / s12935-015-0221-1. PMC 4502609. PMID 26180516.
- ^ Johnstone RW, Ruefli AA, Lowe SW (leden 2002). „Apoptóza: souvislost mezi genetikou rakoviny a chemoterapií“. Buňka. 108 (2): 153–64. doi:10.1016 / S0092-8674 (02) 00625-6. PMID 11832206. S2CID 7429296.
- ^ Rajman L, Chwalek K, Sinclair DA (2018). „Terapeutický potenciál molekul podporujících NAD: důkazy in vivo“. Buněčný metabolismus. 27 (3): 529–547. doi:10.1016 / j.cmet.2018.02.011. PMC 6342515. PMID 29514064.
- ^ A b C d E F Corrie PG, Pippa G. (2008). "Cytotoxická chemoterapie: klinické aspekty". Lék. 36 (1): 24–28. doi:10.1016 / j.mpmed.2007.10.012.
- ^ A b C Wagner AD, Syn NL, Moehler M, Grothe W, Yong WP, Tai BC, Ho J, Unverzagt S (srpen 2017). "Chemoterapie pro pokročilý karcinom žaludku". Cochrane Database of Systematic Reviews. 8: CD004064. doi:10.1002 / 14651858.cd004064.pub4. PMC 6483552. PMID 28850174.
- ^ A b C d E F G h i j k Rachel Airley (2009). Chemoterapie rakoviny. Wiley-Blackwell. ISBN 978-0-470-09254-5.
- ^ A b C d E F Wood M, Brighton D (2005). Příručka o chemoterapii rakoviny v nemocnici Royal Marsden Hospital: průvodce pro multidisciplinární tým. St. Louis, Mo: Elsevier Churchill Livingstone. ISBN 978-0-443-07101-0.
- ^ Perry, Michael J. (2008). Kniha zdrojů chemoterapie. Philadelphia: Wolters Kluwer Health / Lippincott Williams & Wilkins. ISBN 978-0-7817-7328-7.
- ^ Epstein RJ (srpen 2005). „Udržovací terapie k potlačení mikrometastázy: nová výzva pro adjuvantní léčbu rakoviny“. Klinický výzkum rakoviny. 11 (15): 5337–41. doi:10.1158 / 1078-0432.CCR-05-0437. PMID 16061845.
- ^ Skeel RT (2003). Příručka chemoterapie rakoviny (brožovaná verze) (6. vydání). Lippincott Williams & Wilkins. ISBN 978-0-7817-3629-9.
- ^ Chabner B, Longo DL (2005). Chemoterapie a bioterapie rakoviny: principy a praxe (4. vydání). Philadelphia: Lippincott Willians & Wilkins. ISBN 978-0-7817-5628-0.
- ^ Nastoupil LJ, Rose AC, Flowers CR (květen 2012). „Difúzní velkobuněčný B-buněčný lymfom: současné přístupy k léčbě“. Onkologie. 26 (5): 488–95. PMID 22730604.
- ^ Freedman A (říjen 2012). „Folikulární lymfom: aktualizace 2012 o diagnostice a léčbě“. American Journal of Hematology. 87 (10): 988–95. doi:10.1002 / ajh.23313. PMID 23001911. S2CID 35447562.
- ^ Rampling R, James A, Papanastassiou V (červen 2004). „Současná a budoucí léčba maligních nádorů na mozku: chirurgie, radioterapie, chemoterapie“. Časopis neurologie, neurochirurgie a psychiatrie. 75 Suppl 2 (Suppl 2): ii24-30. doi:10.1136 / jnnp.2004.040535. PMC 1765659. PMID 15146036.
- ^ Madan V, Lear JT, Szeimies RM (únor 2010). „Nemelonomová rakovina kůže“. Lanceta. 375 (9715): 673–85. doi:10.1016 / S0140-6736 (09) 61196-X. PMC 3339125. PMID 20171403.
- ^ Du Bois D, Du Bois EF (1989). "Vzorec pro odhad přibližné povrchové plochy, pokud je známa výška a hmotnost. 1916". Výživa. 5 (5): 303–11, diskuse 312–3. PMID 2520314.
- ^ A b C Felici A, Verweij J, Sparreboom A (září 2002). „Dávkovací strategie pro protinádorová léčiva: dobrá, špatná a povrch těla“. European Journal of Cancer. 38 (13): 1677–84. doi:10.1016 / s0959-8049 (02) 00151-x. PMID 12175683.
- ^ A b C Kaestner SA, Sewell GJ (únor 2007). „Dávkování chemoterapie, část I: vědecké podklady pro současnou praxi a využití plochy povrchu těla“ (PDF). Klinická onkologie. 19 (1): 23–37. doi:10.1016 / j.clon.2006.10.010. hdl:10026.1/3714. PMID 17305252.
- ^ Pinkel D (srpen 1958). „Využití plochy povrchu těla jako kritéria pro dávkování léků při chemoterapii rakoviny“. Výzkum rakoviny. 18 (7): 853–6. PMID 13573353.
- ^ A b Gurney H (duben 2002). „Jak vypočítat dávku chemoterapie“. British Journal of Cancer. 86 (8): 1297–302. doi:10.1038 / sj.bjc.6600139. PMC 2375356. PMID 11953888.
- ^ A b Beumer JH, Chu E, Salamone SJ (listopad 2012). „Dávkování chemoterapie na základě plochy povrchu těla: vhodné v 21. století?“. Journal of Clinical Oncology. 30 (31): 3896–7. doi:10.1200 / JCO.2012.44.2863. PMID 22965963.
- ^ A b Baker SD, Verweij J, Rowinsky EK, Donehower RC, Schellens JH, Grochow LB, Sparreboom A (prosinec 2002). „Role povrchu těla v dávkování zkoumaných protinádorových látek u dospělých, 1991-2001“. Journal of the National Cancer Institute. 94 (24): 1883–8. doi:10.1093 / jnci / 94.24.1883. PMID 12488482.
- ^ A b C d E F G h i j Gamelin E, Delva R, Jacob J, Merrouche Y, Raoul JL, Pezet D, Dorval E, Piot G, Morel A, Boisdron-Celle M (květen 2008). „Individuální úprava dávky fluorouracilu na základě farmakokinetického sledování ve srovnání s konvenčním dávkováním: výsledky multicentrické randomizované studie u pacientů s metastatickým kolorektálním karcinomem.“ Journal of Clinical Oncology. 26 (13): 2099–105. doi:10.1200 / jco.2007.13.3934. PMID 18445839. S2CID 9557055.
- ^ Saam J, Critchfield GC, Hamilton SA, Roa BB, Wenstrup RJ, Kaldate RR (září 2011). „Dávkování 5-fluoruracilu na základě povrchu těla vede k rozsáhlé interindividuální variabilitě expozice 5-fluoruracilu u pacientů s kolorektálním karcinomem v režimech FOLFOX“. Klinický kolorektální karcinom. 10 (3): 203–6. doi:10.1016 / j.clcc.2011.03.015. PMID 21855044.
- ^ A b C d E F G Capitain O, Asevoaia A, Boisdron-Celle M, Poirier AL, Morel A, Gamelin E (prosinec 2012). „Individuální úprava dávky fluorouracilu v přípravku FOLFOX na základě farmakokinetického sledování ve srovnání s konvenčním dávkováním plochy povrchu těla: studie fáze II, proof-of-concept“. Klinický kolorektální karcinom. 11 (4): 263–7. doi:10.1016 / j.clcc.2012.05.004. PMID 22683364.
- ^ Kaldate RR, Haregewoin A, Grier CE, Hamilton SA, McLeod HL (2012). „Modelování oblasti 5-fluorouracilu pod křivkou versus dávkový vztah pro vývoj algoritmu farmakokinetického dávkování pro pacienty s kolorektálním karcinomem, kteří dostávají FOLFOX6“. Onkolog. 17 (3): 296–302. doi:10.1634 / theoncologist.2011-0357. PMC 3316912. PMID 22382460.
- ^ A b C Hunter RJ, Navo MA, Thaker PH, Bodurka DC, Wolf JK, Smith JA (únor 2009). "Dávkování chemoterapie u obézních pacientů: skutečný versus přiřazený povrch těla (BSA)". Recenze léčby rakoviny. 35 (1): 69–78. doi:10.1016 / j.ctrv.2008.07.005. PMID 18922643.
- ^ Hanna, Louise; Crosby, Tom; Fergus Macbeth, eds. (2008). Praktická klinická onkologie. Cambridge, Velká Británie: Cambridge University Press. ISBN 978-0-521-61816-8.
- ^ Buffery PJ, Allen KM, Chin PK, Moore GA, Barclay ML, Begg EJ (únor 2014). „Třináctiletá zkušenost s farmakokinetickým monitorováním a dávkováním busulfanu: lze strategii zlepšit?“. Terapeutické monitorování léčiv. 36 (1): 86–92. doi:10.1097 / FTD.0b013e31829dc940. PMID 24299921. S2CID 28646787.
- ^ Bartelink IH, Bredius RG, Belitser SV, Suttorp MM, Bierings M, Knibbe CA a kol. (2014). „Souvislost mezi expozicí busulfanu a výsledkem u dětí, které dostávají intravenózní busulfan před transplantací hematopoetických kmenových buněk“. Ther Drug Monit. 36 (1): 93–99. doi:10.1097 / FTD.0b013e3182a04fc7. PMID 24061446. S2CID 21072472.
- ^ „ARK Methotrexate Assay“. Diagnostika archy. Archivovány od originál dne 28. dubna 2014. Citováno 28. dubna 2014.
- ^ „Přizpůsobení chemoterapie pro lepší péči o rakovinu“. Diagnostika mé péče. Archivovány od originál dne 28. dubna 2014. Citováno 25. listopadu 2018.
- ^ „Stručná historie dávkování BSA“. Diagnostika mé péče.
- ^ Asher V, Lee J, Bali A (září 2012). „Předoperační sérový albumin je nezávislým prognostickým prediktorem přežití u rakoviny vaječníků“. Lékařská onkologie. 29 (3): 2005–9. doi:10.1007 / s12032-011-0019-5. PMID 21735143. S2CID 19558612.
- ^ A b Siddik ZH (2005). „Mechanismy působení rakovinných chemoterapeutických činidel: DNA-interaktivní alkylační činidla a protinádorová léčiva na bázi platiny“. Příručka o rakovině. John Wiley & Sons, Ltd. doi:10.1002 / 0470025077.chap84b. ISBN 978-0470025062.
- ^ A b C d E F Lind M. J., M. J. (2008). "Principy cytotoxické chemoterapie". Lék. 36 (1): 19–23. doi:10.1016 / j.mpmed.2007.10.003.
- ^ A b C Damia G, D'Incalci M (září 1998). „Mechanismy rezistence vůči alkylačním činidlům“. Cytotechnologie. 27 (1–3): 165–73. doi:10.1023 / A: 1008060720608. PMC 3449574. PMID 19002790.
- ^ A b C d Malhotra V, Perry MC (2003). "Klasická chemoterapie: mechanismy, toxicity a terapeutické okno". Biologie a terapie rakoviny. 2 (4 Suppl 1): S2-4. doi:10,4161 / cbt.199. PMID 14508075.
- ^ Giorgi-Renault S, Renault J, Baron M, Gebel-Servolles P, Delic J, Cros S, Paoletti C (1988). "Heterocyklické chinony XIII. Dimerizace v sérii 5,8-chinazolindionů: Syntéza a protinádorové účinky bis (4-amino-5,8-chinazolindionů)" ". Chem. Pharm. Býk. 36 (10): 3933–3947. doi:10,1248 / cpb.36.3933. PMID 3245973.
- ^ Takimoto CH, Calvo E (2008). "Principy onkologické farmakoterapie". In Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (eds.). Management rakoviny: Multidisciplinární přístup (11. vydání).
- ^ A b C Parker WB (červenec 2009). „Enzymologie purinových a pyrimidinových antimetabolitů používaných při léčbě rakoviny“. Chemické recenze. 109 (7): 2880–93. doi:10.1021 / cr900028p. PMC 2827868. PMID 19476376.
- ^ Adjei AA (červen 2004). „Pemetrexed (ALIMTA), nový multitargetovaný antineoplastický prostředek“. Klinický výzkum rakoviny. 10 (12 Pt 2): 4276s - 4280s. doi:10.1158 / 1078-0432.CCR-040010. PMID 15217974. S2CID 31467685.
- ^ Wagstaff AJ, Ibbotson T, Goa KL (2003). „Capecitabin: přehled jeho farmakologie a terapeutické účinnosti při léčbě pokročilého karcinomu prsu“. Drogy. 63 (2): 217–36. doi:10.2165/00003495-200363020-00009. PMID 12515569.
- ^ Rowinsky EK, Donehower RC (říjen 1991). „Klinická farmakologie a použití antimikrotubulárních látek v chemoterapeutikách proti rakovině“. Farmakologie a terapeutika. 52 (1): 35–84. doi:10.1016/0163-7258(91)90086-2. PMID 1687171.
- ^ A b C Yue QX, Liu X, Guo DA (srpen 2010). "Přírodní produkty vázající mikrotubuly pro léčbu rakoviny". Planta Medica. 76 (11): 1037–43. doi:10,1055 / s-0030-1250073. PMID 20577942.
- ^ Hirata K, Miyamoto K, Miura Y (1994). "Catharanthus roseus L. (Brčál): Produkce vindolinu a kataranthinu ve více kulturách výhonků ". V Bajaj YP (ed.). Biotechnologie v zemědělství a lesnictví 26. Léčivé a aromatické rostliny. VI. Springer-Verlag. str.46–55. ISBN 9783540563914.
- ^ van Der Heijden R, Jacobs DI, Snoeijer W, Hallard D, Verpoorte R (březen 2004). „Alkaloidy z Catharanthus: farmakognosie a biotechnologie“. Současná léčivá chemie. 11 (5): 607–28. doi:10.2174/0929867043455846. PMID 15032608.
- ^ Gansäuer A, Justicia J, Fan CA, Worgull D, Piestert F (2007). „Redukční tvorba vazby C – C po otevření epoxidu přenosem elektronů“. v Krische MJ (vyd.). Redukční kovem katalyzovaná redukce C — C vazby: odklon od preformovaných organokovových činidel. Témata ze současné chemie. 279. Springer Science & Business Media. s. 25–52. doi:10.1007/128_2007_130. ISBN 9783540728795.
- ^ Cooper R, Deakin JJ (2016). „Afrika je dar světu“. Botanické zázraky: Chemie rostlin, které změnily svět. CRC Press. s. 46–51. ISBN 9781498704304.
- ^ A b Keglevich P, Hazai L, Kalaus G, Szántay C (květen 2012). "Úpravy základních koster vinblastinu a vinkristinu". Molekuly. 17 (5): 5893–914. doi:10,3390 / molekuly17055893. PMC 6268133. PMID 22609781.
- ^ Raviña, Enrique (2011). "Vinca alkaloidy". Vývoj objevování drog: Od tradičních léků po moderní léky. John Wiley & Sons. str. 157–159. ISBN 9783527326693.
- ^ Faller BA, Pandit TN (2011). „Bezpečnost a účinnost vinorelbinu v léčbě nemalobuněčného karcinomu plic“. Insights of Clinical Medicine: Oncology. 5: 131–44. doi:10,4137 / CMO.S5074. PMC 3117629. PMID 21695100.
- ^ Ngo QA, Roussi F, Cormier A, Thoret S, Knossow M, Guénard D, Guéritte F (leden 2009). "Syntéza a biologické hodnocení vinka alkaloidů a hybridů phomopsinu". Journal of Medicinal Chemistry. 52 (1): 134–42. doi:10.1021 / jm801064y. PMID 19072542.
- ^ Damayanthi Y, Lown JW (červen 1998). „Podofylotoxiny: současný stav a poslední vývoj“. Současná léčivá chemie. 5 (3): 205–52. PMID 9562603.
- ^ Liu YQ, Yang L, Tian X (2007). „Podophyllotoxin: současné perspektivy“. Současné bioaktivní sloučeniny. 3 (1): 37–66. doi:10.1016 / j.jallcom.2006.06.070.
- ^ Lodish H, Berk A, Zipursky SL a kol. (2000). Molekulární buněčná biologie. 4. vydání. Role topoizomeráz v replikaci DNA. New York: W. H. Freeman.
- ^ Goodsell DS (2002). "Molekulární perspektiva: DNA topoizomerázy". Kmenové buňky. 20 (5): 470–1. doi:10.1634 / kmenové články. 20-5-470. PMID 12351817. S2CID 9257158.
- ^ Nitiss JL (květen 2009). „Cílení na DNA topoizomerázu II v chemoterapii rakoviny“. Recenze přírody. Rakovina. 9 (5): 338–50. doi:10.1038 / nrc2607. PMC 2748742. PMID 19377506.
- ^ Offermanns S, Rosenthal W (14. srpna 2008). Encyclopedia of Molecular Pharmacology. Springer Science & Business Media. p. 155. ISBN 9783540389163.
- ^ Offermanns S, Rosenthal W (14. srpna 2008). Encyclopedia of Molecular Pharmacology. Springer Science & Business Media. str. 91 a násl. ISBN 9783540389163.
- ^ Koeller J, Eble M (1988). "Mitoxantron: Nový derivát antracyklinů". Klinická lékárna. 7 (8): 574–81. PMID 3048848.
- ^ Minotti G, Menna P, Salvatorelli E, Cairo G, Gianni L (červen 2004). „Antracykliny: molekulární pokroky a farmakologický vývoj protinádorové aktivity a kardiotoxicity“. Farmakologické recenze. 56 (2): 185–229. doi:10.1124 / pr. 56.2.6. PMID 15169927. S2CID 13138853.
- ^ Sobell HM (srpen 1985). „Aktinomycin a transkripce DNA“. Sborník Národní akademie věd Spojených států amerických. 82 (16): 5328–31. Bibcode:1985PNAS ... 82.5328S. doi:10.1073 / pnas.82.16.5328. PMC 390561. PMID 2410919.
- ^ Dorr RT (duben 1992). „Farmakologie bleomycinu: mechanismus účinku a rezistence a klinická farmakokinetika“. Semináře z onkologie. 19 (2 Suppl 5): 3–8. PMID 1384141.
- ^ Verweij J, Pinedo HM (říjen 1990). "Mitomycin C: mechanismus účinku, užitečnost a omezení". Protirakovinné léky. 1 (1): 5–13. doi:10.1097/00001813-199010000-00002. PMID 2131038.
- ^ Greer JA, Amoyal N, Nisotel L, Fishbein JN, MacDonald J, Stagl J a kol. (Březen 2016). „Systematický přehled dodržování perorálních antineoplastických terapií“. Onkolog. 21 (3): 354–76. doi:10.1634 / theoncologist.2015-0405. PMC 4786357. PMID 26921292.
- ^ Moreno-Ramirez D, de la Cruz-Merino L, Ferrandiz L, Villegas-Portero R, Nieto-Garcia A (2010). „Izolovaná perfuze končetin u maligního melanomu: systematické hodnocení účinnosti a bezpečnosti“. Onkolog. 15 (4): 416–27. doi:10.1634 / theoncologist.2009-0325. PMC 3227960. PMID 20348274.
- ^ Verhoef C, de Wilt JH, ten Hagen TL, Eggermont AM (říjen 2008). „Izolovaná jaterní perfúze pro léčbu jaterních nádorů: západ nebo východ slunce?“. Chirurgické onkologické kliniky Severní Ameriky. 17 (4): 877–94, xi. doi:10.1016 / j.soc.2008.04.007. PMID 18722924.
- ^ Hendriks JM, Van Schil PE (1998). "Izolovaná plicní perfuze pro léčbu plicních metastáz". Chirurgická onkologie. 7 (1–2): 59–63. doi:10.1016 / S0960-7404 (98) 00028-0. PMID 10421507.
- ^ Chitwood K, Etzkorn J, Cohen G (září 2013). „Lokální a intralezionální léčba nemelanomové rakoviny kůže: srovnání účinnosti a nákladů“. Dermatologická chirurgie. 39 (9): 1306–16. doi:10.1111 / dsu.12300. PMID 23915332. S2CID 597295.
- ^ Huang ES (2000). Vnitřní lékařství: příručka pro lékaře, průvodce přežití rezidentů. Arlington, VA: Scrub Hill Press. p. 130. ISBN 978-0-9645467-5-2.
- ^ Elad S, Zadik Y, Hewson I, Hovan A, Correa ME, Logan R, Elting LS, Spijkervet FK, Brennan MT (srpen 2010). "Systematický přehled virových infekcí spojených s orálním postižením u pacientů s rakovinou: reflektor na Herpesviridea". Podpůrná péče o rakovinu. 18 (8): 993–1006. doi:10.1007 / s00520-010-0900-3. PMID 20544224. S2CID 2969472.
- ^ A b C Gafter-Gvili A, Fraser A, Paul M, Vidal L, Lawrie TA, van de Wetering MD, Kremer LC, Leibovici L (leden 2012). „Antibiotická profylaxe bakteriálních infekcí u afebrilních neutropenických pacientů po chemoterapii“. Cochrane Database of Systematic Reviews. 1: CD004386. doi:10.1002 / 14651858.CD004386.pub3. PMC 4170789. PMID 22258955.
- ^ „Coriolus Versicolor“. Cancer.org. 10. června 2008. Citováno 7. srpna 2012.
- ^ Davila ML (leden 2006). "Neutropenická enterokolitida". Aktuální názor na gastroenterologii. 22 (1): 44–7. doi:10.1097 / 01.mog.0000198073.14169.3b. PMID 16319675. S2CID 25479771.
- ^ A b Keidan RD, Fanning J, Gatenby RA, Weese JL (březen 1989). "Recidivující tyflitida. Onemocnění vyplývající z agresivní chemoterapie". Nemoci tlustého střeva a konečníku. 32 (3): 206–9. doi:10.1007 / BF02554529. PMID 2920627. S2CID 46090832.
- ^ Gibson RJ, Keefe DM (září 2006). „Průjem a zácpa vyvolaná rakovinovou chemoterapií: mechanismy poškození a preventivní strategie“. Podpůrná péče o rakovinu. 14 (9): 890–900. doi:10.1007 / s00520-006-0040-r. PMID 16604351. S2CID 109778.
- ^ Wei D, Heus P, van de Wetering FT, van Tienhoven G, Verleye L, Scholten RJ (srpen 2018). „Probiotika pro prevenci nebo léčbu průjmů souvisejících s chemoterapií nebo radioterapií u lidí s rakovinou“. Cochrane Database of Systematic Reviews. 8: CD008831. doi:10.1002 / 14651858.cd008831.pub3. PMC 6513393. PMID 30168576.
- ^ Groopman JE, Itri LM (říjen 1999). "Anemie vyvolaná chemoterapií u dospělých: výskyt a léčba". Journal of the National Cancer Institute. 91 (19): 1616–34. doi:10.1093 / jnci / 91.19.1616. PMID 10511589.
- ^ Henry DH (červenec 2006). „Role nitrožilního železa při anémii související s rakovinou“. Onkologie. 20 (8 Suppl 6): 21–4. PMID 16925107.
- ^ Rodgers GM, Becker PS, Bennett CL, Cella D, Chanan-Khan A, Chesney C, Cleeland C, Coccia PF, Djulbegovic B, Garst JL, Gilreath JA, Kraut EH, Lin WC, Matulonis U, Millenson M, Reinke D, Rosenthal J, Sabbatini P, Schwartz RN, Stein RS, Vij R (červenec 2008). "Anemie vyvolaná rakovinou a chemoterapií". Journal of the National Comprehensive Cancer Network. 6 (6): 536–64. doi:10.6004 / jnccn.2008.0042. PMID 18597709.
- ^ Vadhan-Raj S (leden 2009). „Řízení trombocytopenie vyvolané chemoterapií: současný stav trombopoetických látek“. Semináře z hematologie. 46 (1 příloha 2): S26-32. doi:10.1053 / j.seminhematol.2008.12.007. PMID 19245931.
- ^ Sekhon SS, Roy V (květen 2006). „Trombocytopenie u dospělých: praktický přístup k hodnocení a řízení“. Southern Medical Journal. 99 (5): 491–8, kvíz 499–500, 533. doi:10.1097 / 01.smj.0000209275.75045.d4. PMID 16711312. S2CID 16527763.
- ^ Estcourt L, Stanworth S, Doree C, Hopewell S, Murphy MF, Tinmouth A, Heddle N a kol. (Cochrane Haematological Malignancies Group) (květen 2012). „Profylaktická transfuze krevních destiček pro prevenci krvácení u pacientů s hematologickými poruchami po chemoterapii a transplantaci kmenových buněk“. Cochrane Database of Systematic Reviews (5): CD004269. doi:10.1002 / 14651858.CD004269.pub3. PMID 22592695.
- ^ Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF a kol. (Cochrane Haematological Malignancies Group) (listopad 2015). „Srovnání různých prahových hodnot počtu krevních destiček pro vedení profylaktické transfuze krevních destiček pro prevenci krvácení u lidí s hematologickými poruchami po myelosupresivní chemoterapii nebo transplantaci kmenových buněk“. Cochrane Database of Systematic Reviews (11): CD010983. doi:10.1002 / 14651858.CD010983.pub2. PMC 4717525. PMID 26576687.
- ^ Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, Cimprich B, Cleeland C, Eisenberger MA, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, O'Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI (srpen 2010). „Pokyny NCCN pro klinickou praxi Únava související s rakovinou“. Journal of the National Comprehensive Cancer Network. 8 (8): 904–31. doi:10.6004 / jnccn.2010.0067. PMID 20870636. S2CID 70400559.
- ^ Franklin DJ, Packel L (březen 2006). "Únava související s rakovinou". Archivy fyzikální medicíny a rehabilitace. 87 (3 Suppl 1): S91–3, kvíz S94–5. doi:10.1016 / j.apmr.2005.12.015. PMID 16500197.
- ^ Křeč F, Byron-Daniel J (listopad 2012). Křeč F (ed.). „Cvičení pro zvládání únavy spojené s rakovinou u dospělých“ (PDF). Cochrane Database of Systematic Reviews. 11: CD006145. doi:10.1002 / 14651858.CD006145.pub3. PMID 23152233.
- ^ Gill P, Grothey A, Loprinzi C (2006). Nevolnost a zvracení u pacienta s rakovinou. Onkologie. 1482–1496. doi:10.1007/0-387-31056-8_83. ISBN 978-0-387-24291-0.
Nevolnost a zvracení jsou dva z nejobávanějších vedlejších účinků léčby rakoviny u pacientů s rakovinou a jejich rodin.
- ^ Chadha V, Shenoi SD (2003). "Ztráta vlasů u pacientů s chemoterapií rakoviny". Indian Journal of Dermatology, Venereology and Leprology. 69 (2): 131–2. PMID 17642856.
- ^ Lemieux J (říjen 2012). "Snížení alopecie vyvolané chemoterapií s ochlazením pokožky hlavy". Klinické pokroky v hematologii a onkologii. 10 (10): 681–2. PMID 23187775.
- ^ Shapiro J, Price VH (duben 1998). "Obnova vlasů. Terapeutické látky". Dermatologické kliniky. 16 (2): 341–56. doi:10.1016 / S0733-8635 (05) 70017-6. PMID 9589208.
- ^ Al-Mohanna H, Al-Khenaizan S (2010). "Trvalá alopecie po lebečním ozáření u dítěte". Časopis kožní medicíny a chirurgie. 14 (3): 141–3. doi:10.2310/7750.2010.09014. PMID 20487675. S2CID 43583651.
- ^ Can G, Demir M, Erol O, Aydiner A (červen 2013). „Srovnání zkušeností mužů a žen s alopecií vyvolanou chemoterapií“. European Journal of Oncology Nursing. 17 (3): 255–60. doi:10.1016 / j.ejon.2012.06.003. PMID 22901547.
- ^ Trüeb RM (březen 2009). „Alopecie vyvolaná chemoterapií“. Semináře v kožní medicíně a chirurgii. 28 (1): 11–4. doi:10.1016 / j.sder.2008.12.001. PMID 19341937.
- ^ Chon SY, Champion RW, Geddes ER, Rashid RM (červenec 2012). „Alopecie vyvolaná chemoterapií“. Journal of the American Academy of Dermatology. 67 (1): e37-47. doi:10.1016 / j.jaad.2011.02.026. PMID 22178150.
- ^ Sekundární neoplazie po chemoterapii, radioterapii a imunosupresi. 55. Basilej: Karger. 2000. ISBN 9783318006155. OCLC 606559421.
- ^ Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu M, Behm FG, Razzouk BI, Ribeiro RC, Rubnitz JE, Sandlund JT, Rivera GK, Evans WE, Relling MV, Pui CH (březen 2007). „Kumulativní výskyt sekundárních novotvarů jako první událost po dětské akutní lymfoblastické leukémii“. JAMA. 297 (11): 1207–15. doi:10.1001 / jama.297.11.1207. PMID 17374815.
- ^ A b C d Brydøy M, Fosså SD, Dahl O, Bjøro T (2007). „Gonadální dysfunkce a problémy s plodností u pacientů, kteří přežili rakovinu“. Acta Oncologica. 46 (4): 480–9. doi:10.1080/02841860601166958. PMID 17497315. S2CID 20672988.
- ^ A b Morgan S, Anderson RA, Gourley C, Wallace WH, Spears N (2012). „Jak chemoterapeutika poškozují vaječník?“. Aktualizace lidské reprodukce. 18 (5): 525–35. doi:10.1093 / humupd / dms022. PMID 22647504.
- ^ Gurgan T, Salman C, Demirol A (říjen 2008). „Těhotenství a techniky asistované reprodukce u mužů a žen po léčbě rakoviny“. Placenta. 29 Suppl B: 152–9. doi:10.1016 / j.placenta.2008.07.007. PMID 18790328.
- ^ Courbiere B, Decanter C, Bringer-Deutsch S, Rives N, Mirallié S, Pech JC, De Ziegler D, Carré-Pigeon F, May-Panloup P, Sifer C, Amice V, Schweitzer T, Porcu-Buisson G, Poirot C (Září 2013). „Nouzové IVF pro zmrazení embryí za účelem zachování plodnosti žen: francouzská multicentrická kohortní studie“. Lidská reprodukce. 28 (9): 2381–8. doi:10.1093 / humrep / det268. PMID 23832792.
- ^ Roness H, Kalich-Philosoph L, Meirow D (2014). „Prevence poškození vaječníků vyvolaného chemoterapií: možné role hormonálních a nehormonálních oslabujících látek“. Aktualizace lidské reprodukce. 20 (5): 759–74. doi:10.1093 / humupd / dmu019. PMID 24833728.
- ^ Tichelli A, Rovó A (srpen 2013). „Problémy s plodností po transplantaci hematopoetických kmenových buněk“. Odborný přehled hematologie. 6 (4): 375–88. doi:10.1586/17474086.2013.816507. PMID 23991924. S2CID 25139582.
Na druhé straně cituje: Sanders JE, Hawley J, Levy W, Gooley T, Buckner CD, Deeg HJ, Doney K, Storb R, Sullivan K, Witherspoon R, Appelbaum FR (duben 1996). „Těhotenství po podání vysokých dávek cyklofosfamidu s vysokými dávkami busulfanu nebo bez nich, ozařování celého těla a transplantace kostní dřeně“. Krev. 87 (7): 3045–52. doi:10.1182 / krev.V87.7.3045.bloodjournal8773045. PMID 8639928. - ^ A b C d E F Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). „Genetické a teratogenní účinky léčby rakoviny na gamety a embrya“. Aktualizace lidské reprodukce. 7 (4): 394–403. doi:10.1093 / humupd / 7.4.394. PMID 11476352. [1]
- ^ A b del Pino BM (23. února 2010). "Periferní neuropatie vyvolaná chemoterapií". Bulletin o rakovině NCI. 7 (4): 6.
- ^ Grisold W, Oberndorfer S, Windebank AJ (2012). „Chemoterapie a polyneuropatie“ (PDF). European Association of Neurooncology Magazine. 12 (1).
- ^ Beijers AJ, Jongen JL, Vreugdenhil G (leden 2012). „Neurotoxicita vyvolaná chemoterapií: hodnota neuroprotektivních strategií“. The Netherlands Journal of Medicine. 70 (1): 18–25. PMID 22271810. Archivovány od originál dne 3. prosince 2013.
- ^ A b Windebank AJ, Grisold W (březen 2008). "Neuropatie vyvolaná chemoterapií". Journal of the Peripheral Nervous System. 13 (1): 27–46. doi:10.1111 / j.1529-8027.2008.00156.x. PMID 18346229. S2CID 20411101.
- ^ Savage L (červenec 2007). „Chemoterapeutem indukovaná bolest vede vědce k záhadám“. Journal of the National Cancer Institute. 99 (14): 1070–1. doi:10.1093 / jnci / djm072. PMID 17623791.
- ^ Tannock IF, Ahles TA, Ganz PA, Van Dam FS (červen 2004). „Kognitivní poruchy spojené s chemoterapií rakoviny: zpráva z workshopu“. Journal of Clinical Oncology. 22 (11): 2233–9. doi:10.1200 / JCO.2004.08.094. PMID 15169812. Archivovány od originál dne 17. září 2012.
- ^ Shaikh AY, Shih JA (červen 2012). "Kardiotoxicita vyvolaná chemoterapií". Aktuální zprávy o srdečním selhání. 9 (2): 117–27. doi:10.1007 / s11897-012-0083-r. PMID 22382639. S2CID 35723897.
- ^ Thatishetty AV, Agresti N, O'Brien CB (listopad 2013). "Chemoterapií vyvolaná hepatotoxicita". Kliniky jaterních chorob. 17 (4): 671–86, ix – x. doi:10.1016 / j.cld.2013.07.010. PMID 24099024.
- ^ King PD, Perry MC (2001). "Hepatotoxicita chemoterapie". Onkolog. 6 (2): 162–76. doi:10.1634 / theoncologist.6-2-162. PMID 11306728.
- ^ de Jonge MJ, Verweij J (únor 2006). "Renální toxicita chemoterapie". Semináře z onkologie. 33 (1): 68–73. doi:10.1053 / j.seminoncol.2005.11.011. PMID 16473645.
- ^ Humphreys BD, Soiffer RJ, Magee CC (leden 2005). „Selhání ledvin spojené s rakovinou a její léčbou: aktualizace“. Časopis Americké nefrologické společnosti. 16 (1): 151–61. doi:10.1681 / ASN.2004100843. PMID 15574506.
- ^ Brock PR, Knight KR, Freyer DR, Campbell KC, Steyger PS, Blakley BW a kol. (Červenec 2012). „Platinem indukovaná ototoxicita u dětí: konsensuální přezkum mechanismů, predispozice a ochrany, včetně nové stupnice ototoxicity International Society of Pediatric Oncology Boston“. Journal of Clinical Oncology. 30 (19): 2408–17. doi:10.1200 / JCO.2011.39.1110. PMC 3675696. PMID 22547603.
- ^ Rybak LP, Mukherjea D, Jajoo S, Ramkumar V (listopad 2009). „Ototoxicita a ochrana cisplatiny: klinické a experimentální studie“. Tohoku Journal of Experimental Medicine. 219 (3): 177–86. doi:10.1620 / tjem.219.177. PMC 2927105. PMID 19851045.
- ^ van As JW, van den Berg H, van Dalen EC (leden 2020). „Různé délky infuze pro prevenci ztráty sluchu vyvolané platinou u dětí s rakovinou“. Cochrane Database of Systematic Reviews. 1: CD010885. doi:10.1002 / 14651858.CD010885.pub5. PMC 6984653. PMID 31961948.
- ^ van As JW, van den Berg H, van Dalen EC (srpen 2016). „Ztráta sluchu vyvolaná platinou po léčbě dětské rakoviny“. Cochrane Database of Systematic Reviews (8): CD010181. doi:10.1002 / 14651858.cd010181.pub2. PMC 6466671. PMID 27486906.
- ^ van As JW, van den Berg H, van Dalen EC (květen 2019). „Lékařské zákroky pro prevenci ztráty sluchu vyvolané platinou u dětí s rakovinou“. Cochrane Database of Systematic Reviews. 5: CD009219. doi:10.1002 / 14651858.cd009219.pub5. PMC 6504134. PMID 31063591.
- ^ Ward EJ, Henry LM, Friend AJ, Wilkins S, Phillips RS (srpen 2015). „Nutriční podpora u dětí a mladých lidí s rakovinou podstupujících chemoterapii“. Cochrane Database of Systematic Reviews (8): CD003298. doi:10.1002 / 14651858.cd003298.pub3. PMID 26301790.
- ^ Weeks JC, Catalano PJ, Cronin A, Finkelman MD, Mack JW, Keating NL, Schrag D (říjen 2012). „Očekávání pacientů ohledně účinků chemoterapie na pokročilou rakovinu. The New England Journal of Medicine. 367 (17): 1616–25. doi:10.1056 / NEJMoa1204410. PMC 3613151. PMID 23094723.
- ^ Deeken JF, Löscher W (březen 2007). „Hematoencefalická bariéra a rakovina: transportéry, léčba a trojské koně“. Klinický výzkum rakoviny. 13 (6): 1663–74. doi:10.1158 / 1078-0432.CCR-06-2854. PMID 17363519.
- ^ Agarwala SS, Kirkwood JM (2000). „Temozolomid, nové alkylační činidlo s aktivitou v centrálním nervovém systému, může zlepšit léčbu pokročilého metastatického melanomu“. Onkolog. 5 (2): 144–51. doi:10.1634 / theoncologist.5-2-144. PMID 10794805.
- ^ Gerstner ER, Fine RL (červen 2007). „Zvýšená propustnost hematoencefalické bariéry pro chemoterapii u metastatických nádorů na mozku: stanovení paradigmatu léčby“. Journal of Clinical Oncology. 25 (16): 2306–12. doi:10.1200 / JCO.2006.10.0677. PMID 17538177.
- ^ Minchinton AI, Tannock IF (srpen 2006). "Pronikání léku do solidních nádorů". Recenze přírody. Rakovina. 6 (8): 583–92. doi:10.1038 / nrc1893. PMID 16862189. S2CID 42818461.
- ^ Goldman B (únor 2003). „Mnoholetá rezistence: mohou nové léky pomoci skóre chemoterapie proti rakovině?“. Journal of the National Cancer Institute. 95 (4): 255–7. doi:10.1093 / jnci / 95.4.255. PMID 12591977.
- ^ Crowley E, McDevitt CA, Callaghan R (2009). Mnohočetná rezistence na rakovinu. Generování inhibitorů P-glykoproteinu: Kam teď, teď?. Springerovy protokoly. 405–432.
- ^ Luqmani YA (2005). „Mechanismy rezistence na léky při chemoterapii rakoviny“. Lékařské zásady a praxe. 14 Příloha 1: 35–48. doi:10.1159/000086183. PMID 16103712.
- ^ Moschovi M, Critselis E, Cen O, Adamaki M, Lambrou GI, Chrousos GP, Vlahopoulos S (2015). „Drogy působící na homeostázu: náročná adaptace rakovinných buněk“. Odborná recenze protinádorové terapie. 15 (12): 1405–17. doi:10.1586/14737140.2015.1095095. PMID 26523494. S2CID 28992964.
- ^ Heavey S, Godwin P, Baird AM, Barr MP, Umezawa K, Cuffe S a kol. (Říjen 2014). „Strategické zaměření osy PI3K-NFκB v NSCLC rezistentním na cisplatinu“. Biologie a terapie rakoviny. 15 (10): 1367–77. doi:10,4161 / cbt.29841. PMC 4130730. PMID 25025901.
- ^ Ryan SL, Beard S, Barr MP, Umezawa K, Heavey S, Godwin P a kol. (Září 2019). „Cílení na NF-κB zprostředkované zánětlivé cesty v NSCLC rezistentním na cisplatinu“ (PDF). Rakovina plic. 135: 217–227. doi:10.1016 / j.lungcan.2019.07.006. PMID 31446998.
- ^ Godwin P, Baird AM, Heavey S, Barr MP, O'Byrne KJ, Gately K (2013). „Cílení na nukleární faktor-kappa B k překonání rezistence na chemoterapii“. Hranice v onkologii. 3: 120. doi:10.3389 / fon.2013.00120. PMC 3655421. PMID 23720710.
- ^ Gerber DE (únor 2008). „Cílené terapie: nová generace léčby rakoviny“. Americký rodinný lékař. 77 (3): 311–9. PMID 18297955.
- ^ Allen TM (říjen 2002). „Terapie cílená na ligand v protinádorové terapii“. Recenze přírody. Rakovina. 2 (10): 750–63. doi:10.1038 / nrc903. PMID 12360278. S2CID 21014917.
- ^ Chen HX, Cleck JN (srpen 2009). „Nežádoucí účinky protinádorových látek, které se zaměřují na dráhu VEGF“. Recenze přírody. Klinická onkologie. 6 (8): 465–77. doi:10.1038 / nrclinonc.2009.94. PMID 19581909. S2CID 30482752.
- ^ Zhang J, Yang PL, Gray NS (leden 2009). "Cílení na rakovinu pomocí inhibitorů kinázy s malou molekulou". Recenze přírody. Rakovina. 9 (1): 28–39. doi:10.1038 / nrc2559. PMID 19104514. S2CID 17934366.
- ^ Hanahan D, Weinberg RA (leden 2000). "Charakteristické znaky rakoviny". Buňka. 100 (1): 57–70. doi:10.1016 / S0092-8674 (00) 81683-9. PMID 10647931. S2CID 1478778.
- ^ Hodgson S (leden 2008). „Mechanismy zděděné náchylnosti k rakovině“. Journal of Zhejiang University Science B. 9 (1): 1–4. doi:10.1631 / jzus.B073001. PMC 2170461. PMID 18196605.
- ^ Perera FP (listopad 1997). „Prostředí a rakovina: kdo je náchylný?“. Věda. 278 (5340): 1068–73. Bibcode:1997Sci ... 278.1068P. doi:10.1126 / science.278.5340.1068. PMID 9353182.
- ^ Hoskins WJ, Perez CA, Young RC, Barakat RR, Markman M, Randall ME, eds. (2005). Principy a praxe gynekologické onkologie (4. vydání). Baltimore, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-4689-2.
- ^ Kehe K, Balszuweit F, Steinritz D, Thiermann H (září 2009). „Molekulární toxikologie kožního zánětu a puchýřků vyvolaná sírovou hořčicí“. Toxikologie. 263 (1): 12–9. doi:10.1016 / j.tox.2009.01.019. PMID 19651324.
- ^ Makin G, Hickman JA (červenec 2000). "Apoptóza a chemoterapie rakoviny". Výzkum buněk a tkání. 301 (1): 143–52. Bibcode:1994RSPTB.345..319H. doi:10.1007 / s004419900160. PMID 10928287. S2CID 22909070.
- ^ Zitvogel L, Apetoh L, Ghiringhelli F, Kroemer G (leden 2008). "Imunologické aspekty chemoterapie rakoviny". Recenze přírody. Imunologie. 8 (1): 59–73. doi:10.1038 / nri2216. PMID 18097448. S2CID 205490545.
- ^ Galluzzi L, Buqué A, Kepp O, Zitvogel L, Kroemer G (únor 2017). "Imunogenní buněčná smrt u rakoviny a infekčních onemocnění". Recenze přírody. Imunologie. 17 (2): 97–111. doi:10.1038 / nri.2016.107. PMID 27748397. S2CID 4045072.
- ^ Pfirschke C, Engblom C, Rickelt S, Cortez-Retamozo V, Garris C, Pucci F, Yamazaki T, Poirier-Colame V, Newton A, Redouane Y, Lin YJ, Wojtkiewicz G, Iwamoto Y, Mino-Kenudson M, Huynh TG Hynes RO, Freeman GJ, Kroemer G, Zitvogel L, Weissleder R, Pittet MJ (únor 2016). „Imunogenní chemoterapie senzibilizuje nádory na terapii blokováním Checkpoint“. Imunita. 44 (2): 343–54. doi:10.1016 / j.immuni.2015.11.024. PMC 4758865. PMID 26872698.
- ^ A b Ben-Ari ET (duben 2004). „Dvojí účel: některé léčby rakoviny používané k léčbě autoimunitních onemocnění“ (PDF). Journal of the National Cancer Institute. 96 (8): 577–9. doi:10.1093 / jnci / 96.8.577. PMID 15100330.
- ^ A b Cutolo M, Sulli A, Pizzorni C, Seriolo B, Straub RH (srpen 2001). "Protizánětlivé mechanismy methotrexátu u revmatoidní artritidy". Annals of the Revmatic Diseases. 60 (8): 729–35. doi:10.1136 / ard.60.8.729. PMC 1753808. PMID 11454634.
- ^ Montaudié H, Sbidian E, Paul C, Maza A, Gallini A, Aractingi S, Aubin F, Bachelez H, Cribier B, Joly P, Jullien D, Le Maître M, Misery L, Richard MA, Ortonne JP (květen 2011). „Methotrexát u psoriázy: systematický přehled modalit léčby, výskytu, rizikových faktorů a monitorování jaterní toxicity“. Věstník Evropské akademie dermatologie a venerologie. 25 Suppl 2: 12–8. doi:10.1111 / j.1468-3083.2011.03991.x. PMID 21388454. S2CID 13015911.
- ^ A b Chen J, Veras MM, Liu C, Lin J (únor 2013). Chen J (ed.). "Methotrexát pro ankylozující spondylitidu". Cochrane Database of Systematic Reviews. 2 (2): CD004524. doi:10.1002 / 14651858.CD004524.pub4. PMID 23450553.
- ^ A b Gray O, McDonnell GV, Forbes RB (2004). Gray O (ed.). "Methotrexát pro roztroušenou sklerózu". Cochrane Database of Systematic Reviews (2): CD003208. doi:10.1002 / 14651858.CD003208.pub2. PMID 15106195.
- ^ A b Gray OM, McDonnell GV, Forbes RB (srpen 2006). "Systematický přehled perorálního methotrexátu u roztroušené sklerózy". Roztroušená skleróza. 12 (4): 507–10. doi:10.1191 / 1352458506ms1299oa. PMID 16900766. S2CID 46120577.
- ^ Ntali S, Bertsias G, Boumpas DT (červen 2011). „Cyklofosfamid a lupusová nefritida: kdy, jak, na jak dlouho?“. Klinické recenze v alergii a imunologii. 40 (3): 181–91. doi:10.1007 / s12016-009-8196-0. PMID 20107927. S2CID 11902371.
- ^ „Pokyny NCCN: Systémová amyloidóza lehkého řetězce“ (PDF). Národní komplexní síť proti rakovině.
- ^ Bacigalupo A, Ballen K, Rizzo D, Giralt S, Lazarus H, Ho V, Apperley J, Slavin S, Pasquini M, Sandmaier BM, Barrett J, Blaise D, Lowski R, Horowitz M (prosinec 2009). „Definování intenzity režimů úpravy: pracovní definice“. Biologie transplantace krve a dřeně. 15 (12): 1628–33. doi:10.1016 / j.bbmt.2009.07.004. PMC 2861656. PMID 19896087.
- ^ Sorsa M, Hämeilä M, Järviluoma E (září 2006). „Zacházení s protinádorovými léky: od identifikace nebezpečí k řízení rizik?“. Annals of the New York Academy of Sciences. 1076 (1): 628–34. Bibcode:2006NYASA1076..628S. doi:10.1196 / annals.1371.008. PMID 17119240. S2CID 7081365.
- ^ A b C d E Thomas h. Connor, PhD (březen 2014). „Chemoterapie: biomarkery expozice, účinku, nebezpečí pro reprodukci a rakoviny“. Onkologický lékárník.
- ^ A b „Osobní ochranné prostředky pro zdravotnické pracovníky, kteří pracují s nebezpečnými drogami“. 2008. doi:10,26616 / NIOSHPUB2009106. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Antineoplastická léčiva: expozice na pracovišti a zdravotní rizika. 2006. ISBN 978-90-393-4331-9.
- ^ A b C „prevence pracovní expozice antineoplastickým a jiným nebezpečným drogám ve zdravotnických zařízeních“ (PDF).
- ^ „Průvodci programem pro nebezpečné drogy“. www.lni.wa.gov. Citováno 22. listopadu 2018.
- ^ Reinhardt, Peter A. (29. listopadu 2017). Nakládání s infekčním a lékařským odpadem. ISBN 9781315894430.[stránka potřebná ]
- ^ „Bezpečné nakládání s odpady ze zdravotnických činností“ (PDF). SZO.
- ^ DeJoy DM, Smith TD, Woldu H, Dyal MA, Steege AL, Boiano JM (červenec 2017). „Účinky bezpečnostních postupů organizace a vnímané bezpečnostní klima na používání OOP, technické kontroly a nežádoucí účinky kapalných antineoplastických léků u zdravotních sester“. Journal of Occupational and Environmental Hygiene. 14 (7): 485–493. doi:10.1080/15459624.2017.1285496. PMID 28326998. S2CID 3879822.
- ^ Ian Olver (19. října 2010). Učebnice MASCC podpůrné péče o rakovinu a pozůstalosti. Springer Science & Business Media. p. 351. ISBN 978-1-4419-1225-1.
- ^ Holland JF, Pollock RE (2010). Holland-Frei Cancer Medicine 8. PMPH-USA. p. 1758. ISBN 978-1-60795-014-1.
- ^ Krumbhaar EB (1919). „Role krve a kostní dřeně v určitých formách otravy plyny“. JAMA. 72: 39–41. doi:10.1001 / jama.1919.26110010018009f.
- ^ A b C Fenn JE, Udelsman R (březen 2011). „První použití léčby rakoviny intravenózní chemoterapií: náprava záznamu“. Journal of the American College of Surgeons. 212 (3): 413–7. doi:10.1016 / j.jamcollsurg.2010.10.018. PMID 21247779.
- ^ Chabner BA, Roberts TG (leden 2005). „Časová osa: Chemoterapie a válka proti rakovině“. Recenze přírody. Rakovina. 5 (1): 65–72. doi:10.1038 / nrc1529. PMID 15630416. S2CID 205467419.
- ^ Faguet GB (2005). Válka proti rakovině. Springer. p.71. ISBN 978-1-4020-3618-7.
- ^ Joensuu H (březen 2008). "Systémová chemoterapie pro rakovinu: od zbraně k léčbě". Lancet. Onkologie. 9 (3): 304. doi:10.1016 / S1470-2045 (08) 70075-5. PMID 18308256.
- ^ A b DeVita VT, Chu E (listopad 2008). „Historie chemoterapie rakoviny“. Výzkum rakoviny. 68 (21): 8643–53. doi:10.1158 / 0008-5472.CAN-07-6611. PMID 18974103.
- ^ Nichols HJ, Walker JE (březen 1923). „Experimentální pozorování profylaxe a léčby syfilisu“. The Journal of Experimental Medicine. 37 (4): 525–42. doi:10.1084 / jem.37.4.525. PMC 2128372. PMID 19868743.
- ^ Top 10 nejprodávanějších léků na rakovinu roku 2013; 29. května 2014
- ^ A b Chidambaram M, Manavalan R, Kathiresan K (2011). „Nanoterapeutika k překonání konvenčních omezení chemoterapie rakoviny“. Journal of Pharmacy & Pharmaceutical Sciences. 14 (1): 67–77. doi:10.18433 / J30C7D. PMID 21501554.
- ^ A b Teicher BA, Chari RV (říjen 2011). „Protilátková konjugovaná terapeutika: výzvy a potenciál“. Klinický výzkum rakoviny. 17 (20): 6389–97. doi:10.1158 / 1078-0432.CCR-11-1417. PMID 22003066.
- ^ Sievers EL, Linenberger M (listopad 2001). „Mylotarg: chemoterapie zaměřená na protilátky pochází z věku“. Aktuální názor na onkologii. 13 (6): 522–7. doi:10.1097/00001622-200111000-00016. PMID 11673694. S2CID 27827980.
- ^ FDA. „Mylotarg (gemtuzumab ozogamicin): stažení z trhu“. Citováno 18. srpna 2013.
- ^ Vines T, Faunce T (květen 2009). „Posouzení bezpečnosti a nákladové efektivity časných nanodrogů“. Journal of Law and Medicine. 16 (5): 822–45. PMID 19554862.
- ^ Heller R, Gilbert R, Jaroszeski MJ (leden 1999). "Klinické aplikace elektrochemoterapie". Pokročilé recenze dodávek drog. 35 (1): 119–129. doi:10.1016 / S0169-409X (98) 00067-2. PMID 10837693.
- ^ Larkin JO, Collins CG, Aarons S, Tangney M, Whelan M, O'Reily S, Breathnach O, Soden DM, O'Sullivan GC (březen 2007). „Elektrochemoterapie: aspekty předklinického vývoje a rané klinické zkušenosti“. Annals of Surgery. 245 (3): 469–79. doi:10.1097 / 01.sla.0000250419.36053,33. PMC 1877027. PMID 17435555.
- ^ A b Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, Billard V, Geertsen PF, Larkin JO, Miklavcic D, Pavlovic I, Paulin-Kosir SM, Cemazar M, Morsli N, Soden DM, Rudolf Z, Robert C, O'Sullivan GC, Mir LM (2006). „Elektrochemoterapie - snadná, vysoce účinná a bezpečná léčba kožních a podkožních metastáz“. Eur J Cancer Suppl. 4 (11): 3–13. doi:10.1016 / j.ejcsup.2006.08.002.
- ^ Möller MG, Salwa S, Soden DM, O'Sullivan GC (listopad 2009). „Elektrochemoterapie jako doplněk nebo alternativa k jiné léčbě neresekovatelného nebo tranzitního melanomu“. Odborná recenze protinádorové terapie. 9 (11): 1611–30. doi:10.1586 / era.09.129. PMID 19895245. S2CID 1630835.
- ^ Testori A, Tosti G, Martinoli C, Spadola G, Cataldo F, Verrecchia F, Baldini F, Mosconi M, Soteldo J, Tedeschi I, Passoni C, Pari C, Di Pietro A, Ferrucci PF (2010). „Elektrochemoterapie pro kožní a podkožní nádorové léze: nový terapeutický přístup“. Dermatologická terapie. 23 (6): 651–61. doi:10.1111 / j.1529-8019.2010.01370.x. PMID 21054709. S2CID 46534637.
- ^ Hampton T (únor 2011). „Elektrické pulsy pomáhají s chemoterapií, mohou otevírat nové cesty pro další látky“. JAMA. 305 (6): 549–51. doi:10.1001 / jama.2011.92. PMID 21304073.
- ^ Mir LM, Gehl J, Sersa G, Collins CG, Garbay JR, Billard V, Geertsen PF, Rudolf Z, O'Sullivan GC, Marty M (2006). „Standardní operační postupy elektrochemoterapie: Pokyny pro použití bleomycinu nebo cisplatiny podávané systémově nebo lokálně a elektrické pulsy dodávané Cliniporator ™ pomocí invazivních nebo neinvazivních elektrod“. Eur J Cancer Suppl. 4 (11): 14–25. doi:10.1016 / j.ejcsup.2006.08.003.
- ^ Soden DM, Larkin JO, Collins CG, Tangney M, Aarons S, Piggott J, Morrissey A, Dunne C, O'Sullivan GC (únor 2006). "Úspěšná aplikace cílené elektrochemoterapie pomocí nových flexibilních elektrod a nízkých dávek bleomycinu na solidní nádory". Dopisy o rakovině. 232 (2): 300–10. doi:10.1016 / j.canlet.2005.03.057. PMID 15964138.
- ^ Miklavcic D, Snoj M, Zupanic A, Kos B, Cemazar M, Kropivnik M, Bracko M, Pecnik T, Gadzijev E, Sersa G (únor 2010). „Směrem k plánování léčby a léčbě hluboce uložených solidních nádorů elektrochemoterapií“. Biomedicínské inženýrství OnLine. 9 (1): 10. doi:10.1186 / 1475-925X-9-10. PMC 2843684. PMID 20178589.
- ^ Issels R (1999). „Hypertermie v kombinaci s chemoterapií - biologické zdůvodnění, klinické aplikace a výsledky léčby“ (PDF). Onkologie. 22 (5): 374–381. doi:10.1159/000026986. S2CID 37581171.
- ^ McKnight JA (květen 2003). "Principy chemoterapie". Klinické techniky v praxi malých zvířat. 18 (2): 67–72. doi:10.1053 / svms.2003.36617. PMID 12831063. S2CID 39060053.
externí odkazy
- Chemoterapie, Americká rakovinová společnost
- Nebezpečné expozice drogám ve zdravotnictví, Národní institut pro bezpečnost a ochranu zdraví při práci
- Seznam antineoplastických a jiných nebezpečných léků ve zdravotnických zařízeních NIOSH, 2016, Národní institut pro bezpečnost a ochranu zdraví při práci
