MAP2K7 - MAP2K7
Dvojitá specificita mitogenem aktivovaná protein kináza kináza 7, také známý jako MAP kináza kináza 7 nebo MKK7, je enzym že u lidí je kódován MAP2K7 gen.[5] Tento protein je členem mitogenem aktivovaná protein kináza kináza rodina. Protein MKK7 existuje jako šest různých izoformy se třemi možnými N-konci (α, β a γ izoformy) a dvěma možnými C-konci (1 a 2 izoformy).[6]
MKK7 je zapojen do signální transdukce zprostředkování buněčných odpovědí na prozánětlivé cytokiny a životní prostředí zdůrazňuje. Tento kináza konkrétně aktivuje MAPK8 / JNK1 a MAPK9 / JNK2 a tato kináza sama o sobě je fosforylovaný a aktivuje se Kinázy kinázy MAP kinázy počítaje v to MAP3K1 / MEKK1, MAP3K2 / MEKK2, MAP3K3 / MEKK5 a MAP4K2 / GCK.[Citace je zapotřebí ]
MKK7 je všudypřítomně exprimován ve všech tkáních. Zobrazuje však vyšší úroveň výrazu v kosterním svalu.[7] Bylo nalezeno několik alternativně sestříhaných variant transkriptu kódujících odlišné izoformy.[5]
Nomenklatura
MAP2K7 je také známý jako:
- MKK7
- JNK aktivovaná kináza 2
- MAPK / ERK kináza 7 (MEK7)
- Stresem aktivovaná protein kináza 4 (SAPK kináza 4, SAPKK4)
- c-Jun N-terminální kináza kináza 2 (JNK kináza 2, JNKK2)
- Stresem aktivovaná / extracelulární signálem regulovaná protein kináza kináza 2 (SEK2)
Izoformy
Myší protein MKK7 je kódován 14 exony což může být alternativně spojené čímž se získá skupina bílkovin kinázy. Výsledkem je šest izoformy se třemi možnými N-konci (α, β a γ izoformy) a dvěma možnými C-konci (1 a 2 izoformy). Molekulární hmotnost izoforem se pohybuje od 38 do 52 kDa, s 345 až 467 aminokyselinami.[6]
Fyziologický význam různých izoforem MKK7 je stále nejasný. Důkazy ukazují, že MKK7a, kterému chybí NH2-koncové prodloužení, vykazuje nižší bazální aktivitu ve vazbě JNK ve srovnání s izoformami MKKβ a y. Zvýšená bazální aktivita v beta a y izoformách může být způsobena třemi D-motivy přítomnými na N-konci těchto izoforem.[8]
Struktura a funkce
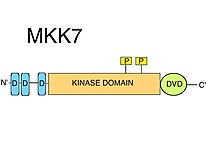
D-motivy
MKK7 má tři konzervované D-motivy (Nábor MAPK krátké lineární motivy ) na své vnitřně neuspořádané N-konec. D-motivy se obvykle skládají ze shluku kladně nabitých aminokyseliny následované střídáním hydrofobních aminokyselin.[8] D-motivy jsou přísně vyžadovány pro nábor substrátů MAPKK, jako je JNK.[10] Kinázové domény MAPK obsahují určité povrchové prvky, jako je takzvaná společná dokovací oblast (CD), vedle dokovací (D) drážky, které specificky rozpoznávají jejich příbuzné D-motivy.[8] D-motivy nalezené v MKK7 jsou vysoce specifické pro JNK, ale mají relativně nízkou vazebnou afinitu. Bylo navrženo, že motivy MKK7 mohou vzájemně synergizovat za účelem poskytnutí účinné fosforylace substrátu[11] Ukázalo se, že všechny tři D-motivy jsou nezbytné pro správné formování komplexu JNK1: MKK7 a pro fosforylaci a aktivaci JNK1 pomocí MKK7.[12]
DVD region
Speciální rozšíření jádra domény C-terminální kinázy, takzvaná „Domain for Versatile Docking“ (DVD) je oblast nalezená v MKK7 jako ve většině známých MAP2K.[10] Oblast DVD je stabilní, většinou spirálovitý sklad přibližně 20 aminokyselin, který se přidává na zadní stranu katalytického jádra domén kináz MAP2K.[13] Tato doménová přípona je vyžadována pro specifické navázání a aktivaci MKK7 příslušnými upstream MAPKKK. Jiné mitogenem aktivované proteinkinázy kinázy také vyžadují, aby oblast DVD (kromě různých jiných nekanonických prvků jejich kinázových domén, jako je „smyčka MKK1 / 2“) mohla rozlišovat mezi různými MAPKKK proti proudu.[14] Tyto speciální interakce kináza-doména / kináza-doména MAPKK: MAPKKK usnadňují fosforylaci MKK7.[8] Kromě aktivace MKK7 může mít vazba na oblast DVD také vliv na MKK7 aktivační smyčka takovým způsobem, že Ser a Thr z S-K-A-K-T motiv přístupný pro fosforylace.[8]
Kinázová doména
MKK7 obsahuje jednu kinázovou doménu. Přímá interakce MKK7: MAPKKK (pomocí oblasti DVD) usnadňuje fosforylaci MKK7 MAPKKK na serinu a threoninu v S-K-A-K-T motiv v katalytické doména (kinázová doména).[9]
Signalizace a regulace
MKK7 hraje důležitou roli ve signální dráze proteinkinázy aktivované stresem / N-terminální kinázy c-Jun (SAP / JNK).[15] Ve spolupráci s další mitogenem aktivovanou protein kinázou MKK4, MKK7 fungují jako rozhodující převodníky před signalizací JNK.[16] Společným úsilím dva MKK fosforylují různé JNK izoformy. Výsledkem je, že MKK7 má velký dopad na řadu fyziologických procesů, jako je proliferace a diferenciace, stejně jako patologické procesy, jako je apoptóza a tumorigeneze.[9] MKK7 se aktivují v důsledku buněčných stresů.[16] Jsou aktivovány řadou MKKK prostřednictvím fosforylace v a S-K-A-K-T motiv umístěný v kinázové doméně MKK7s. MKKK se vztahují k MKK7 prostřednictvím svého DVD místa na C-konci a fosforylují MKK7 na serin a threonin zbytky.[9] Po aktivaci MKK4 a MKK7 přímo fosforylují specifické tyrosin a threonin zbytky lokalizované v konzervovaném motivu T-P-Y aktivační smyčky proteinu JNK.[9] Ačkoli MKK7 působí prostřednictvím dvojí specificity, má tendenci fosforylovat threonin na proteinu JNK, přičemž MKK4 nechává fosforylovat tyrosin.[16] Fosforylované a aktivované JNK aktivují substráty jako transkripční faktory nebo pro-apoptotický protein.[9] Zdá se, že MKK7 a MKK4 regulují vzájemnou expresi, čímž ovlivňují signalizaci JNK. Monofosforylace JNK na threoninovém zbytku je adekvátní pro zvýšení aktivity JNK, což tvrdí, že MKK7 je důležitou složkou pro aktivitu JNK, zatímco další fosforylace tyrosinového zbytku pomocí MKK4 poskytuje příznivější aktivaci.[9] Celkově MAP2K7 obsahuje více aminokyselinových míst, která jsou fosforylována a ubikvitinována.[17]
Lešení proteiny

Kromě přímých interakcí mezi JNK, MKK7 a dalšími upstream proteinkinázami, různé proteiny lešení funkce k zajištění specificity mezi složkami signalizační kaskády MAPK.[8][16] Různé proteiny JNK, MAPK a MAPKK (např. MKK7 nebo MKK4) se specificky vážou na proteiny skeletu. Bylo identifikováno několik savčích proteinů lešení. Patří mezi ně protein interagující s JNK (JIP) 1 a jeho bližší příbuzný homolog, JIP2 nebo (zcela nesouvisející) proteiny JIP3 a JIP4. Nicméně se ukázalo, že JIP1 / 2 a JIP3 / 4 jsou schopné vzájemné přímé interakce.[19] Spousta Src-homologie-3 (POSH) se také ukázala být partnerem JIP1 / 2.[16]
Všechny tyto regulátory dráhy JNK sestavují transportní komplexy spojené s vezikulárním transportem závislým na kinesinu. V této souvislosti působí JIP1 / 2 jako nákladní adaptéry, které se vážou na motorický protein a nákladní protein současně. Kromě svých „normálních“ nákladů (C-konce transmembránových proteinů) přepravují také enzymy MAP2K a MAP3K, jmenovitě MKK7, DLK a MLK3. Kinázy vázané na lešení JIP1 / 2 jsou obecně zabaveny a považovány za neaktivní.[18] Vzhledem k tomu, že se předpokládá, že mechanismus vazby nákladu tohoto komplexu je závislý na fosforylaci, může fosforylace JNK kinázou uvolňovat své vlastní aktivátory z lešení, což vede k silné lokální smyčce pozitivní zpětné vazby.[18][20]
Interakce
Ukázalo se, že MAP2K7 interaguje s:
Biologický význam
MKK7 se podílí na vývoji epiteliálních tkání, jako je kůže a plíce, a také na vývoji zubů během časné embryogeneze u myší.[8] Experimenty také naznačují, že kromě organizace MKK4 jsou pro organizaci tělesných plánů savců během roku vyžadovány MKK7 embryogeneze.[16] MKK7 bylo také navrženo, aby fungovalo jako Gen potlačující metastázu (MSG) podporou klidu tumoru na metastazující stránky.[33] U malých savců může stres, jako je tlakové přetížení, způsobit srdeční hypertrofii a selhání, pokud je MKK7 vyřazen.[34] Podmíněné vymazání Map2k7 v nervových kmenových buňkách a postmitotických neuronech identifikovaly roli MKK7 v prodloužení axonů.[35] Neuronově specifické delece Map2k7 ukázaly roli MKK7 v motorické dysfunkci závislé na věku.[36]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000076984 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000002948 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b „Entrez Gene: MAP2K7 mitogenem aktivovaná protein kináza kináza 7“.
- ^ A b Tournier C, Whitmarsh AJ, Cavanagh J, Barrett T, Davis RJ (1999). „The MKK7 gen kóduje skupinu c-Jun NH2-terminální kinázové kinázy ". Molekulární a buněčná biologie. 19 (2): 1569–1581. doi:10.1128 / mcb.19.2.1569. PMC 116085. PMID 9891090.
- ^ Foltz IN, Gerl RE, Wieler JS, Luckach M, Salmon RA, Schrader JW (1998). „Lidská mitogenem aktivovaná protein kináza 7 (MKK7) je vysoce konzervovaná c-Jun N-terminální kináza / stres aktivovaná protein kináza (JNK / SAPK) aktivovaná environmentálními stresy a fyziologickými podněty“. The Journal of Biological Chemistry. 273 (15): 9344–9351. doi:10.1074 / jbc.273.15.9344. PMID 9535930.
- ^ A b C d E F G Wang X, Destrument A, Tournier C (2007). "Fyziologické role MKK4 a MKK7: Pohledy ze zvířecích modelů". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1773 (8): 1349–1357. doi:10.1016 / j.bbamcr.2006.10.016. PMID 17157936.
- ^ A b C d E F G Haeusgen W, Herdegen T, Waetzig V (2011). "Úzké místo signalizace JNK: Molekulární a funkční charakteristiky MKK4 a MKK7". European Journal of Cell Biology. 90 (6–7): 536–544. doi:10.1016 / j.ejcb.2010.11.008. PMID 21333379.
- ^ A b Gantert C, Honerkamp J, Timmer J (1992). "Analýza dynamiky časových řad třesu rukou". Biologická kybernetika. 66 (6): 479–484. doi:10.1007 / bf00204112. PMID 1586672. S2CID 22250412.
- ^ Ho DT, Bardwell AJ, Abdollahi M, Bardwell L (2003). „Docking site in MKK4 Mediates High Affinity Binding to JNK MAPKs and competes with Similar Docking Sites in JNK Substrates“. Journal of Biological Chemistry. 278 (35): 32662–32672. doi:10,1074 / jbc.M304229200. PMC 3017503. PMID 12788955.
- ^ Ho DT, Bardwell AJ, Grewal S, Iverson C, Bardwell L (2006). „Interakční dokovací stránky JNK v MKK7 podporují vazbu a aktivaci proteinových kináz aktivovaných JNK mitogenem“. Journal of Biological Chemistry. 281 (19): 13169–13179. doi:10,1074 / jbc.M601010200. PMC 3017509. PMID 16533805.
- ^ Raman M, Chen W, Cobb MH (2007). "Diferenční regulace a vlastnosti MAPK". Onkogen. 26 (22): 3100–3112. doi:10.1038 / sj.onc.1210392. PMID 17496909.
- ^ Reményi A, Good MC, Lim WA (2006). "Dokovací interakce v sítích proteinových kináz a fosfatáz". Aktuální názor na strukturní biologii. 16 (6): 676–685. doi:10.1016 / j.sbi.2006.10.008. PMID 17079133.
- ^ Yao Z, Diener K, Wang XS, Zukowski M, Matsumoto G, Zhou G, Mo R, Sasaki T, Nishina H, Hui CC, Tan TH, Woodgett JP, Penninger JM (1997). "Aktivace stresem aktivovaných proteinových kináz / c-Jun N-terminálních proteinových kináz (SAPKs / JNKs) novou mitogenem aktivovanou proteinovou kinázou". The Journal of Biological Chemistry. 272 (51): 32378–32383. doi:10.1074 / jbc.272.51.32378. PMID 9405446.
- ^ A b C d E F G Asaoka Y, Nishina H (2010). „Různorodé fyziologické funkce MKK4 a MKK7 během rané embryogeneze“. Journal of Biochemistry. 148 (4): 393–401. doi:10.1093 / jb / mvq098. PMID 20801953.
- ^ „MKK7 (člověk)“. www.phosphosite.org. Citováno 2020-10-28.
- ^ A b C Nihalani D, Wong HN, Holzman LB (srpen 2003). „Nábor JNK do JIP1 a JNK závislá fosforylace JIP1 reguluje dynamiku a aktivaci JNK modulu“. J. Biol. Chem. 278 (31): 28694–702. doi:10,1074 / jbc.M304212200. PMID 12756254.
- ^ Hammond JW, Griffin K, Jih GT, Stuckey J, Verhey KJ (květen 2008). "Kooperativní versus nezávislá přeprava různých nákladů pomocí Kinesin-1". Provoz. 9 (5): 725–41. doi:10.1111 / j.1600-0854.2008.00722.x. hdl:2027.42/72137. PMID 18266909. S2CID 21901129.
- ^ Nihalani D, Wong H, Verma R, Holzman LB (duben 2007). "Rodina kináz Src přímo reguluje dynamiku a aktivaci modulu JIP1". Mol. Buňka. Biol. 27 (7): 2431–41. doi:10.1128 / MCB.01479-06. PMC 1899903. PMID 17242197.
- ^ Jaffe AB, hala A, Schmidt A (březen 2005). "Sdružení CNK1 s Rho guaninovými nukleotidovými výměnnými faktory řídí signální specificitu za Rho". Aktuální biologie. 15 (5): 405–12. doi:10.1016 / j.cub.2004.12.082. PMID 15753034. S2CID 16479940.
- ^ Karandikar M, Xu S, Cobb MH (prosinec 2000). „MEKK1 váže raf-1 a kaskádové komponenty ERK2“. Journal of Biological Chemistry. 275 (51): 40120–7. doi:10,1074 / jbc.M005926200. PMID 10969079.
- ^ Tournier C, Whitmarsh AJ, Cavanagh J, Barrett T, Davis RJ (1997). „Mitogenem aktivovaná protein kináza 7 je aktivátor c-Jun NH2-terminální kinázy“. Sborník Národní akademie věd Spojených států amerických. 94 (14): 7337–7342. Bibcode:1997PNAS ... 94.7337T. doi:10.1073 / pnas.94.14.7337. PMC 23822. PMID 9207092.
- ^ A b Cheng J, Yang J, Xia Y, Karin M, Su B (2000). "Synergická interakce MEK kinázy 2, c-Jun N-terminální kinázy (JNK) kinázy 2 a JNK1 vede k účinné a specifické aktivaci JNK1". Molekulární a buněčná biologie. 20 (7): 2334–2342. doi:10.1128 / MCB.20.7.2334-2342.2000. PMC 85399. PMID 10713157.
- ^ Kelkar N, Gupta S, Dickens M, Davis RJ (2000). "Interakce mitogenem aktivovaného signálního modulu proteinkinázy s neuronálním proteinem JIP3". Molekulární a buněčná biologie. 20 (3): 1030–1043. doi:10.1128 / MCB.20.3.1030-1043.2000. PMC 85220. PMID 10629060.
- ^ Matsuura H, Nishitoh H, Takeda K, Matsuzawa A, Amagasa T, Ito M, Yoshioka K, Ichijo H (2002). "Role lešení závislá na fosforylaci JSAP1 / JIP3 v signální cestě ASK1-JNK. Nový režim regulace kaskády MAP kinázy". Journal of Biological Chemistry. 277 (43): 40703–40709. doi:10,1074 / jbc.M202004200. PMID 12189133.
- ^ A b Yasuda J, Whitmarsh AJ, Cavanagh J, Sharma M, Davis RJ (1999). "JIP skupina mitogenem aktivovaných proteinových kinázových proteinů lešení". Molekulární a buněčná biologie. 19 (10): 7245–7254. doi:10,1128 / mcb.19.10.7245. PMC 84717. PMID 10490659.
- ^ Papa S, Zazzeroni F, Bubici C, Jayawardena S, Alvarez K, Matsuda S, Nguyen DU, Pham CG, Nelsbach AH, Melis T, De Smaele E, Tang WJ, D'Adamio L, Franzoso G (2004). „Gadd45β zprostředkovává potlačení signalizace JNK NF-kB zaměřením na MKK7 / JNKK2“. Přírodní buněčná biologie. 6 (2): 146–153. doi:10.1038 / ncb1093. PMID 14743220. S2CID 5250125.
- ^ Merritt SE, Mata M, Nihalani D, Zhu C, Hu X, Holzman LB (1999). „Smíšená linie kinázy DLK využívá jako substrát MKK7 a nikoli MKK4“. The Journal of Biological Chemistry. 274 (15): 10195–10202. doi:10.1074 / jbc.274.15.10195. PMID 10187804.
- ^ Negri S, Oberson A, Steinmann M, Sauser C, Nicod P, Waeber G, Schorderet DF, Bonny C (2000). „CDNA klonování a mapování nového proteinu ovlivňujícího ostrůvek-mozek / JNK“. Genomika. 64 (3): 324–330. doi:10,1006 / geno.2000.6129. PMID 10756100.
- ^ Zama T, Aoki R, Kamimoto T, Inoue K, Ikeda Y, Hagiwara M (2002). „Úloha lešení mitogenem aktivované proteinkinázové fosfatázy, SKRP1, pro signalizační cestu JNK“ (PDF). Journal of Biological Chemistry. 277 (26): 23919–23926. doi:10,1074 / jbc.M200838200. PMID 11959862. S2CID 12430487.
- ^ Zama T, Aoki R, Kamimoto T, Inoue K, Ikeda Y, Hagiwara M (2002). „Nová fosfatáza SKRP1 s dvojí specificitou interaguje s kinázou MAPK MKK7 a inaktivuje dráhu JNK MAPK. Implikace pro přesnou regulaci konkrétní dráhy MAPK“. Journal of Biological Chemistry. 277 (26): 23909–23918. doi:10,1074 / jbc.M200837200. PMID 11959861.
- ^ Naumov GN, Folkman J, Straume O, Akslen LA (2008). „Nádorově-cévní interakce a doba klidu nádoru“. APMIS. 116 (7–8): 569–85. doi:10.1111 / j.1600-0463.2008.01213.x. PMC 3508681. PMID 18834403.
- ^ Liu W, Zi M, Chi H, Jin J, Prehar S, Neyses L a kol. (Duben 2011). "Deprivace MKK7 v kardiomyocytech vyvolává srdeční selhání u myší, když jsou vystaveny tlakovému přetížení". Journal of Molecular and Cellular Cardiology. 50 (4): 702–11. doi:10.1016 / j.yjmcc.2011.01.013. PMID 21284947.
- ^ Yamasaki T, Kawasaki H, Arakawa S, Shimizu K, Shimizu S, Reiner O a kol. (Listopad 2011). „Stresem aktivovaná protein kináza MKK7 reguluje prodloužení axonů ve vyvíjející se mozkové kůře“. The Journal of Neuroscience. 31 (46): 16872–83. doi:10.1523 / JNEUROSCI.1111-11.2011. PMC 6633308. PMID 22090513.
- ^ Yamasaki, Tokiwa; Deki-Arima, Norie; Kaneko, Asahito; Miyamura, Norio; Iwatsuki, Mamiko; Matsuoka, Masato; Fujimori-Tonou, Noriko; Okamoto-Uchida, Yoshimi; Hirayama, červen; Marth, Jamey D .; Yamanashi, Yuji (2017). „Motorická dysfunkce závislá na věku v důsledku neuronově specifického narušení stresem aktivované proteinové kinázy MKK7“. Vědecké zprávy. 7 (1): 7348. Bibcode:2017NatSR ... 7.7348Y. doi:10.1038 / s41598-017-07845-x. ISSN 2045-2322. PMC 5544763. PMID 28779160.
Další čtení
- Lin, A (2006). "Signální cesta JNK (Molecular Biology Intelligence Unit)". Landes Bioscience. 1: 1–97. ISBN 978-1587061202.




