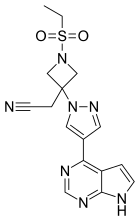
Baricitinib - Baricitinib
| |||
| Klinické údaje | |||
|---|---|---|---|
| Obchodní názvy | Olumiant, Baricinix | ||
| Ostatní jména | INCB28050, LY3009104 | ||
| AHFS /Drugs.com | Monografie | ||
| MedlinePlus | a618033 | ||
| Licenční údaje |
| ||
| Těhotenství kategorie | |||
| Trasy z správa | Pusou (tablety ) | ||
| ATC kód | |||
| Právní status | |||
| Právní status |
| ||
| Farmakokinetické data | |||
| Biologická dostupnost | 79% | ||
| Vazba na bílkoviny | 50% | ||
| Metabolismus | CYP3A4 (<10%) | ||
| Odstranění poločas rozpadu | 12,5 hodiny | ||
| Vylučování | 75% moči, 20% stolice | ||
| Identifikátory | |||
| |||
| Číslo CAS | |||
| PubChem CID | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| ChEBI | |||
| ChEMBL | |||
| PDB ligand | |||
| Řídicí panel CompTox (EPA) | |||
| Informační karta ECHA | 100.219.080 | ||
| Chemické a fyzikální údaje | |||
| Vzorec | C16H17N7Ó2S | ||
| Molární hmotnost | 371.42 g · mol−1 | ||
| 3D model (JSmol ) | |||
| |||
| |||
Baricitinib, prodávané pod značkou Olumiant je mimo jiné lékem k léčbě revmatoidní artritida (RA) u dospělých, jejichž onemocnění nebylo dobře kontrolováno pomocí RA léků nazývaných antagonisté faktoru nekrotizujícího nádory (TNF).[2] Působí jako inhibitor janus kinázy (JAK), blokování podtypů JAK1 a JAK2.[3] Droga je schválena pro použití v Evropské unii[4] a USA.[2][5]
Lékařské použití
V únoru 2017 byl baricitinib schválen pro použití v EU jako léčba druhé linie pro středně těžkou až těžkou aktivní revmatoidní artritidu u dospělých, buď samostatně, nebo v kombinaci s methotrexát.[6][4]
V dubnu 2017 dostal baricitinib od USA kompletní dopis s odpovědí (CRL) Úřad pro kontrolu potravin a léčiv (FDA), 2017.[Citace je zapotřebí ] V dopise bylo uvedeno, že FDA nemohl schválit žádost v její stávající podobě. Konkrétně FDA naznačil, že ke stanovení nejvhodnějších dávek jsou zapotřebí další klinická data a že jsou zapotřebí další údaje k další charakterizaci bezpečnostních obav ve všech léčebných ramenech.[Citace je zapotřebí ]
Dne 23. dubna 2018 poradní výbor FDA doporučil schválení baricitinibu 2 mg pro léčbu revmatoidní artritidy, ale nedoporučil dávku 4 mg s odvoláním na závažné nežádoucí účinky.[7] Dne 31. května 2018 schválila FDA barictinib pro léčbu dospělých pacientů se středně těžkou až těžce aktivní revmatoidní artritidou, u nichž byla nedostatečná odpověď na jednu nebo více terapií antagonisty TNF.[5][2][8]
V listopadu 2020 vydala FDA povolení nouzového použití (EUA) pro kombinaci baricitinibu s remdesivir, k léčbě podezřelých nebo laboratorně potvrzených COVID-19 u hospitalizovaných osob ve věku dvou let nebo starších vyžadujících doplňkový kyslík, invazivní mechanickou ventilaci nebo okysličení mimotělní membrány (ECMO).[9]
Kontraindikace
Během těhotenství je užívání baricitinibu kontraindikováno.[6][1]
Vedlejší efekty
Ve studiích infekce horních cest dýchacích a vysoká krev cholesterol úrovně (hypercholesterolemie ) se vyskytly u více než 10% pacientů. Méně časté nežádoucí účinky zahrnovaly další infekce, jako je herpes zoster, herpes simplex, infekce močového ústrojí, a gastroenteritida.[6]
Interakce
Bytost metabolizován pouze v malé míře má látka nízký potenciál pro interakce. Ve studiích inhibitory jaterních enzymů CYP3A4, CYP2C19, a CYP2C9, stejně jako CYP3A4 induktor rifampicin neměla žádný relevantní vliv na koncentrace baricitinibu v krvi. Zatímco baricitinib blokuje řadu transportní proteiny in vitro, klinicky relevantní interakce prostřednictvím tohoto mechanismu jsou považovány za velmi nepravděpodobné, snad s výjimkou transportéru kationtů SLC22A1 (OCT1).[6]
Aditivní účinek s jinými imunosupresiva nelze vyloučit.[6]
Farmakologie
Mechanismus účinku
Baricitinib je inhibitor Janus kinázy (JAK), který reverzibilně inhibuje Janus kináza 1 s poloviční maximální inhibiční koncentrace (IC50) z 5.9nM a Janus kináza 2 s IC50 5,7 nM. Tyrosinkináza 2, který patří do stejné rodiny enzymů, je ovlivněn méně (IC50 = 53 nM) a Janus kináza 3 mnohem méně (IC50 > 400 nM). Přes a signální transdukce cesta zahrnující STAT proteiny, to nakonec moduluje genová exprese v imunologických buňkách.[6]
Mezi další inhibitory JAK patří tofacitinib, který je indikován k léčbě revmatoidní artritidy, psoriatické artritidy a ulcerózní kolitidy;[10][11] fedratinib,[12] a ruxolitinib.[13][14]
Farmakokinetika
Látka se rychle vstřebává ze střeva absolutně biologická dostupnost 79%. Dosahuje nejvyšší krevní plazma úrovně asi po hodině; u různých jedinců se doba dosažení této úrovně pohybuje od 0,5 do 3 hodin. Příjem potravy nemá žádný relevantní vliv na farmakokinetiku léčiva. 50% cirkulujícího baricitinibu je vázáno na krev plazmatické proteiny.[6]
Méně než 10% látky je metabolizováno na čtyři různé oxidační produkty prostřednictvím CYP3A4; zbytek je ponechán beze změny. Poločas eliminace je v průměru 12,5 hodiny. Asi 75% je vylučováno močí a 20% vylučováno močí fekálie.[6]
Dějiny
Jak srpna 2016[Aktualizace] Bylo registrováno 31 klinických studií s baricitinibem, z nichž 24 bylo dokončeno,[15] a 4 ze 6 studií fáze 3 byly dokončeny.[16][potřebuje aktualizaci ]
V dubnu 2020 Lilly oznámila, že vyšetřuje použití baricitinibu k léčbě COVID-19 pacientů. Předpokládá se, že protizánětlivá aktivita léčiva působí na zánětlivou kaskádu spojenou s COVID-19.[17]
V listopadu 2020 zveřejněný výzkum ukázal, že barcitinib byl při léčbě pacientů s COVID-19 prospěšný. Podle příspěvku „mechanistické působení inhibitoru Janus kinázy-1/2 zaměřené na vstup viru, replikaci a cytokinovou bouři a je spojeno s příznivými výsledky, včetně těžce nemocných starších pacientů“.[18]
Tato sekce potřebuje expanzi. Můžete pomoci přidávat k tomu. (Dubna 2017) |
V klinické studii hospitalizovaných pacientů s COVID-19 bylo prokázáno, že baricitinib v kombinaci s remdesivirem zkracuje čas do zotavení do 29 dnů po zahájení léčby ve srovnání s pacienty, kteří dostávali placebo s remdesivirem.[9] Bezpečnost a účinnost této vyšetřovací terapie pro použití při léčbě COVID-19 je nadále hodnocena.[9] Baricitinib není registrován ani schválen jako samostatná léčba přípravku COVID-19.[9]
Údaje podporující EUA pro baricitinib v kombinaci s remdesivirem jsou založeny na randomizované, dvojitě zaslepené, placebem kontrolované klinické studii (ACTT-2), kterou provedl Národní institut pro alergie a infekční choroby (NIAID).[9] Tato klinická studie hodnotila, zda baricitinib ovlivnil, jak dlouho trvalo zotavení z COVID-19 u subjektů, které rovněž užívaly remdesivir.[9] Studie sledovala pacienty po dobu 29 dnů a zahrnovala 1 033 pacientů se středně těžkou nebo těžkou COVID-19; 515 pacientů dostávalo baricitinib plus remdesivir a 518 pacientů dostávalo placebo plus remdesivir.[9] Zotavení bylo definováno jako buď propuštění z nemocnice, nebo hospitalizace, ale nevyžadující doplňkový kyslík a již nevyžadující trvalou lékařskou péči.[9] Medián doby do zotavení z COVID-19 byl sedm dní pro baricitinib plus remdesivir a osm dní pro placebo plus remdesivir.[9] Šance na progresi stavu pacienta do smrti nebo ventilaci v den 29 byla nižší ve skupině s baricitinibem plus remdesivirem ve srovnání s placebem plus remdesivirem.[9] Šance na klinické zlepšení v den 15 byla vyšší ve skupině s baricitinibem plus remdesivirem ve srovnání s placebem plus remdesivirem.[9] U všech těchto koncových bodů byly účinky statisticky významné.[9] EUA byl vydán Eli Lilly and Company.[9]
Společnost a kultura
Právní status
V lednu 2016 předložila Eli Lilly a nová aplikace léku do USA Úřad pro kontrolu potravin a léčiv (FDA) pro schválení baricitinibu k léčbě středně těžké až těžké aktivní revmatoidní artritidy.[19]
V prosinci 2016 Výbor pro humánní léčivé přípravky (CHMP) z Evropská agentura pro léčivé přípravky (EMA) doporučil schválení baricitinibu jako léčby revmatoidní artritidy.[3] Schválení Evropské unie bylo uděleno v únoru 2017.[4]
Navzdory všeobecným očekáváním, že FDA schválí baricitinib pro revmatoidní artritidu,[20] v dubnu 2017 vydala FDA zamítnutí s odvoláním na obavy ohledně dávkování a bezpečnosti.[21][22]
V květnu 2018 byl baricitinib schválen ve Spojených státech pro léčbu revmatoidní artritidy.[7][2][5]
V březnu 2020 americký FDA udělil průlomová terapie označení pro baricitinib pro léčbu alopecia areata.[23]
Názvy značek
v Bangladéš droga se mimo jiné prodává pod obchodními názvy Baricinix a Baricent (Incepta Pharma).[Citace je zapotřebí ]
Reference
- ^ A b C „Použití baricitinibu (olumiantu) během těhotenství“. Drugs.com. 8. listopadu 2019. Citováno 16. března 2020.
- ^ A b C d „Snapshoty s drogovými zkouškami: Olumiant“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 31. května 2018. Citováno 16. března 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b „Shrnutí stanoviska pro Olumiant“ (PDF). Evropská agentura pro léčivé přípravky (EMA). 15. prosince 2016.
- ^ A b C „Olumiant EPAR“. Evropská agentura pro léčivé přípravky (EMA). 3. prosince 2019. Text byl zkopírován z tohoto zdroje, kterým je © Evropská agentura pro léčivé přípravky. Reprodukce je povolena za předpokladu, že je uveden zdroj.
- ^ A b C „Balíček pro schválení léků: Olumiant (baricitinib)“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 5. července 2018. Citováno 16. března 2020.
- ^ A b C d E F G h „Olumiant: EPAR - Informace o produktu“ (PDF). Evropská agentura pro léčivé přípravky. 13. února 2017.
- ^ A b Stručný dokument FDA - Zasedání poradního výboru pro artritidu
- ^ „Olumiant- baricitinib tableta potažená filmem“. DailyMed. 13. listopadu 2019. Citováno 16. března 2020.
- ^ A b C d E F G h i j k l m „Aktualizace koronaviru (COVID-19): FDA povoluje kombinaci léků pro léčbu COVID-19“. US Food and Drug Administration (Tisková zpráva). 19. listopadu 2020. Citováno 19. listopadu 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Tableta Xeljanz- tofacitinib, potahovaná tableta Xeljanz XR- tofacitinib, potahovaná, s prodlouženým uvolňováním“. DailyMed. 20. prosince 2019. Citováno 28. dubna 2020.
- ^ „FDA schvaluje Xeljanz pro revmatoidní artritidu“ (Tisková zpráva). 6. listopadu 2012.
- ^ "Tobolka inrebic-fedratinib hydrochloridu". DailyMed. 16. srpna 2019. Citováno 28. dubna 2020.
- ^ Mesa RA (červen 2010). „Ruxolitinib, selektivní inhibitor JAK1 a JAK2 k léčbě myeloproliferativních novotvarů a psoriázy“. Léky. 13 (6): 394–403. PMID 20506062.
- ^ „Tableta jakafiruxolitinibu“. DailyMed. 26. února 2020. Citováno 28. dubna 2020.
- ^ „Klinické studie s baricitinibem“. ClinicalTrials.gov.
- ^ „Klinické studie baricitinib fáze 3“. ClinicalTrials.gov.
- ^ „Eli Lilly studuje baricitinib pro léčbu Covid-19“. Arena pro klinické studie.
- ^ Stebbing J, Sánchez Nievas G, Falcone M, Youhanna S, Richardson P, Ottaviani S a kol. (Listopad 2020). „Inhibice JAK snižuje infekčnost jater SARS-CoV-2 a moduluje zánětlivé reakce ke snížení morbidity a mortality“. Sci Adv. doi:10.1126 / sciadv.abe4724. PMID 33187978.
- ^ „Lilly a Incyte oznamují předložení NDA FDA pro orální baricitinib podávaný jednou denně k léčbě středně těžké až těžké revmatoidní artritidy“. Drugs.com. 19. ledna 2016.
- ^ Carroll J (13. dubna 2017). „Nevíme, kdy (přesně) Lilly oznámí rozhodnutí FDA o baricitinibu, ale dejte si pozor na hrozící cenovou hádku.“. Koncové body Novinky.
- ^ Ramsey L (17. dubna 2017). „FDA sestřelil nový lék na revmatoidní artritidu - a společnosti, které tento lék vyrábějí, padají“. Business Insider.
- ^ Grant C (14. dubna 2017). „Překvapení, že FDA odmítne tuto biotechnologii“. The Wall Street Journal.
- ^ „Lilly obdržela označení průlomové terapie FDA pro baricitinib pro léčbu alopecie areata“ (Tisková zpráva). Eli Lilly a společnost. 16. března 2020. Citováno 16. března 2020 - prostřednictvím PR Newswire.
externí odkazy
- "Baricitinib". Informační portál o drogách. Americká národní lékařská knihovna.