10. ADAM - ADAM10
| Endopeptidáza ADAM10 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.4.24.81 | ||||||||
| Číslo CAS | 193099-09-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Protein obsahující desintegrin a metaloproteinázovou doménu 10, také známý jako 10. ADAM nebo CDw156 nebo CD156c je protein že u lidí je kódován 10. ADAM gen.[5]
Funkce
Členové ADAM rodina jsou proteiny buněčného povrchu s jedinečnou strukturou, které mají oba tyto potenciály přilnavost a proteáza domén. Sheddase, obecný název pro metalopeptidázu ADAM, funguje primárně ke štěpení membránových proteinů na buněčném povrchu. Jakmile jsou sheddázy uvolněny, uvolňují rozpustné ektodomény se změněným umístěním a funkcí.[6][7][8]
Ačkoli jeden sheddase může „shazovat“ různé látky, více sheddase může štěpit stejný substrát, což má různé důsledky. Tento gen kóduje člena rodiny ADAM, který štěpí mnoho proteinů, včetně TNF-alfa a E-kadherinu.[5]
ADAM10 (EC #: 3.4.24.81) je a sheddase, a má širokou specificitu pro reakce hydrolýzy peptidů.[9]
ADAM10 štěpí ephrin, v komplexu ephrin / eph, vytvořený mezi dvěma povrchy buněk. Když je efrin uvolněn z nepřátelské buňky, je celý komplex ephrin / eph endocytován. Toto prolévání v transu nebylo dříve ukázáno, ale může se dobře podílet na dalších událostech prolévání.[10]
v neurony „ADAM10 je nejdůležitější enzym s α-sekretáza aktivita pro proteolytický zpracování amyloidový prekurzorový protein.[11]
ADAM10 patří do podčeledi A, nejpřednější podrodiny proteinů ADAM, kterou sdílejí všechny hlavní skupiny zvířata, choanoflagellates, houby, a zelené řasy ze třídy Mamiellophyceae.[12]
Struktura
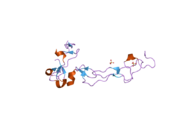
Ačkoli nebyly publikovány žádné krystalografické rentgenové difrakční analýzy, které by zobrazovaly celou strukturu ADAM10, byla pomocí této techniky studována jedna doména. Disintigrin a doména bohatá na cystein (ukázané vpravo) hrají zásadní roli v regulaci aktivity proteázy in vivo. Nedávné experimentální důkazy naznačují, že tato oblast, která je odlišná od aktivního místa, může být zodpovědná za substrátovou specificitu enzymu. Navrhuje se, že se tato doména váže na konkrétní oblasti substrátu enzymu, což umožňuje hydrolýzu peptidové vazby na přesně definovaných místech na určitých proteinech substrátu.[13]
Navrhované aktivní místo ADAM10 bylo identifikováno sekvenční analýzou a je identické s enzymy v rodině metaloproteinových domén Snake Venom. Konsenzuální sekvence pro katalyticky aktivní proteiny ADAM je ONXGHNLGXXHD. Strukturální analýza ADAM17, který má stejnou sekvenci aktivního místa jako ADAM10, naznačuje, že tři histidiny v této sekvenci váží Zn2+ atom a že glutamát je katalytickým zbytkem.[14]
Katalytický mechanismus
Ačkoli přesný mechanismus ADAM10 nebyl důkladně prozkoumán, jeho aktivní místo je homologní s těmi dobře studovaných zinečnatých proteáz, jako je karboxypeptidáza A a termolysin. Proto se navrhuje, aby ADAM10 využíval podobný mechanismus jako tyto enzymy. U proteáz zinku byly klíčové katalytické prvky identifikovány jako glutamátový zbytek a Zn2+ iont koordinovaný na histidinové zbytky.[15]
Navrhovaný mechanismus začíná deprotonací molekuly vody glutamátem. Výsledný hydroxid iniciuje nukleofilní útok na karbonylový uhlík na peptidové páteři a vytváří čtyřboký meziprodukt. Tento krok je usnadněn odběrem elektronů z kyslíku Zn2+ a následnou stabilizací zinku záporným nábojem na atomu kyslíku v přechodném stavu. Jak se elektrony pohybují dolů z atomu kyslíku, aby znovu vytvořily dvojnou vazbu, čtyřboký meziprodukt se zhroutí na produkty s protonací -NH zbytkem glutamátu.[15]
Klinický význam
Nemoci mozku
ADAM10 hraje klíčovou roli v modulaci molekulárních mechanismů odpovědných za tvorbu, zrání a stabilizaci dendritické páteře a v regulaci molekulární organizace glutamatergické synapsy. V důsledku toho je změna aktivity ADAM10 striktně korelována s nástupem různých typů synaptopatií, počínaje poruchami neurodevelopmentu, tj. Poruchami autistického spektra, až po neurodegenerativní onemocnění, tj. Alzheimerovu chorobu.[16]
Interakce s parazitem malárie
Řada různých proteinů na povrchu Plasmodium falciparum paraziti malárie pomáhají útočníkům vázat se na červené krvinky. Jakmile se však paraziti připojí k krevním buňkám hostitele, musí se zbavit „lepkavých“ povrchových proteinů, které by jinak interferovaly se vstupem do buňky. Enzym Sheddase, v tomto příkladu specificky nazývaný PfSUB2, je nutný pro parazity k napadení buněk; bez ní paraziti umírají. Sheddase je podle studie skladován a uvolňován z buněčných oddílů poblíž špičky parazita. Jakmile se enzym dostane na povrch, připojí se k motoru, který jej dopravuje zepředu dozadu a uvolňuje lepkavé povrchové proteiny. Když jsou tyto bílkoviny odstraněny, parazit získává vstup do červených krvinek. Celá invaze trvá asi 30 sekund a bez této metalopeptidázy ADAM by byla malárie neúčinná při napadení červených krvinek.[17]
Rakovina prsu
V kombinaci s nízkými dávkami herceptin selektivní inhibitory ADAM10 snižují proliferaci v HER2 nadměrně exprimující buněčné linie, zatímco inhibitory, které neinhibují ADAM10, nemají žádný dopad. Tyto výsledky jsou v souladu s tím, že ADAM10 je hlavním determinantem vylučování HER2, jehož inhibice může poskytnout nový terapeutický přístup k léčbě rakoviny prsu a řady dalších rakovin s aktivní signalizací HER2.[18]
Přítomnost produktu tohoto genu v neuronálních synapsích ve spojení s proteinem AP2 byl pozorován ve zvýšeném množství v hipokampálních neuronech Alzheimerova choroba pacientů.[19]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000137845 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000054693 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b „Entrez Gene: ADAM10 ADAM metalopeptidázová doména 10“.
- ^ Moss ML, Bartsch JW (červen 2004). "Terapeutické výhody z cílení na členy rodiny ADAM". Biochemie. 43 (23): 7227–35. doi:10.1021 / bi049677f. PMID 15182168.
- ^ Nagano O, Saya H (prosinec 2004). "Mechanismus a biologický význam štěpení CD44". Cancer Science. 95 (12): 930–5. doi:10.1111 / j.1349-7006.2004.tb03179.x. PMID 15596040.
- ^ Blobel CP (leden 2005). "ADAM: klíčové komponenty v signalizaci a vývoji EGFR". Recenze přírody. Molekulární buněčná biologie. 6 (1): 32–43. doi:10.1038 / nrm1548. PMID 15688065.
- ^ "Vstup endopeptidázy ADAM10 (číslo EC 3.4.24.81)".
- ^ Janes PW, Saha N, Barton WA, Kolev MV, Wimmer-Kleikamp SH, Nievergall E a kol. (Říjen 2005). „Adam meets Eph: modul pro rozpoznávání substrátu ADAM funguje jako molekulární přepínač pro štěpení efrinu v trans“. Buňka. 123 (2): 291–304. doi:10.1016 / j.cell.2005.08.014. PMID 16239146.
- ^ Haass C, Kaether C, Thinakaran G, Sisodia S (květen 2012). „Obchodování a proteolytické zpracování APP“. Perspektivy Cold Spring Harbor v medicíně. 2 (5): a006270. doi:10.1101 / cshperspect.a006270. PMC 3331683. PMID 22553493.
- ^ Souza J, Lisboa A, Santos T, Andrade M, Neves V, Teles-Souza J, Jesus H, Bezerra T, Falcão V, Oliveira R, Del-Bem L (2020). "Vývoj rodiny genů ADAM u eukaryotů". Genomika. doi:10.1016 / j.ygeno.2020.05.010.
- ^ Smith KM, Gaultier A, Cousin H, Alfandari D, White JM, DeSimone DW (prosinec 2002). „Doména bohatá na cystein reguluje funkci proteázy ADAM in vivo“. The Journal of Cell Biology. 159 (5): 893–902. doi:10.1083 / jcb.200206023. PMC 2173380. PMID 12460986.
- ^ Wolfsberg TG, Primakoff P, Myles DG, White JM (říjen 1995). „ADAM, nová rodina membránových proteinů obsahujících doménu disintegrin a metaloproteáza: multipotenciální funkce v interakcích buňka-buňka a buňka-matice“. The Journal of Cell Biology. 131 (2): 275–8. doi:10.1083 / jcb.131.2.275. PMC 2199973. PMID 7593158.
- ^ A b Lolis E, Petsko GA (1990). "Analogy přechodného stavu v krystalografii proteinů: sondy strukturního zdroje enzymové katalýzy". Roční přehled biochemie. 59: 597–630. doi:10.1146 / annurev.bi.59.070190.003121. PMID 2197984.
- ^ Marcello E, Borroni B, Pelucchi S, Gardoni F, Di Luca M (listopad 2017). „ADAM10 jako terapeutický cíl pro onemocnění mozku: od vývojových poruch po Alzheimerovu chorobu“. Znalecký posudek na terapeutické cíle. 21 (11): 1017–1026. doi:10.1080/14728222.2017.1386176. PMID 28960088.
- ^ "'Sheddase „pomáhá parazitům malárie napadnout červené krvinky“. Archivovány od originál dne 12. dubna 2008.
- ^ Liu PC, Liu X, Li Y, Covington M, Wynn R, Huber R a kol. (Červen 2006). "Identifikace ADAM10 jako hlavního zdroje aktivity HER2 ektodomény sheddase v HER2 nadměrně exprimujících buňkách rakoviny prsu". Biologie a terapie rakoviny. 5 (6): 657–64. doi:10,4161 / cbt. 5.6.6708. PMID 16627989.
- ^ Marcello E, Saraceno C, Musardo S, Vara H, de la Fuente AG, Pelucchi S, et al. (Červen 2013). "Endocytóza synaptického ADAM10 při neuronální plasticitě a Alzheimerově chorobě". The Journal of Clinical Investigation. 123 (6): 2523–38. doi:10.1172 / JCI65401. PMC 3668814. PMID 23676497.
Další čtení
- Wolfsberg TG, Primakoff P, Myles DG, White JM (říjen 1995). „ADAM, nová rodina membránových proteinů obsahujících doménu disintegrinu a metaloproteázy: multipotenciální funkce v interakcích buňka-buňka a buňka-matice“. The Journal of Cell Biology. 131 (2): 275–8. doi:10.1083 / jcb.131.2.275. PMC 2199973. PMID 7593158.
- O'Bryan JP, Fridell YW, Koski R, Varnum B, Liu ET (leden 1995). „Transformující se receptorová tyrosinkináza, Axl, je posttranslačně regulována proteolytickým štěpením“. The Journal of Biological Chemistry. 270 (2): 551–7. doi:10.1074 / jbc.270.2.551. PMID 7822279.
- Howard L, Lu X, Mitchell S, Griffiths S, Glynn P (červenec 1996). „Molekulární klonování MADM: katalyticky aktivní savčí disintegrin-metaloproteáza exprimovaná v různých typech buněk“. The Biochemical Journal. 317 (Pt 1) (1): 45–50. doi:10.1042 / bj3170045. PMC 1217484. PMID 8694785.
- McKie N, Edwards T, Dallas DJ, Houghton A, Stringer B, Graham R a kol. (Leden 1997). "Exprese členů nové membránově vázané metaloproteinázové rodiny (ADAM) v lidských kloubních chondrocytech". Sdělení o biochemickém a biofyzikálním výzkumu. 230 (2): 335–9. doi:10.1006 / bbrc.1996.5957. PMID 9016778.
- Rosendahl MS, Ko SC, Long DL, Brewer MT, Rosenzweig B, Hedl E a kol. (Září 1997). „Identifikace a charakterizace pro-nádorového nekrotického faktoru-alfa-zpracovávajícího enzymu z rodiny metaloproteáz zinku ADAM“. The Journal of Biological Chemistry. 272 (39): 24588–93. doi:10.1074 / jbc.272.39.24588. PMID 9305925.
- Yamazaki K, Mizui Y, Tanaka I (říjen 1997). "Radiační hybridní mapování lidského genu ADAM10 na chromozom 15". Genomika. 45 (2): 457–9. doi:10.1006 / geno.1997.4910. PMID 9344679.
- Yamazaki K, Mizui Y, Sagane K, Tanaka I (prosinec 1997). „Přiřazení genu disintegrinové a metaloproteinázové domény 10 (Adam10) myšímu chromozomu 9“. Genomika. 46 (3): 528–9. doi:10.1006 / geno.1997.5043. PMID 9441766.
- Yavari R, Adida C, Bray-Ward P, solanky M, Xu T (červenec 1998). „Lidská metaloproteáza-dezintegrace Kuzbanian reguluje osud sympatoadrenálních buněk ve vývoji a neoplazii“. Lidská molekulární genetika. 7 (7): 1161–7. doi:10,1093 / hmg / 7.7.1161. PMID 9618175.
- Dallas DJ, Genever PG, Patton AJ, Millichip MI, McKie N, Skerry TM (červenec 1999). "Lokalizace receptorů ADAM10 a Notch v kosti". Kost. 25 (1): 9–15. doi:10.1016 / S8756-3282 (99) 00099-X. PMID 10423016.
- Dias Neto E, Correa RG, Verjovski-Almeida S, Briones MR, Nagai MA, da Silva W a kol. (Březen 2000). "Brokovnicové sekvenování lidského transkriptomu se značkami sekvencí exprimovanými ORF". Sborník Národní akademie věd Spojených států amerických. 97 (7): 3491–6. Bibcode:2000PNAS ... 97.3491D. doi:10.1073 / pnas.97.7.3491. PMC 16267. PMID 10737800.
- Hattori M, Osterfield M, Flanagan JG (srpen 2000). "Regulované štěpení kontaktem zprostředkovaného repelentu axonů". Věda. 289 (5483): 1360–5. Bibcode:2000Sci ... 289,1360H. doi:10.1126 / science.289.5483.1360. PMID 10958785.
- Vincent B, Paitel E, Saftig P, Frobert Y, Hartmann D, De Strooper B a kol. (Říjen 2001). „Disintegriny ADAM10 a TACE přispívají ke konstitutivnímu a forbolesterem regulovanému normálnímu štěpení buněčného prionového proteinu“. The Journal of Biological Chemistry. 276 (41): 37743–6. doi:10,1074 / jbc.M105677200. PMID 11477090.
- Chubinskaya S, Mikhail R, Deutsch A, Tindal MH (září 2001). „Protein ADAM-10 je přítomen v lidské kloubní chrupavce primárně ve formě vázané na membránu a je upregulován při osteoartritidě a v reakci na IL-1alfa v bovinní nosní chrupavce.“ The Journal of Histochemistry and Cytochemistry. 49 (9): 1165–76. doi:10.1177/002215540104900910. PMID 11511685.
- Lemjabbar H, Basbaum C (leden 2002). „Receptor faktoru aktivujícího trombocyty a ADAM10 zprostředkovávají reakce na Staphylococcus aureus v epitelových buňkách“. Přírodní medicína. 8 (1): 41–6. doi:10,1038 / nm0102-41. PMID 11786905.
- Healy EF, Romano P, Mejia M, Lindfors G (listopad 2010). „Acetylenické inhibitory ADAM10 a ADAM17: in silico analýza účinnosti a selektivity“. Journal of Molecular Graphics & Modeling. 29 (3): 436–42. doi:10.1016 / j.jmgm.2010.08.006. PMID 20863729.
- Arndt M, Lendeckel U, Röcken C, Nepple K, Wolke C, Spiess A a kol. (Únor 2002). "Změněná exprese ADAM (A Disintegrin And Metalloproteinase) ve fibrilačních lidských síních". Oběh. 105 (6): 720–5. doi:10.1161 / hc0602.103639. PMID 11839628.
- Colciaghi F, Borroni B, Pastorino L, Marcello E, Zimmermann M, Cattabeni F a kol. (Únor 2002). „a-sekreáza ADAM10 stejně jako a a APP je snížena u krevních destiček a mozkomíšního moku u pacientů s Alzheimerovou chorobou“. Molekulární medicína. 8 (2): 67–74. doi:10.1007 / BF03402076. PMC 2039975. PMID 12080182.
- Lim R, Winteringham LN, Williams JH, McCulloch RK, Ingley E, Tiao JY a kol. (Říjen 2002). „MADM, nový adaptační protein, který zprostředkovává fosforylaci vazebného místa 14-3-3 faktoru 1 myeloidní leukemie“ (PDF). The Journal of Biological Chemistry. 277 (43): 40997–1008. doi:10,1074 / jbc.M206041200. PMID 12176995.
- Gatta LB, Albertini A, Ravid R, Finazzi D (listopad 2002). „Úrovně mRNA beta-sekretázy BACE a alfa-sekretázy ADAM10 v Alzheimerově hipokampu“. NeuroReport. 13 (16): 2031–3. doi:10.1097/00001756-200211150-00008. PMID 12438920.
- Gutwein P, Mechtersheimer S, Riedle S, Stoeck A, Gast D, Joumaa S a kol. (Únor 2003). „Štěpení adhezní molekuly L1 zprostředkované ADAM10 na povrchu buňky a v uvolněných membránových váčcích“. FASEB Journal. 17 (2): 292–4. doi:10.1096 / fj.02-0430fje. PMID 12475894.
externí odkazy
- 10. ADAM umístění lidského genu v UCSC Genome Browser.
- 10. ADAM podrobnosti o lidském genu v UCSC Genome Browser.
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: O14672 (Protein 10 obsahující dezintegrin a metaloproteinázovou doménu) na PDBe-KB.
Tento článek včlení text z United States National Library of Medicine, který je v veřejná doména.