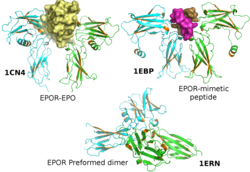
Erytropoetinový receptor - Erythropoietin receptor
The receptor erytropoetinu (EpoR) je protein že u lidí je kódován EPOR gen.[5] EpoR je 52kDa peptid s jediným sacharidovým řetězcem, jehož výsledkem je n přibližně 56-57 kDa proteinu nacházejícího se na povrchu buněk reagujících na EPO. Je členem cytokinový receptor rodina. EpoR již existuje jako dimery[6] který po navázání 30 kDa ligandu erytropoetin (Epo), mění svůj homodimerizovaný stav. Tyto konformační změny vedou k autofosforylace z Jak2 kinázy, které jsou předem asociovány s receptorem (tj. EpoR nemá vnitřní aktivitu kinázy a závisí na aktivitě Jak2).[7][8] V současnosti je nejznámější funkcí EpoR podpora šíření a záchrany erytroid (červené krvinky) předci z apoptóza.[5]
Funkce a mechanismus účinku
Cytoplazmatické domény EpoR obsahují řadu fosfotyrosinů, které jsou fosforylovaný podle Jak2 a slouží jako dokovací místa pro různé aktivátory intracelulární dráhy a statistiky (jako např Stat5 ). Kromě aktivace Ras / AKT a ERK / MAP kinázy fosfatidylinositol 3-kináza / AKT cesta a Faktory transkripce STAT, fosfotyrosiny také slouží jako dokovací místa pro fosfatázy, které negativně ovlivňují signalizaci EpoR, aby se zabránilo nadměrné aktivaci, která může vést k takovým poruchám, jako je erytrocytóza. Obecně mohou vznikat defekty na receptoru erytropoetinu erytroleukémie a familiární erytrocytóza. Mutace v Jak2 kinázách spojené s EpoR mohou také vést k polycythemia vera.[9]
Přežití erytroidů
Primární rolí EpoR je podporovat proliferaci erytroidních progenitorových buněk a zachránit erythroidní progenitory před buněčnou smrtí.[10] Signalizace Jak2-Stat5 indukovaná EpoR spolu s transkripčním faktorem GATA-1 indukuje transkripci proteinu B-xL pro přežití.[11] EpoR se navíc podílí na potlačení exprese receptorů smrti Fas, Trail a TNFa, které negativně ovlivňují erytropoézu.[12][13][14]
Na základě současných důkazů stále není známo, zda Epo / EpoR přímo způsobují „proliferaci a diferenciaci“ erytroidních progenitorů in vivo, ačkoli tyto přímé účinky byly popsány na základě práce in vitro.
Diferenciace erytroidů
Předpokládá se, že diferenciace erytroidů primárně závisí na přítomnosti a indukci transkripčních faktorů erytroidu, jako jsou GATA-1, FOG-1 a EKLF, a také na potlačení transkripčních faktorů myeloid / lymfoid, jako je PU.1.[15] Přímé a významné účinky signalizace EpoR konkrétně na indukci erytroidně specifických genů, jako je beta-globin, byly hlavně nepolapitelné. Je známo, že GATA-1 může indukovat expresi EpoR.[16] Signální dráha EpoR PI3-K / AKT zase zvyšuje aktivitu GATA-1.[17]
Buněčný cyklus / proliferace erytroidů
Indukce proliferace EpoR je pravděpodobně závislá na typu buňky. Je známo, že EpoR může aktivovat mitogenní signální dráhy a může vést k proliferaci buněk v erytroleukemických buněčných liniích in vitro, různé neerytroidní buňky a rakovinné buňky. Zatím o tom neexistují dostatečné důkazy in vivo„Signalizace EpoR může indukovat progenitory erytroidů k dělení buněk nebo k tomu, zda mohou hladiny Epo modulovat buněčný cyklus.[10] Signalizace EpoR může stále mít proliferační účinek na progenitory BFU-e, ale tyto progenitory nelze přímo identifikovat, izolovat a studovat. Progenitory CFU-e vstupují do buněčného cyklu v době indukce GATA-1 a potlačení PU.1 spíše vývojově než v důsledku signalizace EpoR.[18] Následné diferenciační stádia (proerytroblast na ortochromatický erytroblast) zahrnují zmenšení velikosti buněk a případné vypuzení jádra a jsou pravděpodobně závislé na signalizaci EpoR pouze pro jejich přežití. Některé důkazy o makrocytóze při hypoxickém stresu (kdy se Epo může zvýšit 1000krát) navíc naznačují, že mitóza je ve skutečnosti přeskočeno v pozdějších erytroidních stádiích, kdy je exprese EpoR nízká / chybí, aby byla co nejdříve zajištěna nouzová rezerva červených krvinek.[19][20] Tyto údaje, i když někdy nepřímé, tvrdí, že existuje omezená kapacita konkrétního rozmnožování v reakci na Epo (a nikoli jiné faktory). Společně tato data naznačují, že EpoR v diferenciaci erytroidů může fungovat primárně jako faktor přežití, zatímco jeho účinek na buněčný cyklus (například rychlost dělení a odpovídající změny hladin cyklinů a inhibitorů Cdk) in vivo čeká na další práci. V jiných buněčných systémech však EpoR může poskytovat specifický proliferativní signál.
Závazek multipotentních předků k erytroidní linii
Role EpoR v závazku počtu řádků je v současné době nejasná. Exprese EpoR se může rozšířit až do zadní části prostoru pro hematopoetické kmenové buňky.[21] Není známo, zda signalizace EpoR hraje a tolerantní (tj. indukuje pouze přežití) nebo an instruktivní (tj. zvyšuje hladinu erytroidních markerů na zámek progenitory na předem určenou diferenciační dráhu) v časných multipotentních progenitorech, aby produkovali dostatečné množství erytroblastů. Současné publikace v této oblasti naznačují, že je primárně tolerantní. Ukázalo se, že tvorba progenitorů BFU-e a CFU-e je normální u embryí hlodavců vyřazených buď pro Epo, nebo EpoR.[22] Argumentem proti takovému nedostatku požadavků je, že v reakci na Epo nebo hypoxický stres se dramaticky zvyšuje počet časných stadií erytroidů, BFU-e a CFU-e. Není však jasné, zda se jedná o poučný signál, nebo opět o tolerantní signál. Jedním dalším bodem je, že signální dráhy aktivované EpoR jsou společné pro mnoho dalších receptorů; nahrazení EpoR receptorem prolaktinu podporuje přežití a diferenciaci erytroidů in vitro.[23][24] Společně tato data naznačují, že závazek k erytroidní linii pravděpodobně nenastane kvůli dosud neznámé poučné funkci EpoR, ale pravděpodobně kvůli jeho roli v přežití ve fázích multipotentního předka.
Studie na zvířatech o mutacích epo receptoru
Myši se zkráceným EpoR[25] jsou životaschopné, což naznačuje, že aktivita Jak2 je dostatečná k podpoře bazální erytropoézy aktivací nezbytných drah bez nutnosti dokovacích míst pro fosfotyrosin. EpoR-H forma zkrácení EpoR obsahuje první, a co lze argumentovat, nejdůležitější tyrosin 343, který slouží jako dokovací místo pro molekulu Stat5, ale postrádá zbytek cytoplazmatického ocasu. Tyto myši vykazují zvýšenou erytropoézu v souladu s myšlenkou, že nábor fosfatázy (a tedy ukončení signalizace) je u těchto myší aberantní.
Receptor EpoR-HM také postrádá většinu cytoplazmatické domény a obsahuje tyrosin 343, který byl mutován na fenylalanin, takže je nevhodný pro efektivní připojení a aktivaci Stat5. Tyto myši jsou anemické a vykazují špatnou reakci na hypoxický stres, jako je léčba fenylhydrazinem nebo injekce erytropoetinu.[25]
EpoR knockoutované myši mají poruchy srdce, mozku a vaskulatury. Tyto defekty mohou být způsobeny blokováním tvorby červených krvinek, a tedy nedostatečným dodáváním kyslíku do vyvíjejících se tkání, protože myši konstruované tak, aby exprimovaly receptory Epo pouze v erytroidních buňkách, se vyvíjejí normálně.
Klinický význam
Mohou se vyskytnout defekty receptoru erytropoetinu erytroleukémie a rodinné erytrocytóza.[5] Nadprodukce červených krvinek zvyšuje pravděpodobnost nežádoucích kardiovaskulárních příhod, jako je trombóza a mrtvice.
Zřídka se mohou objevit zdánlivě prospěšné mutace v EpoR, kde zvýšený počet červených krvinek umožňuje lepší dodávání kyslíku při atletických vytrvalostních akcích bez zjevných nepříznivých účinků na zdraví sportovce (jako například u finského sportovce Eero Mäntyranta ).[26]
Uvádí se, že erytropoetin udržuje endoteliální buňky a podporuje nádor angiogeneze, proto může dysregulace EpoR ovlivnit růst určitých nádorů.[27][28] Tato hypotéza však není všeobecně přijímána.
Interakce
Ukázalo se, že receptor erytropoetinu komunikovat s:
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000187266 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000006235 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C „Entrez Gene: EPOR erythropoietin receptor“.
- ^ Livnah O, Stura EA, Middleton SA, Johnson DL, Jolliffe LK, Wilson IA (únor 1999). "Krystalografický důkaz pro preformované dimery receptoru erytropoetinu před aktivací ligandu". Věda. 283 (5404): 987–90. doi:10.1126 / science.283.5404.987. PMID 9974392.
- ^ Youssoufian H, Longmore G, Neumann D, Yoshimura A, Lodish HF (květen 1993). "Struktura, funkce a aktivace receptoru erytropoetinu". Krev. 81 (9): 2223–36. doi:10,1182 / krev. V81.9.2223.2223. PMID 8481505.
- ^ Wilson IA, Jolliffe LK (prosinec 1999). "Struktura, organizace, aktivace a plasticita receptoru erytropoetinu". Aktuální názor na strukturní biologii. 9 (6): 696–704. doi:10.1016 / S0959-440X (99) 00032-9. PMID 10607675.
- ^ James C, Ugo V, Le Couédic JP, Staerk J, Delhommeau F, Lacout C, Garçon L, Raslova H, Berger R, Bennaceur-Griscelli A, Villeval JL, Constantinescu SN, Casadevall N, Vainchenker W (duben 2005). "Unikátní klonální mutace JAK2 vedoucí ke konstitutivní signalizaci způsobuje polycythemii vera". Příroda. 434 (7037): 1144–8. doi:10.1038 / nature03546. PMID 15793561. S2CID 4399974.
- ^ A b Koury MJ, Bondurant MC (duben 1990). „Erytropoetin zpomaluje rozpad DNA a zabraňuje programované smrti v erytroidních progenitorových buňkách“. Věda. 248 (4953): 378–81. doi:10.1126 / science.2326648. PMID 2326648.
- ^ Socolovsky M, Fallon AE, Wang S, Brugnara C, Lodish HF (červenec 1999). „Fetální anémie a apoptóza progenitorů červených krvinek u myší Stat5a - / - 5b - / -: přímá role Stat5 při indukci Bcl-X (L)“. Buňka. 98 (2): 181–91. doi:10.1016 / S0092-8674 (00) 81013-2. PMID 10428030. S2CID 17925652.
- ^ De Maria R, Testa U, Luchetti L, Zeuner A, Stassi G, Pelosi E, Riccioni R, Felli N, Samoggia P, Peschle C (únor 1999). "Apoptotická role systému Fas / Fas ligandů v regulaci erytropoézy". Krev. 93 (3): 796–803. doi:10,1182 / krev. V93.3.796. PMID 9920828.
- ^ Liu Y, Pop R, Sadegh C, Brugnara C, Haase VH, Socolovsky M (červenec 2006). „Potlačení koexprese Fas-FasL erytropoetinem zprostředkovává expanzi erytroblastů během reakce erytropoetického stresu in vivo“. Krev. 108 (1): 123–33. doi:10.1182 / krev-2005-11-4458. PMC 1895827. PMID 16527892.
- ^ Felli N, Pedini F, Zeuner A, Petrucci E, Testa U, Conticello C, Biffoni M, Di Cataldo A, Winkles JA, Peschle C, De Maria R (srpen 2005). „Několik členů nadčeledi TNF přispívá k inhibici erytropoézy zprostředkované IFN-gama“. Journal of Immunology. 175 (3): 1464–72. doi:10,4049 / jimmunol.175.3.1464. PMID 16034083.
- ^ Cantor AB, Orkin SH (květen 2002). „Transkripční regulace erytropoézy: záležitost zahrnující více partnerů“. Onkogen. 21 (21): 3368–76. doi:10.1038 / sj.onc.1205326. PMID 12032775.
- ^ Zon LI, Youssoufian H, Mather C, Lodish HF, Orkin SH (prosinec 1991). "Aktivace promotoru receptoru erytropoetinu transkripčním faktorem GATA-1". Sborník Národní akademie věd Spojených států amerických. 88 (23): 10638–41. doi:10.1073 / pnas.88.23.10638. PMC 52985. PMID 1660143.
- ^ Zhao W, Kitidis C, Fleming MD, Lodish HF, Ghaffari S (únor 2006). „Erytropoetin stimuluje fosforylaci a aktivaci GATA-1 prostřednictvím signální dráhy PI3-kináza / AKT“. Krev. 107 (3): 907–15. doi:10.1182 / krev-2005-06-2516. PMC 1895894. PMID 16204311.
- ^ Pop R, Shearstone JR, Shen Q, Liu Y, Hallstrom K, Koulnis M, Gribnau J, Socolovsky M (2010). „Klíčový krok závazku v erytropoéze je synchronizován s hodinami buněčného cyklu prostřednictvím vzájemné inhibice mezi PU.1 a progresí S-fáze“. PLOS Biology. 8 (9): e1000484. doi:10.1371 / journal.pbio.1000484. PMC 2943437. PMID 20877475.
- ^ Seno S, Miyahara M, Asakura H, Ochi O, Matsuoka K, Toyama T (listopad 1964). „Makrocytóza vyplývající z rané denukleace prekurzorů erytroidu“. Krev. 24 (5): 582–93. doi:10,1182 / krev. V24.5.582.582. PMID 14236733.
- ^ Borsook H, Lingrel JB, Scaro JL, Millette RL (říjen 1962). "Syntéza hemoglobinu ve vztahu k zrání erytroidních buněk". Příroda. 196 (4852): 347–50. doi:10.1038 / 196347a0. PMID 14014098. S2CID 34948124.
- ^ Forsberg EC, Serwold T, Kogan S, Weissman IL, Passegué E (červenec 2006). „Nové důkazy podporující megakaryocytový-erytrocytový potenciál flk2 / flt3 + multipotentních hematopoetických předků“. Buňka. 126 (2): 415–26. doi:10.1016 / j.cell.2006.06.037. PMID 16873070.
- ^ Wu H, Liu X, Jaenisch R, Lodish HF (říjen 1995). „Generace aktivovaných progenitorů erytroidních BFU-E a CFU-E nevyžaduje erytropoetin ani receptor erytropoetinu“. Buňka. 83 (1): 59–67. doi:10.1016/0092-8674(95)90234-1. PMID 7553874. S2CID 17401291.
- ^ Socolovsky M, Fallon AE, Lodish HF (září 1998). „Receptor prolaktinu zachraňuje EpoR - / - erytroidní progenitory a nahrazuje EpoR v synergické interakci s c-kitem“. Krev. 92 (5): 1491–6. doi:10,1182 / krev. V92.5.1491. PMID 9716574.
- ^ Socolovsky M, Dusanter-Fourt I, Lodish HF (květen 1997). „Receptor prolaktinu a výrazně zkrácené receptory erytropoetinu podporují diferenciaci erytroidních progenitorů“. The Journal of Biological Chemistry. 272 (22): 14009–12. doi:10.1074 / jbc.272.22.14009. PMID 9162017.
- ^ A b Zang H, Sato K, Nakajima H, McKay C, Ney PA, Ihle JN (červen 2001). „Distální oblast a receptorové tyrosiny receptoru Epo nejsou pro erytropoézu in vivo nezbytné“. Časopis EMBO. 20 (12): 3156–66. doi:10.1093 / emboj / 20.12.3156. PMC 150206. PMID 11406592.
- ^ de la Chapelle A, Träskelin AL, Juvonen E (květen 1993). „Zkrácený erytropoetinový receptor způsobuje dominantně zděděnou benigní lidskou erytrocytózu“. Sborník Národní akademie věd Spojených států amerických. 90 (10): 4495–9. doi:10.1073 / pnas.90.10.4495. PMC 46538. PMID 8506290.
- ^ Farrell F, Lee A (2004). "Erytropoetinový receptor a jeho exprese v nádorových buňkách a jiných tkáních". Onkolog. 9 Suppl 5: 18–30. doi:10.1634 / theoncologist.9-90005-18. PMID 15591419.
- ^ Jelkmann W, Bohlius J, Hallek M, Sytkowski AJ (červenec 2008). "Erytropoetinový receptor v normálních a rakovinných tkáních". Kritické recenze v onkologii / hematologii. 67 (1): 39–61. doi:10.1016 / j.critrevonc.2008.03.006. PMID 18434185.
- ^ Chin H, Saito T, Arai A, Yamamoto K, Kamiyama R, Miyasaka N, Miura O (říjen 1997). „Erytropoetin a IL-3 indukují fosforylaci tyrosinu CrkL a jeho asociaci s Shc, SHP-2 a Cbl v hematopoetických buňkách“. Sdělení o biochemickém a biofyzikálním výzkumu. 239 (2): 412–7. doi:10.1006 / bbrc.1997.7480. PMID 9344843.
- ^ Arai A, Kanda E, Nosaka Y, Miyasaka N, Miura O (srpen 2001). „CrkL se získává prostřednictvím své domény SH2 na receptor erytropoetinu a hraje roli v signalizaci receptoru zprostředkovaného Lyn“. The Journal of Biological Chemistry. 276 (35): 33282–90. doi:10,1074 / jbc.M102924200. PMID 11443118.
- ^ Middleton SA, Barbone FP, Johnson DL, Thurmond RL, You Y, McMahon FJ, Jin R, Livnah O, Tullai J, Farrell FX, Goldsmith MA, Wilson IA, Jolliffe LK (květen 1999). „Sdílené a jedinečné determinanty receptoru erytropoetinu (EPO) jsou důležité pro vazbu EPO a EPO mimetického peptidu“. The Journal of Biological Chemistry. 274 (20): 14163–9. doi:10.1074 / jbc.274.20.14163. PMID 10318834.
- ^ Livnah O, Johnson DL, Stura EA, Farrell FX, Barbone FP, You Y, Liu KD, Goldsmith MA, He W, Krause CD, Pestka S, Jolliffe LK, Wilson IA (listopad 1998). „Komplex antagonistický peptid-EPO receptor naznačuje, že dimerizace receptoru není pro aktivaci dostatečná“. Přírodní strukturní biologie. 5 (11): 993–1004. doi:10.1038/2965. PMID 9808045. S2CID 24052881.
- ^ Tauchi T, Feng GS, Shen R, Hoatlin M, Bagby GC, Kabat D, Lu L, Broxmeyer HE (březen 1995). „Zapojení fosfotyrosin fosfatázy Syp obsahující SH2 do signálních transdukčních drah receptoru erytropoetinu“. The Journal of Biological Chemistry. 270 (10): 5631–5. doi:10.1074 / jbc.270.10.5631. PMID 7534299.
- ^ Feng GS, Ouyang YB, Hu DP, Shi ZQ, Gentz R, Ni J (květen 1996). „Grap je nový adaptační protein SH3-SH2-SH3, který spojuje tyrosinkinázy s cestou Ras“. The Journal of Biological Chemistry. 271 (21): 12129–32. doi:10.1074 / jbc.271.21.12129. PMID 8647802.
- ^ Huang LJ, Constantinescu SN, Lodish HF (prosinec 2001). „N-koncová doména Janus kinázy 2 je nutná pro Golgiho zpracování a expresi erytropoetinového receptoru na povrchu buňky.“ Molekulární buňka. 8 (6): 1327–38. doi:10.1016 / S1097-2765 (01) 00401-4. PMID 11779507.
- ^ Witthuhn BA, Quelle FW, Silvennoinen O, Yi T, Tang B, Miura O, Ihle JN (červenec 1993). „JAK2 se asociuje s receptorem erytropoetinu a po stimulaci erytropoetinem je fosforylován a aktivován tyrosinem.“ Buňka. 74 (2): 227–36. doi:10.1016 / 0092-8674 (93) 90414-L. PMID 8343951. S2CID 37503350.
- ^ Chin H, Arai A, Wakao H, Kamiyama R, Miyasaka N, Miura O (květen 1998). „Lyn se fyzicky asociuje s receptorem erytropoetinu a může hrát roli při aktivaci dráhy Stat5“. Krev. 91 (10): 3734–45. doi:10,1182 / krev. V91.10.3734. PMID 9573010.
- ^ Shigematsu H, Iwasaki H, Otsuka T, Ohno Y, Arima F, Niho Y (květen 1997). „Role vav protoonkogenního produktu (Vav) v buněčné proliferaci zprostředkované erytropoetinem a aktivitě fosfatidylinositol 3-kinázy“. The Journal of Biological Chemistry. 272 (22): 14334–40. doi:10.1074 / jbc.272.22.14334. PMID 9162069.
- ^ Damen JE, Cutler RL, Jiao H, Yi T, Krystal G (říjen 1995). „Fosforylace tyrosinu 503 v erytropoetinovém receptoru (EpR) je nezbytná pro vazbu na podjednotku P85 fosfatidylinositol (PI) 3-kinázy a pro aktivitu PI 3-kinázy související s EpR“. The Journal of Biological Chemistry. 270 (40): 23402–8. doi:10.1074 / jbc.270.40.23402. PMID 7559499.
- ^ Klingmüller U, Lorenz U, Cantley LC, Neel BG, Lodish HF (březen 1995). „Specifický nábor SH-PTP1 na receptor erytropoetinu způsobuje inaktivaci JAK2 a ukončení proliferativních signálů“. Buňka. 80 (5): 729–38. doi:10.1016/0092-8674(95)90351-8. PMID 7889566. S2CID 16866005.
- ^ Eyckerman S, Verhee A, der Heyden JV, Lemmens I, Ostade XV, Vandekerckhove J, Tavernier J (prosinec 2001). „Design and application of cytokine-receptor-based interaction trap“. Přírodní buněčná biologie. 3 (12): 1114–9. doi:10.1038 / ncb1201-1114. PMID 11781573. S2CID 10228882.
- ^ Sasaki A, Yasukawa H, Shouda T, Kitamura T, Dikic I, Yoshimura A (září 2000). „CIS3 / SOCS-3 potlačuje signalizaci erytropoetinu (EPO) vazbou na receptor EPO a JAK2“. The Journal of Biological Chemistry. 275 (38): 29338–47. doi:10,1074 / jbc.M003456200. PMID 10882725.
- ^ Hörtner M, Nielsch U, Mayr LM, Heinrich PC, Haan S (květen 2002). "Nové vysoce afinitní vazebné místo pro supresor cytokinové signalizace-3 na receptoru erytropoetinu". European Journal of Biochemistry / FEBS. 269 (10): 2516–26. doi:10.1046 / j.1432-1033.2002.02916.x. PMID 12027890.
- ^ Chin H, Nakamura N, Kamiyama R, Miyasaka N, Ihle JN, Miura O (prosinec 1996). „Fyzické a funkční interakce mezi Stat5 a tyrosin-fosforylovanými receptory pro erytropoetin a interleukin-3“. Krev. 88 (12): 4415–25. doi:10.1182 / krev.V88.12.4415.bloodjournal88124415. PMID 8977232.
Další čtení
- Zhu Y, D'Andrea AD (březen 1994). "Molekulární fyziologie erytropoetinu a receptoru erytropoetinu". Aktuální názor na hematologii. 1 (2): 113–8. PMID 9371269.
- Lacombe C, Mayeux P (srpen 1998). "Biologie erytropoetinu". Haematologica. 83 (8): 724–32. PMID 9793257.
- Bonifacino JS (leden 2002). "Kontrola kvality signálních komplexů receptor-kináza". Vývojová buňka. 2 (1): 1–2. doi:10.1016 / S1534-5807 (01) 00114-9. PMID 11782306.
- Takeshita A, Shinjo K, Naito K, Ohnishi K, Higuchi M, Ohno R (únor 2002). "Erytropoetinový receptor u myelodysplastického syndromu a leukémie". Leukémie a lymfom. 43 (2): 261–4. doi:10.1080/10428190290006026. PMID 11999556. S2CID 34605746.
- Kralovics R, Škoda RC (leden 2005). "Molekulární patogeneze Philadelphia chromozom negativních myeloproliferativních poruch". Krevní recenze. 19 (1): 1–13. doi:10.1016 / j.blre.2004.02.002. PMID 15572213.
- Madeddu P, Emanueli C (březen 2007). „Zapnutí reparativní angiogeneze: základní role vaskulárního erytropoetinového receptoru“. Výzkum oběhu. 100 (5): 599–601. doi:10.1161 / 01.RES.0000261610.11754.b1. PMC 2827860. PMID 17363704.
externí odkazy
- Erytropoetin + receptory v americké národní lékařské knihovně Lékařské předměty (Pletivo)
Tento článek včlení text z United States National Library of Medicine, který je v veřejná doména.