Přirozeně se vyskytující fenoly - Naturally occurring phenols - Wikipedia
v biochemie, přirozeně se vyskytující fenoly odkazuje na fenol funkční skupina který se nachází v přírodní produkty.[1][2][3] Fenolové sloučeniny jsou produkovány rostlinami a mikroorganismy.[4] Organismy někdy syntetizují fenolové sloučeniny v reakci na ekologické tlaky, jako je napadení patogeny a hmyzem, UV záření a poranění.[5] Protože jsou přítomny v potravinách konzumovaných v lidské stravě a v rostlinách používaných v tradiční medicína z několika kultur je jejich role v lidském zdraví a nemoci předmětem výzkumu.[1][5][6][7]:104 Některé fenoly jsou germicidní a používají se při přípravě dezinfekčních prostředků.


Klasifikace
Rozličný klasifikace lze použít schémata.[8]:2 Běžně používané schéma je založeno na počtu uhlíků a bylo navrženo Jeffrey Harborne a Simmonds v roce 1964 a publikováno v roce 1980:[8]:2[9]
| Počet atomů uhlíku | Základní kostra | Počet fenolických cyklů | Třída | Příklady |
|---|---|---|---|---|
| 6 | C6 | 1 | Jednoduché fenoly, Benzochinony | Katechol, hydrochinon, 2,6-dimethoxybenzochinon |
| 7 | C6-C1 | 1 | Fenolové kyseliny, Fenolové aldehydy | Kyseliny gallové, salicylové |
| 8 | C6-C2 | 1 | Acetofenony, Deriváty tyrosinu, Kyseliny fenyloctové | 3-Acetyl-6-methoxybenzaldehyd, Tyrosol, Kyselina p-hydroxyfenyloctová, Kyselina homogentisová |
| 9 | C6-C3 | 1 | Hydroxycinamové kyseliny, Fenylpropeny, Kumariny, Isokumariny, Chromony | Kofeová, ferulové kyseliny, myristicin, Eugenol, Umbelliferon, aesculetin, Bergenon, Eugenin |
| 10 | C6-C4 | 1 | Naftochinony | Juglone, Plumbagin |
| 13 | C6-C1-C6 | 2 | Xanthonoidy | Mangiferin |
| 14 | C6-C2-C6 | 2 | Stilbenoidy, Antrachinony | Resveratrol, Emodin |
| 15 | C6-C3-C6 | 2 | Chalkonoidy, Flavonoidy, Isoflavonoidy, Neoflavonoidy | Kvercetin, kyanidin, Genistein |
| 16 | C6-C4-C6 | 2 | Halogenované řasové fenolové sloučeniny | Kaviol A., colpol |
| 18 | (C6-C3)2 | 2 | Lignany, Neolignany | Pinoresinol, eusiderin |
| 30 | (C6-C3-C6)2 | 4 | Biflavonoidy | Amentoflavon |
| mnoho | (C6-C3)n, (C6)n, (C6-C3-C6)n | n> 12 | Ligniny, Katechol melaniny, Flavolans (Kondenzované taniny ), Polyfenolové proteiny, Polyfenoly | Malinový ellagitannin, Kyselina tříslová |
V této Harborneově klasifikaci nejsou C6-C7-C6 diarylheptanoidy.
Mohou být také klasifikovány na základě jejich počtu fenolových skupin. Lze je tedy volat jednoduché fenoly nebo monofenoly, pouze s jednou fenolickou skupinou, nebo di- (bi-), tri- a oligofenolyse dvěma, třemi nebo několika fenolickými skupinami.
Rozmanitá rodina přírodních fenolů je flavonoidy, které zahrnují několik tisíc sloučenin, mezi nimi i flavonoly, flavony, flavan-3ol (katechiny), flavanony, antokyanidiny, a isoflavonoidy.[10]
Fenolovou jednotku lze nalézt dimerizovanou nebo dále polymerizovanou, čímž se vytvoří nová třída polyfenolu. Například, kyselina ellagová je dimer kyseliny gallové a tvoří třídu ellagitanninů, nebo a katechin a gallocatechin se může spojit za vzniku červené sloučeniny theaflavin, což je proces, jehož výsledkem je také velká třída hnědé thearubigins v čaji.
Dva přírodní fenoly ze dvou různých kategorií, například flavonoid a lignan, se mohou spojit a vytvořit hybridní třídu, jako je flavonolignany.
Nomenklatura polymery:
| Základní jednotka: |  |  |  |
|---|---|---|---|
| Třída / polymer: | Hydrolyzovatelné taniny | Flavonoid, Kondenzované taniny |
Hybridní chemické třídy
Rostliny rodu Humulus a Konopí produkují terpenofenolové metabolity, sloučeniny, které jsou meroterpeny.[11] Fenolové lipidy jsou dlouhé alifatické řetězce vázané k fenolové skupině.
Chirality
Mnoho přírodních fenolů je chirální. Příkladem takových molekul je katechin. Cavicularin je neobvyklý makrocykl, protože to byla první sloučenina izolovaná ze zobrazování přírody optická aktivita kvůli přítomnosti planární chirality a axiální chirality.
UV viditelná absorbance
Přírodní fenoly vykazují optické vlastnosti charakteristické pro benzen, např. absorpce blízko 270 nm. Podle Woodwardova pravidla, bathochromické posuny často se také stává, že naznačuje přítomnost delokalizovaných π elektronů vznikajících z a časování mezi benzenem a vinyly skupiny.[12]
Jelikož molekuly s vyšší úrovní konjugace procházejí tímto fenoménem bathochromického posunu, je část viditelného spektra absorbována. Vlnové délky ponechané v procesu (obvykle v červené části spektra) mění složení barva konkrétní látky. Acylace s skořicovými kyselinami o antokyanidiny posunutá barevná tonalita (CIE Laboratoř úhel odstínu) až nachový.[13]
Zde je řada UV viditelné spektra molekul klasifikovaných zleva doprava podle úrovně jejich konjugace:
 UV viditelné spektrum kyselina gallová, s lambda max kolem 270 nm. |  UV viditelné spektrum kyselina ferulová, s lambda max na 321 a ramenem na 278 nm. |  UV viditelné spektrum kvercetin, s lambda max při 369 nm. |  UV viditelné spektrum kyanidin-3-O-glukosid (chryzantém), s lambda max při 518 nm. |
 Chemická struktura kyselina gallová, kyselina fenolová. | 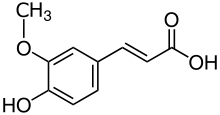 Chemická struktura kyselina ferulová kyselina hydroxycinamová. |  Chemická struktura kvercetin, flavonol. | 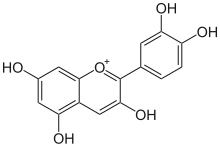 Chemická struktura kyanidin anthocyanidin. |
Absorpční vzor zodpovědný za červenou barvu antokyany může doplňovat zelenou chlorofyl ve fotosynteticky aktivních tkáních, jako jsou mladí Quercus coccifera listy.[14]
Oxidace

Přírodní fenoly jsou reaktivní druh k oxidace, zejména komplexní směs fenolických látek, která se nachází například v potravinách, může podstoupit autoxidace během procesu stárnutí. Jednoduché přírodní fenoly mohou vést k tvorbě Prokyanidiny typu B. ve vínech[15] nebo v modelových řešeních.[16][17] To souvisí s neenzymatické hnědnutí charakteristika změny barvy tohoto procesu.[18] Tento jev lze pozorovat v potravinách, jako jsou mrkvové pyré.[19]
Browning spojený s oxidací fenolových sloučenin byl také uveden jako příčina smrti buněk v calli vytvořen v in vitro kultur. Tyto fenolické látky pocházejí jak z tkání explantátu, tak ze sekretů explantátu.
Fenolové sloučeniny
Přirozeně se vyskytující
| Kanabinoidy | aktivní složky konopí |
| Kapsaicin | štiplavá sloučenina chilli papričky |
| Carvacrol | nalezeno v, mj., oregano; antimikrobiální a neuroprotektant[20] |
| Kresol | nalezen v uhelný dehet a kreozot |
| Estradiol | estrogen - hormony |
| Eugenol | hlavní složka esenciální olej z stroužek |
| Kyselina gallová | nalezen v koule |
| Guaiacol | (2-methoxyfenol) - má kouř příchuť, a nachází se v pražený káva, whisky, a kouř |
| Methylsalicylát | hlavní složka éterického oleje z zimní zelená |
| Malinový keton | sloučenina s intenzivním malina čich |
| Kyselina salicylová | prekurzorová sloučenina na Aspirin (při výrobě se používá chemická syntéza) |
| Serotonin / dopamin / adrenalin / noradrenalin | přírodní neurotransmitery |
| Thymol | (2-Isopropyl-5-methylfenol) - nalezen v tymián; an antiseptický který se používá v ústní vody |
| Tyrosin | an aminokyselina |
| Sesamol | přirozeně se vyskytující sloučenina nalezená v sezamová semínka |
Syntetický
| Fenol | mateřská sloučenina, použitá jako a dezinfekční prostředek a pro chemická syntéza |
| Bisfenol A | a další bisfenoly vyrobené z ketonů a fenolu / kresolu |
| BHT | (butylovaný hydroxytoluen) - rozpustný v tucích antioxidant a potravinářská přídatná látka |
| 4-Nonylfenol | produkt rozpadu čistící prostředky a nonoxynol-9 |
| Orthofenylfenol | A fungicid používá se pro voskování citrusové plody |
| Kyselina pikrová | (trinitrofenol) - an výbušný materiál |
| Fenolftalein | indikátor pH |
| Xylenol | používá se v antiseptických a dezinfekčních prostředcích |
Biosyntéza
Fenolika jsou tvořena třemi různými biosyntetickými cestami: (i) cestou shikimate / chorizmatu nebo sukcinylbenzoátu, která produkuje deriváty fenylpropanoidu (C6 – C3); ii) cesta octanu / malonátu nebo polyketidu, která produkuje fenylpropanoidy s prodlouženým postranním řetězcem, včetně velké skupiny flavonoidů (C6 – C3 – C6) a některých chinonů; a (iii) cestu acetát / mevalonát, která dehydrogenačními reakcemi produkuje aromatické terpenoidy, většinou monoterpeny.[21][22] Aromatická aminokyselina fenylalanin, syntetizovaný v dráha kyseliny shikimové, je běžným prekurzorem aminokyselin a fenolických sloučenin obsahujících fenol.
V rostlinách jsou fenolové jednotky esterifikovaný nebo methylovaný a jsou předloženy časování, což znamená, že přírodní fenoly se většinou nacházejí v glykosid formulář místo aglykon formulář.
V olivovém oleji, tyrosol tvoří estery s mastnými kyselinami.[23] V žitě alkylresorcinoly jsou fenolové lipidy.
Některé acetylace zahrnují terpeny jako geraniol.[24] Tyto molekuly se nazývají meroterpeny (chemická sloučenina mající částečnou terpenoidní strukturu).
K methylaci může dojít vytvořením éter vazba na hydroxylové skupiny tvořící O-methylované polyfenoly. V případě O-methylovaný flavon tangeritin, všech pět hydroxylových skupin je methylovaných, přičemž nezůstávají žádné volné hydroxylové skupiny fenolové skupiny. Methylace může také nastat na přímo na uhlíku benzenového kruhu, jako v případě poriol, a C-methylovaný flavonoid.
Biologický rozklad
Houba bílé hniloby Phanerochaete chrysosporium může odstranit až 80% fenolických sloučenin z koksování odpadní voda.[25]
Aplikace
Triesloviny se používají v koželužském průmyslu.
Některé přírodní fenoly lze použít jako biopesticidy. Furanoflavonoidy jako karanjin nebo rotenoidy se používají jako akaricid nebo insekticid.[26]
Enologické třísloviny jsou důležitými prvky v chuti vína.[27]
Některé fenoly se prodávají jako doplňky stravy. Fenoly byly zkoumány jako drogy. Například, Crofelemer (USAN, obchodní název Fulyzaq) je léčivý přípravek vyvíjený k léčbě průjmů spojených s léky proti HIV. Navíc byly vyrobeny deriváty fenolické sloučeniny, combretastatin A-4, protirakovinová molekula, včetně atomů dusíku nebo halogenů, pro zvýšení účinnosti léčby.[28]
Průmyslové zpracování a analýza
Extrakce fenolem
Extrakce fenolem je technologie zpracování používaná k přípravě fenolů jako surovin, sloučenin nebo přísad pro průmyslové zpracování dřeva a pro chemický průmysl.
Extrakce lze provést za použití různých rozpouštědel. Existuje riziko, že polyfenol oxidáza (PPO) degraduje fenolický obsah vzorku, proto je třeba použít inhibitory PPO, jako je draslík dithionit (K.2S2Ó4) nebo provést experiment s kapalným dusíkem nebo vzorek několik sekund vařit (blanšírování ) k deaktivaci enzymu. Dále frakcionace extraktu lze dosáhnout použitím extrakce na pevné fázi kolony a může vést k izolaci jednotlivých sloučenin.
Obnova přírodních fenolů ze zbytků biomasy je součástí biorafinace.[29]
Oddělení
pKA fenolických sloučenin lze vypočítat z retenční čas v kapalinová chromatografie.[30][31]
Analytické metody
Lze použít studie o hodnocení antioxidační kapacity elektrochemické metody.[32]
Detekci lze provést rekombinantní světélkující bakteriální senzory.[33]
Profilování
Fenolického profilování lze dosáhnout pomocí kapalinová chromatografie – hmotnostní spektrometrie (LC / MS).[34]
Kvantifikace
Metoda kvantifikace fenolického obsahu je volumetrická titrace. Oxidační činidlo, manganistan, se používá k oxidaci známých koncentrací standardního roztoku za vzniku a standardní křivka. Obsah neznámých fenolů se poté vyjádří jako ekvivalenty příslušného standardu.
Některé metody kvantifikace celkového fenolického obsahu jsou založeny na kolorimetrický Měření. Celkové fenoly (nebo antioxidační účinek) lze měřit pomocí Folin-Ciocalteuova reakce. Výsledky jsou obvykle vyjádřeny jako ekvivalenty kyseliny gallové (GAE). Chlorid železitý (FeCl3) test je také kolorimetrický test.
Lamaison a Carnet navrhli test pro stanovení celkového obsahu flavonoidů ve vzorku (AlCI3 metoda). Po správném promíchání vzorku a činidla se směs inkubuje 10 minut při teplotě okolí a odečte se absorbance roztoku při 440 nm. Obsah flavonoidů je vyjádřen v mg / g kvercetinu.[35]
Výsledky kvantifikace produkované pomocí detektor diodového pole -připojeno HPLC jsou obecně uváděny spíše jako relativní než absolutní hodnoty protože chybí komerčně dostupné standardy pro každou fenolickou molekulu. Tuto techniku lze také spojit s hmotnostní spektrometrie (například HPLC – DAD–ESI / MS) pro přesnější molekulu identifikace.
Hodnocení antioxidačního účinku
- In vitro Měření
Jiné testy měří antioxidační kapacitu frakce. Někteří používají 2,2'-azino-bis (3-ethylbenzothiazolin-6-sulfonovou kyselinu) (ABTS ) radikální kation, který je reaktivní vůči většině antioxidantů včetně fenolik, thioly a vitamín C.[36] Během této reakce se modrý ABTS radikální kation převede zpět do své bezbarvé neutrální formy. Reakce může být sledována spektrofotometricky. Tento test se často označuje jako Trolox ekvivalentní antioxidační kapacita (TEAC). Reaktivita různých testovaných antioxidantů se srovnává s reaktivitou Trolox, což je vitamin E. analogový.
Další testy antioxidační kapacity, které používají Trolox jako standard, zahrnují difenylpikrylhydrazyl (DPPH), absorpční kapacita kyslíkových radikálů (ORAC), železo snižující schopnost plazmy (FRAP) testy nebo inhibice katalyzované mědí in vitro člověk lipoprotein s nízkou hustotou oxidace.[37]
Existuje také test buněčné antioxidační aktivity (CAA). Dichlorofluorescin je sonda, která je zachycena v buňkách a je snadno oxidována na fluorescenci dichlorfluorescein (DCF). Metoda měří schopnost sloučenin zabránit tvorbě DCF pomocí 2,2'-Azobis (2-amidinopropan) dihydrochlorid (ABAP) generované peroxylové radikály v lidském hepatokarcinomu HepG2 buňky.[38]
Mezi další metody patří butylovaný hydroxytoluen (BHT), butylovaný hydroxyanisol (BHA), Rancimatova metoda (Rancidification Assessment of Fat).[39]
- In vivo modely
Larvy modelového zvířete Galleria mellonella, také zvaný voskové červy, lze použít k testování antioxidačního účinku jednotlivých molekul pomocí kyselina boritá v potravinách k vyvolání vyvolaného oxidačního stresu.[40] Obsah malondialdehyd, indikátor oxidačního stresu a aktivity antioxidačních enzymů superoxiddismutáza, kataláza, glutathion S-transferáza a glutathionperoxidáza lze sledovat. Profenoloxidáza lze také získat z hmyzu.[41]
Genetická analýza
Fenolické biosyntetické a metabolické dráhy a enzymy lze studovat pomocí transgeneze genů. The Arabidopsis regulační gen pro produkci Antokyanin Pigment 1 (AtPAP1) lze exprimovat u jiných druhů rostlin.[42]
Přirozené výskyty
Fenoly se nacházejí v přírodním světě, zejména v rostlinné říši.
Výskyt u prokaryot
Orobol najdete v Streptomyces neyagawaensis (Actinobacterium).[Citace je zapotřebí ] Fenolové sloučeniny lze nalézt v sinice Arthrospira maxima, používaný v doplňku stravy, Spirulina.[43] Tři sinice Microcystis aeruginosa, Cylindrospermopsis raciborskii a Oscilátor sp. jsou předmětem výzkumu přírodní produkce butylovaný hydroxytoluen (BHT),[44] antioxidant, přísada do potravin a průmyslová chemie.
Proteobacterium Pseudomonas fluorescens vyrábí phloroglucinol, kyselina floroglucinolkarboxylová a diacetylfloroglucinol.[45] Dalším příkladem fenolických látek produkovaných v proteobakteriích je 3,5-dihydroxy-4-isopropyl-trans-stilben, bakteriální stilbenoid produkovaný v Photorhabdus bakteriální symbionty Heterorhabditida hlístice.
Výskyt hub
Fenolové kyseliny lze nalézt v houbách bazidiomycety druh.[46] Například, kyselina protocatechuová a pyrokatechol se nacházejí v Agaricus bisporus[47] stejně jako další fenylované látky jako fenylacetický a kyseliny fenylpyruvové. Jiné sloučeniny jako atromentin a kyselina telephorová lze také izolovat z hub v Agaricomycetes třída. Orobol, an isoflavon, lze izolovat od Aspergillus niger.
- v kvasnicích
Aromatické alkoholy (příklad: tyrosol ) jsou produkovány kvasinkami Candida albicans.[48] Oni jsou také nalezeni v pivo.[49] Tyto molekuly jsou snímání kvora sloučeniny pro Saccharomyces cerevisiae.[50]
- Metabolismus
Arylalkohol dehydrogenáza používá aromatický alkohol a NAD+ vyrábět aromatický aldehyd, NADH a H+.
Arylalkohol dehydrogenáza (NADP +) používá aromatický alkohol a NADP+ vyrábět aromatický aldehyd, NADPH a H+.
Aryldialkylfosfatáza (také známý jako organofosforová hydroláza, fosfotriesteráza a paraoxonhydroláza) používá aryl-dialkylfosfát a H2O k výrobě dialkylfosfátu a arylalkoholu.
Výskyty lišejníků
Kyselina gyroforová, a depside, a orcinol se nacházejí v lišejník.[51]
Výskyt řas
The zelená řasa Botryococcus braunii je předmětem výzkumu přírodní produkce butylovaný hydroxytoluen (BHT),[44] antioxidant, přísada do potravin a průmyslová chemie.
Fenolové kyseliny jako např protocatechuic, p-hydroxybenzoová, 2,3-dihydroxybenzoová, chlorogenní, vanilka, kávový, str- kumarická a kyselina salicylová, kyselina skořicová a hydroxybenzaldehydy, jako jsou p-hydroxybenzaldehyd, 3,4-dihydroxybenzaldehyd, vanilin byly izolovány z in vitro kultury sladkovodní zelené řasy Spongiochloris spongiosa.[52]
Phlorotanniny, například eckol, se nacházejí v hnědé řasy. Vidalenolon lze nalézt v tropickém prostředí červená řasa Vidalia sp.[53]
Výskyt v suchozemských rostlinách (embryofyty)
Výskyt v cévnatých rostlinách
Fenolové sloučeniny se většinou nacházejí v cévnatých rostlin (tracheofyty), tj. Lycopodiophyta[54] (lykožruti), Pteridophyta (kapradiny a přesličky), Krytosemenné rostliny (kvetoucí rostliny nebo Magnoliophyta) a Gymnospermy[55] (jehličnany, cykasy, Ginkgo a Gnetales ).[Citace je zapotřebí ]
V kapradinách, sloučeniny, jako jsou kaempferol a jeho glukosid lze izolovat od methanolový extrakt z lístků z Phegopteris connectilis[56] nebo kaempferol-3-O-rutinosid, známý hořce chutnající flavonoidový glykosid, lze izolovat z oddenků Selliguea feei.[57] Kyselina hypogalická, kyselina kávová, paeoniflorin a pikurosid lze izolovat od sladkovodní kapradiny Salvinia molesta.[58]
V jehličnanech (Pinophyta) jsou fenolické látky skladovány v polyfenolické formě parenchyma buňky, tkáň hojná v phloem všech jehličnanů.[59]
The vodní rostlina Myriophyllum spicatum vyrábí ellagický, galský a pyrogalické kyseliny a (+) -katechin.[60]
Výskyty v jednoděložných rostlinách
Alkylresorcinoly lze nalézt v obilovinách.[Citace je zapotřebí ]
2,4-Bis (4-hydroxybenzyl) fenol je fenolická sloučenina nalezená v orchidejích Gastrodia elata a Galeola faberi.[Citace je zapotřebí ]
Výskyty v nevaskulárních rostlinách
Fenolika lze nalézt také v nevaskulárních suchozemských rostlinách (mechorosty ). Dihydrostilbenoidy a bis (bibenzyl) lze nalézt v játrech (Marchantiophyta ), například makrocykly cavicularin a riccardin C.. Ačkoli lignin chybí v mechy (Bryophyta) a hornworts (Anthocerotophyta), v těchto dvou taxonech lze nalézt některé fenolické látky.[61] Například, kyselina rosmarinová a v hornwortu se nachází 3'-O-β-D-glukosid kyseliny rosmarinové Anthoceros agrestis.[62]
Výskyty v jiných eukaryotech
Výskyt u hmyzu
Vytvrzování proteinové složky hmyzí kutikula Bylo prokázáno, že je to způsobeno činěním činidla vyrobeného oxidací formování fenolické látky sklerotin.[Citace je zapotřebí ] Při analogickém kalení švába ootheca, příslušnou fenolovou látkou je kyselina 3: 4-dihydroxybenzoová (kyselina protocatechuová ).[63]
Acetosyringon je produkován chyceným samcem (Leptoglossus phyllopus ) a použitý v jeho komunikačním systému.[64][65][66] Guaiacol se vyrábí ve střevech Pouštní kobylky, Schistocerca gregariarozložením rostlinného materiálu. Tento proces provádí střevní bakterie Pantoea aglomerans.[67] Guaiacol je jednou z hlavních složek feromonů, které způsobují rojení akát.[68] Orcinol byl detekován v „toxickém lepidle“ druhů mravenců Camponotus saundersi.[Citace je zapotřebí ] Rhynchophorus ferrugineus (červená dlaň weevil) použití 2-methoxy-4-vinylfenol pro chemickou signalizaci (feromony ).[69] Další jednoduché a složité fenoly lze nalézt v eusociálních mravencích (např Crematogaster ) jako složky jedu.[70]
Výskyt u savců
U slonů byly tyto dvě sloučeniny 3-ethylfenol a 2-ethyl 4,5 dimethylfenol byly detekovány ve vzorcích moči.[71] Vyšetření sekrece spánkových žláz ukázalo přítomnost fenol, m-kresol a p-kresol (4-methylfenol) během musth u mužů sloni.[72][73][74]
p-kresol a o-kresol jsou také složkami člověka potit se.[Citace je zapotřebí ] P-kresol je také hlavní složkou v prase zápach.[75]
4-Ethylfenol, 1,2-dihydroxybenzen, 3-hydroxyacetofenon, 4-methyl-l, 2-dihydroxybenzen, 4-methoxyacetofenon, Kyselina 5-methoxysalicylová, salicylaldehyd, a Kyselina 3-hydroxybenzoová jsou součástí castoreum, výpotek z kolečkových vaků dospělého bobra severoamerického (Castor canadensis ) a bobr evropský (Ricinové vlákno ), který se používá v parfumerii.[76]
Role
V některých případech jsou přírodní fenoly přítomny ve vegetativním složení olistění odradit bylinožravý, například v případě Dub západní jed.[77]
Role v půdě
v půdy Předpokládá se, že se z rozkladu uvolňuje větší množství fenolů vrh rostlin spíše než pádem v jakémkoli přirozeném rostlinném společenství.[Citace je zapotřebí ] Rozklad mrtvého rostlinného materiálu způsobuje, že složité organické sloučeniny jsou pomalu oxidovány lignin -jako humus nebo se rozpadnout na jednodušší formy (cukry a aminocukry, alifatické a fenolové organické kyseliny), které se dále transformují na mikrobiální biomasu (mikrobiální humus) nebo se reorganizují a dále oxidují na huminové sestavy (fulvic a humín kyseliny), na které se váží jílové minerály a hydroxidy kovů.[Citace je zapotřebí ] Probíhá dlouhá debata o schopnosti rostlin přijímat huminové látky ze svých kořenových systémů a metabolizovat je.[Citace je zapotřebí ] Nyní existuje shoda ohledně toho, jak humus hraje ve fyziologii rostlin spíše roli hormonální než jen výživnou.[Citace je zapotřebí ]
V půdě čelí rozpustné fenoly čtyřem různým osudům. Mohly by být degradovány a mineralizovány jako zdroj uhlíku heterotrofní mikroorganismy; mohou být transformovány na nerozpustné a vzpurné humín látky polymeračními a kondenzačními reakcemi (s přispěním půdních organismů); mohou se adsorbovat jílové minerály nebo formulář cheláty s ionty hliníku nebo železa; nebo mohou zůstat v rozpuštěné formě, vyluhovány prosakující vodou a nakonec opustit ekosystém jako součást rozpuštěný organický uhlík (DOC).[4]
Loužení je proces, při kterém kationty jako žehlička (Fe) a hliník (Al), stejně jako organické látky, jsou odstraněny z odpadu a transportovány dolů do půdy níže. Tento proces je znám jako podzolizace a je obzvláště intenzivní v boreálních a chladných mírných lesích, které jsou převážně tvořeny jehličnatý borovice, jejichž odpadky jsou bohaté na fenolové sloučeniny a kyselina fulvová.[78]
Role v přežití
Fenolové sloučeniny mohou působit jako ochranné látky, inhibitory, přirozené toxické látky pro zvířata a pesticidy proti napadajícím organismům, tj. Býložravcům, hlístům, fytofágnímu hmyzu a houbovým a bakteriálním patogenům. Vůně a pigmentace způsobené jinými fenoliky mohou přilákat symbiotické mikroby, opylovače a zvířata, která šíří ovoce.[21]
Obrana proti predátorům
Těkavé fenolové sloučeniny se nacházejí v rostlině pryskyřice kde mohou přilákat dobrodince jako parazitoidy nebo dravci býložravců, kteří na rostlinu útočí.[79]
U řas Alaria marginata „Fenoly působí jako chemická ochrana proti býložravcům.[80] V tropických Sargassum a Turbinaria druhy, které často přednostně konzumují býložravý Ryby a echinoidy, je zde relativně nízká úroveň fenolických látek a tříslovin.[81] Mořské alelochemikálie jsou obecně přítomny ve větším množství a rozmanitosti v tropických oblastech než v mírných oblastech. Fenoly mořských řas byly hlášeny jako zjevná výjimka z tohoto biogeografického trendu. Vysoké koncentrace fenolu se vyskytují u druhů hnědých řas (řády Dictyotales a Fucales ) z mírných i tropických oblastí, což naznačuje zeměpisná šířka sám o sobě není rozumným prediktorem koncentrací rostlinných fenolů.[82]
Obrana proti infekci
v Vitis vinifera hroznový, trans-resveratrol je fytoalexin produkovaný proti růstu plísňových patogenů, jako je Botrytis cinerea[83] a delta-viniferin je další réva fytoalexin produkoval následující plísňové infekce podle Plasmopara viticola.[84] Pinosylvin je preinfekční stilbenoid toxin (tj. syntetizovaný před infekcí), na rozdíl od fytoalexiny, které se syntetizují během infekce. Je přítomen v jádrové dřevo z Pinaceae.[85] Je to fungitoxin chránící dřevo před plísňové infekce.[86]
Sakuranetin je flavanon, druh flavonoidu. Najdete jej v Polymnia fruticosa[87] a rýže, kde působí jako a fytoalexin proti klíčení spor Pyricularia oryzae.[88] v Čirok, SbF3'H2 gen, kódující a flavonoid 3'-hydroxyláza, se zdá být vyjádřen v patogen specifický 3-deoxyantokyanidin fytoalexiny syntéza,[89] například v Čirok -Colletotrichum interakce.[90]
6-methoxymellein je dihydroisokumarin a a fytoalexin indukované v plátcích mrkve UV-C,[91] který umožňuje odpor Botrytis cinerea[92] a další mikroorganismy.[93]
Danielone je fytoalexin nalezen v papája ovoce. Tato sloučenina vykazovala vysokou antifungální aktivitu proti Colletotrichum gloesporioides, patogenní houba papáje.[94]
Stilbeny se vyrábějí v Eukalyptus sideroxylon v případě napadení patogeny. Takové sloučeniny mohou být zahrnuty v hypersenzitivní reakce rostlin. Vysoká hladina fenolických látek v některých lesích může vysvětlit jejich přirozenost zachování proti hnilobě.[95]
V rostlinách VirA je protein histidinkináza, která detekuje určité cukry a fenolové sloučeniny. Tyto sloučeniny se obvykle nacházejí z poraněných rostlin a jako výsledek je VirA používán Agrobacterium tumefaciens lokalizovat potenciální hostitelské organismy pro infekci.[96]
Role v alelopatických interakcích
Mohou být zahrnuty přírodní fenoly alelopatický interakce, například v půda[97] nebo ve vodě. Juglone je příklad takové molekuly, která inhibuje růst jiných druhů rostlin kolem ořechů.[Citace je zapotřebí ] Vodní cévnatá rostlina Myriophyllum spicatum vyrábí ellagický, galský a pyrogalické kyseliny a (+) -katechin, alelopatické fenolové sloučeniny inhibující růst modrozelené řasy Microcystis aeruginosa.[60]
Fenolici, a zejména flavonoidy a isoflavonoidy, může být zapojen do endomycorrhizae formace.[98]
Acetosyringon je nejlépe známý svou účastí v rozpoznávání rostlinných patogenů,[99] zejména jeho role jako signálu přitahujícího a transformujícího jedinečné onkogenní bakterie rodu Agrobacterium.[Citace je zapotřebí ] Gen virA na Ti plazmid v genomu Agrobacterium tumefaciens a Agrobacterium rhizogenes je používán těmito půdními bakteriemi k infikování rostlin prostřednictvím kódování receptoru pro acetosyringon a další fenolické fytochemikálie vylučované rostlinnými ranami.[100] Tato sloučenina také umožňuje vyšší účinnost transformace v rostlinách v transformačních postupech zprostředkovaných A. tumefaciens, a proto je důležitá v rostlinné biotechnologii.[101]
Obsah v lidské stravě
Významné zdroje přírodních fenolů v roce 2006 lidská výživa zahrnout bobule, čaj, pivo, olivový olej, čokoláda nebo kakao, káva, granátová jablka, popcorn, yerba maté, ovoce a ovocné nápoje (včetně jablečného vína, vína a vína) ocet ) a zelenina. Byliny a koření, ořechy (vlašské ořechy, arašídy) a řasy jsou také potenciálně významné pro dodávání určitých přírodních fenolů.
Přírodní fenoly lze nalézt také v mastných matricích olivový olej.[102] Nefiltrovaný olivový olej má vyšší hladiny fenolů nebo polárních fenolů, které tvoří komplexní komplex fenol-protein.
Fenolové sloučeniny, pokud se používají v nápoje, jako švestkový džus Ukázalo se, že jsou užitečné v barevných a senzorických složkách, jako je zmírnění hořkost.[103]
Někteří zastánci bio zemědělství tvrdí, že ekologicky pěstované brambory, pomeranče, a listová zelenina mají více fenolických sloučenin a ty mohou poskytovat antioxidant ochrana proti srdeční choroba a rakovina.[104] Důkazy o podstatných rozdílech mezi biopotravinami a konvenčními potravinami však nejsou dostatečné pro tvrzení, že biopotraviny jsou bezpečnější nebo zdravější než konvenční potraviny.[105][106]
Lidský metabolismus
U zvířat a lidí se po požití stanou přírodní fenoly součástí xenobiotický metabolismus. V následných reakcích fáze II jsou tyto aktivované metabolity konjugovány s nabitými druhy, jako je např glutathion, síran, glycin nebo kyselina glukuronová. Tyto reakce jsou katalyzovány velkou skupinou transferáz se širokou specificitou. UGT1A6 je lidský gen kódující fenol UDP glukuronosyltransferázu aktivní na jednoduchých fenolech.[107] Enzym kódovaný genem UGT1A8 má aktivitu glukuronidázy s mnoha substráty včetně kumariny, antrachinony a flavony.[108]
Reference
- ^ A b Khoddami, A; et al. (2013). "Techniky pro analýzu rostlinných fenolických sloučenin". Molekuly. 18 (2): 2328–75. CiteSeerX 10.1.1.386.9960. doi:10,3390 / molekuly 18022328. PMC 6270361. PMID 23429347.
- ^ Amorati, R; Valgimigli, L. (2012). "Modulace antioxidační aktivity fenolů nekovalentními interakcemi". Org Biomol Chem. 10 (21): 4147–58. doi:10.1039 / c2ob25174d. PMID 22505046.
- ^ Robbins, Rebecca J (2003). „Kyseliny fenolové v potravinách: přehled analytické metodiky“. Journal of Agricultural and Food Chemistry. 51 (10): 2866–2887. doi:10.1021 / jf026182t. PMID 12720366.
- ^ A b Hättenschwiler, Stephan; Vitousek, Peter M. (2000). „Role polyfenolů v koloběhu živin v suchozemském ekosystému“. Trendy v ekologii a evoluci. 15 (6): 238–243. doi:10.1016 / S0169-5347 (00) 01861-9. PMID 10802549.
- ^ A b Klepačka, J; et al. (2011). „Fenolové sloučeniny jako faktory odlišující kultivar a odrůdu u některých rostlinných produktů“. Rostlinné potraviny Hum Nutr. 66 (1): 64–69. doi:10.1007 / s11130-010-0205-1. PMC 3079089. PMID 21243436.
- ^ Mishra, BB; Tiwari, VK. (2011). „Přírodní produkty: rostoucí role v budoucím objevu drog“. Eur J Med Chem. 46 (10): 4769–807. doi:10.1016 / j.ejmech.2011.07.057. PMID 21889825.
- ^ Robert E.C. Wildman, redaktor. Příručka nutraceutik a funkčních potravin, druhé vydání. CRC Press; 2. vydání, 2006. ISBN 0849364094
- ^ A b Wilfred Vermerris a Ralph Nicholson. Fenolická sloučenina biochemie Springer, 2008
- ^ Harborne, J. B. (1980). "Rostlinné fenoly". In Bell, E. A .; Charlwood, B.V. (eds.). Encyclopedia of Plant Physiology, svazek 8 Sekundární rostlinné produkty. Berlin Heidelberg New York: Springer-Verlag. 329–395.
- ^ Jamison, Jennifer R. (2003). Klinický průvodce výživou a doplňky stravy při léčbě nemocí. str. 525. ISBN 978-0-443-07193-5.
- ^ Kapitola osm: „Biosyntéza terpenofenolických metabolitů v chmele a konopí“. Jonathan E. Page a Jana Nagel, Nedávné pokroky ve fytochemii, 2006, svazek 40, s. 179–210, doi:10.1016 / S0079-9920 (06) 80042-0
- ^ Jeandenis, J .; Pezet, R .; Tabacchi, R. (2006). „Rychlá analýza stilbenů a derivátů z listů vinné révy infikovaných plísní pomocí kapalinové chromatografie - hmotnostní spektrometrie s fotoionizací za atmosférického tlaku“. Journal of Chromatography A. 1112 (1–2): 263–8. doi:10.1016 / j.chroma.2006.01.060. PMID 16458906.
- ^ Stintzing, F. C .; Stintzing, A. S .; Carle, R .; Frei, B .; Wrolstad, R. E. (2002). "Barevné a antioxidační vlastnosti antokyanových pigmentů na bázi kyanidinu". Journal of Agricultural and Food Chemistry. 50 (21): 6172–6181. doi:10.1021 / jf0204811. PMID 12358498.
- ^ Karageorgou, P .; Manetas, Y. (2006). "Důležitost červeného mládí: Antokyany a ochrana mladých listů Quercus coccifera z býložravosti hmyzu a nadměrného světla ". Fyziologie stromů. 26 (5): 613–621. doi:10.1093 / treephys / 26.5.613. PMID 16452075.
- ^ "Tandemová hmotnostní spektrometrie prokyanidinů typu B ve víně a dehydrodikatechinů typu B v autoxidační směsi (+) - katechinu a (-) - epikatechinu". Weixing Sun, Miller Jack M., Journal of Mass Spectrometry, 2003, ročník 38, číslo 4, str. 438–446, INIST:14708334
- ^ On, F .; Pan, Q. H .; Shi, Y .; Zhang, X. T .; Duan, C. Q. (2009). "Identifikace autoxidačních oligomerů flavan-3-olů v modelových roztocích pomocí HPLC-MS / MS". Journal of Mass Spectrometry. 44 (5): 633–640. Bibcode:2009JMSp ... 44..633H. doi:10,1002 / jms.1536. PMID 19053150.
- ^ Cilliers, J. J. L .; Singleton, V. L. (1989). "Neenzymové autoxidační reakce fenolického hnědnutí v modelovém systému s kyselinou kávovou". Journal of Agricultural and Food Chemistry. 37 (4): 890–896. doi:10.1021 / jf00088a013.
- ^ "Neenzymové autoxidační reakce kyseliny kávové ve víně". Johannes J. L. Cilliers a Vernon L. Singleton, Dopoledne. J. Enol. Vitic., 1990, 41: 1, s. 84–86, (abstraktní )
- ^ Talcott, S. T .; Howard, L. R. (1999). „Fenolová autoxidace je odpovědná za degradaci barev ve zpracované mrkvové pyré“. Journal of Agricultural and Food Chemistry. 47 (5): 2109–2115. doi:10.1021 / jf981134n. PMID 10552504.
- ^ „Carvacrol, přísada do potravin, poskytuje neuroprotekci u fokální mozkové ischemie / reperfuzního poranění u myší“Yu a kol. 2012 [1]
- ^ A b Bhattacharya, A; et al. (2010). "Recenze: Role rostlinných fenolik v obraně a komunikaci během infekce Agrobacterium a Rhizobium". Mol Plant Pathol. 11 (5): 705–19. doi:10.1111 / j.1364-3703.2010.00625.x. PMC 6640454. PMID 20696007.
- ^ Knaggs, Andrew R. (2001). „Biosyntéza metabolitů shikimate (1999)“. Zprávy o přírodních produktech. 18 (3): 334–55. doi:10.1039 / b001717p. PMID 11476485.
- ^ Lucas, Ricardo; Comelles, Francisco; Alcántara, David; Maldonado, Olivia S .; Curcuroze, Melanie; Parra, Jose L .; Morales, Juan C. (2010). „Povrchově aktivní vlastnosti lipofilních antioxidantů, esterů mastných kyselin tyrosolu a hydroxytyrosolu: potenciální vysvětlení nelineární hypotézy antioxidační aktivity v emulzích typu olej ve vodě“. Journal of Agricultural and Food Chemistry. 58 (13): 8021–6. doi:10.1021 / jf1009928. PMID 20524658.
- ^ Šmejkal, Karel; Grycová, Lenka; Marek, Radek; Lemière, Filip; Jankovská, Dagmar; Forejtníková, Hana; Vančo, Ján; Suchý, Václav (2007). „Sloučeniny C-Geranyl z Paulownia tomentosa Ovoce". Journal of Natural Products. 70 (8): 1244–8. doi:10.1021 / np070063w. PMID 17625893.
- ^ Lu Y; Yan L; Wang Y; Zhou S; Fu J; Zhang J (červen 2009). "Biodegradace fenolických sloučenin z koksovatelné odpadní vody imobilizovanou hnilobou bílé hniloby Phanerochaete chrysosporium". Journal of Hazardous Materials. 165 (1–3): 1091–7. doi:10.1016 / j.jhazmat.2008.10.091. PMID 19062164.
- ^ Perumalsamy, Haribalan; Jang, Myung Jin; Kim, Jun-Ran; Kadarkarai, Murugan; Ahn, Young-Joon (2015). „Larvicidní aktivita a možný způsob působení čtyř flavonoidů a dvou mastných kyselin identifikovaných v semenu Millettia pinnata vůči třem druhům komárů“. Paraziti a vektory. 8 (1): 237. doi:10.1186 / s13071-015-0848-8. ISSN 1756-3305. PMC 4410478. PMID 25928224.
- ^ Tržní potenciál inovací souvisejících s taninem ve vinařském průmyslu, Megan Hill a Geoff Kaine, viktoriánské vládní ministerstvo primárního průmyslu, 2007
- ^ Carr, Miriam; Greene, Lisa M .; Knox, Andrew J.S .; Lloyd, David G .; Zisterer, Daniela M .; Meegan, Mary J. (2010). „Identifikace olova konformačně omezených analogů kombretastatinu typu β-laktamu: Syntéza, antiproliferativní aktivita a účinky cílení na tubulin“. European Journal of Medicinal Chemistry. 45 (12): 5752–5766. doi:10.1016 / j.ejmech.2010.09.033. PMID 20933304.
- ^ Villaverde, J. J .; De Vega, A .; Ligero, P .; Freire, C. S. R .; Neto, C. P .; Silvestre, A. J. D. (2010). „Miscanthus x giganteus Bark Organosolv Fractionation: Fate of Lipophilic Components and Formation of Valuable Phenolic Byproducts“. Journal of Agricultural and Food Chemistry. 58 (14): 8279–8285. doi:10.1021 / jf101174x. PMID 20593898.
- ^ Hanai, T .; Koizumi, K .; Kinoshita, T .; Arora, R .; Ahmed, F. (1997). "Předpověď pKA hodnoty fenolických a dusíkatých sloučenin výpočtovou chemickou analýzou ve srovnání s hodnotami měřenými kapalinovou chromatografií ". Journal of Chromatography A. 762 (1–2): 55–61. doi:10.1016 / S0021-9673 (96) 01009-6. PMID 9098965.
- ^ Beltran, J. (2003). "Spektrofotometrické, potenciometrické a chromatografické pKA hodnoty polyfenolových kyselin ve vodě a médiu acetonitril – voda “. Analytica Chimica Acta. 484 (2): 253–264. doi:10.1016 / S0003-2670 (03) 00334-9.
- ^ René, Alice; Abasq, Marie-Laurence; Hauchard, Didier; Hapiot, Philippe (2010). „Jak reagují fenolové sloučeniny na iont superoxidu? Jednoduchá elektrochemická metoda pro hodnocení antioxidační kapacity“. Analytická chemie. 82 (20): 8703–10. doi:10.1021 / ac101854w. PMID 20866027.
- ^ Leedjarv, A .; Ivask, A .; Virta, M .; Kahru, A. (2006). "Analýza biologicky dostupných fenolů z přírodních vzorků pomocí rekombinantních luminiscenčních bakteriálních senzorů". Chemosféra. 64 (11): 1910–9. Bibcode:2006Chmsp..64.1910L. doi:10.1016 / j.chemosphere.2006.01.026. PMID 16581105.
- ^ Stobiecki, M .; Skirycz, A .; Kerhoas, L .; Kachlicki, P .; Muth, D .; Einhorn, J .; Mueller-Roeber, B. (2006). "Profilování fenolických glykosidových konjugátů v listech Arabidopsis thaliana pomocí LC / MS ". Metabolomika. 2 (4): 197–219. doi:10.1007 / s11306-006-0031-5. S2CID 39140266.
- ^ „Teneurs en principaux flavonoides des fleurs de Cratageus monogyna Jacq et de Cratageus Laevigata (Poiret D.C.) en Fonction de la vegetation ". J. L. Lamaison a A. Carnet, Plantes Medicinales Phytotherapie, 1991, XXV, strany 12–16
- ^ Walker, Richard B .; Everette, Jace D. (2009). "Srovnávací reakční rychlosti různých antioxidantů s ABTS radikálním kationem". Journal of Agricultural and Food Chemistry. 57 (4): 1156–61. doi:10.1021 / jf8026765. PMID 19199590.
- ^ Meyer, Anne S .; Yi, Ock-Sook; Pearson, Debra A .; Waterhouse, Andrew L .; Frankel, Edwin N. (1997). „Inhibice oxidace lidských lipoproteinů s nízkou hustotou ve vztahu ke složení fenolických antioxidantů v hroznech (Vitis vinifera)". Journal of Agricultural and Food Chemistry. 45 (5): 1638–1643. doi:10.1021 / jf960721a.
- ^ Wolfe, K. L .; Liu, R. H. (2007). „Test buněčné antioxidační aktivity (CAA) pro hodnocení antioxidantů, potravin a doplňků stravy“. Journal of Agricultural and Food Chemistry. 55 (22): 8896–8907. doi:10.1021 / jf0715166. PMID 17902627.
- ^ Astrid; von Gadow, Elizabeth Joubert; Hansmann, Chris F. (1997). „Srovnání antioxidační aktivity aspalathinu s aktivitou jiných rostlinných fenolů čaje Rooibos (Aspalathus linearis), α-tokoferol, BHT a BHA“. J. Agric. Food Chem. 45 (3): 632–638. doi:10.1021 / jf960281n.
- ^ Hyršl, Pavel; Büyükgüzel, Ender; Büyükgüzel, Kemal (2007). „Účinky oxidačního stresu vyvolaného kyselinou boritou na antioxidační enzymy a přežití v Galleria mellonella“. Archiv biochemie a fyziologie hmyzu. 66 (1): 23–31. doi:10.1002 / arch.20194. PMID 17694562.
- ^ Kopácek, Petr; Weise, Christoph; Götz, Peter (1995). „Profenoloxidáza z voskové můry Galleria mellonella: čištění a charakterizace proenzymu“. Hmyzí biochemie a molekulární biologie. 25 (10): 1081–1091. doi:10.1016/0965-1748(95)00040-2. PMID 8580908.
- ^ Li, Xiang; Gao, Ming-Jun; Pan, Hong-Yu; Cui, De-Jun; Gruber, Margaret Y. (2010). Purple Canola: ArabidopsisPAP1 zvyšuje antioxidanty a fenoly v Brassica napus Listy". Journal of Agricultural and Food Chemistry. 58 (3): 1639–45. doi:10.1021 / jf903527y. PMID 20073469.
- ^ Výroba fenolických sloučenin do Spirulina maxima mikrořasy a jejich ochranné účinky in vitro na model hepatotoxicity. Abd El-Baky Hanaa H., El Baz Farouk K. a El-Baroty Gamal S., Pokrok v potravinářských vědách, 2009, ročník 31, číslo 1, s. 8–16, INIST:21511068
- ^ A b Babu B .; Wu J. T. (prosinec 2008). „Produkce přírodního butylovaného hydroxytoluenu jako antioxidantu sladkovodním fytoplanktonem“ (PDF). Journal of Phycology. 44 (6): 1447–1454. doi:10.1111 / j.1529-8817.2008.00596.x. PMID 27039859. S2CID 26084768.
- ^ Achkar, Jihane; Xian, Mo; Zhao, Huimin; Frost, J. W. (2005). "Biosyntéza floroglucinolu". J. Am. Chem. Soc. 127 (15): 5332–5333. doi:10.1021 / ja042340g. PMID 15826166.
- ^ Barros, Lillian; Dueñas, Montserrat; Ferreira, Isabel C.F.R .; Baptista, Paula; Santos-Buelga, Celestino (2009). „Stanovení fenolických kyselin pomocí HPLC – DAD – ESI / MS u šestnácti různých druhů portugalských divokých hub“. Potravinová a chemická toxikologie. 47 (6): 1076–9. doi:10.1016 / j.fct.2009.01.039. PMID 19425182.
- ^ Delsignore, A; Romeo, F; Giaccio, M (1997). "Obsah fenolických látek v bazidiomycetách". Mykologický výzkum. 101 (5): 552–6. doi:10.1017 / S0953756296003206.
- ^ Ghosh, Suman; Kebaara, Bessie W .; Atkin, Audrey L .; Nickerson, Kenneth W. (2008). „Regulace produkce aromatického alkoholu u Candida albicans“. Aplikovaná a environmentální mikrobiologie. 74 (23): 7211–7218. doi:10.1128 / AEM.01614-08. PMC 2592902. PMID 18836025.
- ^ Szlavko, Clara M. (1973). "Trtptophol, tyrosol a fenyletanol - aromatické vyšší alkoholy v pivu". Journal of the Brewing Institute. 79 (4): 283–288. doi:10.1002 / j.2050-0416.1973.tb03541.x.
- ^ Hogan, Deborah A. (2006). „Snímání kvora: Alkoholy v sociální situaci“. Aktuální biologie. 16 (12): R457 – R458. doi:10.1016 / j.cub.2006.05.035. PMID 16782000. S2CID 3970864.
- ^ Robiquet (1829). „Essai analytique des lichens de l'orseille“. Annales de chimie et de physique. 42: 236–257.
- ^ Onofrejová, L .; Vašíčková, J .; Klejdus, B .; Stratil, P .; Mišurcová, L .; Kráčmar, S .; Kopecký, J .; Vacek, J. (2010). „Bioaktivní fenoly v řasách: aplikace technik extrakce tlakovou kapalinou a pevnou fází“. Journal of Pharmaceutical and Biomedical Analysis. 51 (2): 464–470. doi:10.1016 / j.jpba.2009.03.027. PMID 19410410.
- ^ Yoo, H. D .; Ketchum, S. O .; Francie, D .; Bair, K .; Gerwick, W. H. (2002). „Vidalenolon, nový fenolický metabolit z tropické červené AlgaVidaliasp“. Journal of Natural Products. 65 (1): 51–53. doi:10.1021 / np010319c. PMID 11809064.
- ^ Pedersen, J. A .; Øllgaard, B. (1982). "Fenolové kyseliny v rodu Lycopodium". Biochemická systematika a ekologie. 10: 3–9. doi:10.1016/0305-1978(82)90044-8.
- ^ Carnachan, S. M .; Harris, P. J. (2000). „Kyselina ferulová je vázána na primární buněčné stěny všech rodin gymnospermů“. Biochemická systematika a ekologie. 28 (9): 865–879. doi:10.1016 / S0305-1978 (00) 00009-0. PMID 10913848.
- ^ Adam, K. P. (1999). "Fenolické složky kapradiny Phegopteris connectilis". Fytochemie. 52 (5): 929–934. doi:10.1016 / S0031-9422 (99) 00326-X.
- ^ Flavonoidy a proanthrocyanidin z oddenků Selliguea feei. Baek Nam-In, Kennelly E. J., Kardono L. B. S., Tsauri S., Padmawinata K., Soejarto D. D. a Kinghorn A. D., Fytochemie1994, sv. 36, č. 2, s. 513–518, INIST:3300075
- ^ Choudhary, M. I .; Naheed, N .; Abbaskhan, A .; Musharraf, S. G .; Siddiqui, H .; Atta-Ur-Rahman (2008). "Fenolické a další složky sladkovodní kapradiny Salvinia molesta". Fytochemie. 69 (4): 1018–1023. doi:10.1016 / j.phytochem.2007.10.028. PMID 18177906.
- ^ Krokene, P .; Nagy, N.E .; Krekling, T. (2008). "Traumatické pryskyřičné kanály a buňky polyfenolického parenchymu v jehličnanech". Indukovaná odolnost rostlin vůči bylinám. str. 147. doi:10.1007/978-1-4020-8182-8_7. ISBN 978-1-4020-8181-1.
- ^ A b Nakai, S. (2000). „Myriophyllum spicatum uvolňované alelopatické polyfenoly inhibující růst modrozelených řas Microcystis aeruginosa“. Vodní výzkum. 34 (11): 3026–3032. doi:10.1016 / S0043-1354 (00) 00039-7.
- ^ Erickson, M .; Miksche, G. E. (1974). "O výskytu ligninu nebo polyfenolů v některých mechech a játrech". Fytochemie. 13 (10): 2295–2299. doi:10.1016/0031-9422(74)85042-9.
- ^ Vogelsang, K .; Schneider, B .; Petersen, M. (2005). „Produkce kyseliny rosmarinové a nové 3′-O-β-D-glukosidu kyseliny rosmarinové v suspenzních kulturách hornwort Anthoceros agrestis Paton“. Planta. 223 (2): 369–373. doi:10.1007 / s00425-005-0089-8. PMID 16133208. S2CID 29302603.
- ^ Hackman, R. H .; Pryor, M. G .; Todd, A. R. (1948). „Výskyt fenolických látek u členovců“. The Biochemical Journal. 43 (3): 474–477. doi:10.1042 / bj0430474. PMC 1274717. PMID 16748434.
- ^ Acetosyringon na www.pherobase.com, databázi feromonů
- ^ Aldrich, J. R .; Blum, M. S .; Duffey, S. S .; Fales, H. M. (1976). „Samci přírodních produktů v ploštici, Leptoglossus phyllopus: Chemie a možné funkce“. Journal of Insect Physiology. 22 (9): 1201–1206. doi:10.1016/0022-1910(76)90094-9.
- ^ Aldrich, J. R .; Blum, M. S .; Fales, H. M. (1979). „Druhově specifické přírodní produkty dospělých mužských brouků (Hemiptera: Heteroptera)“. Journal of Chemical Ecology. 5: 53–62. doi:10.1007 / BF00987687. S2CID 34346907.
- ^ Dillon, R.J .; Vennard, C.T .; Charnley, A.K. (Duben 2002). „Poznámka: Střevní bakterie produkují složky feromonu soudržnosti akát“. Journal of Applied Microbiology. 92 (4): 759–763. doi:10.1046 / j.1365-2672.2002.01581.x. ISSN 1364-5072. PMID 11966918. S2CID 8561972.
- ^ Dillon, Rod J .; Vennard, Chris T .; Charnley, A. Keith (2000). "Využití střevních bakterií v kobylce". Příroda. 403 (6772): 851. doi:10.1038/35002669. PMID 10706273. S2CID 5207502.
- ^ Semiochemical - 2-methoxy-4-vinylphenol, Pherobase.com
- ^ Marlier, J.; Quinet, Y.; Debiseau, J. (2004). "Defensive Behaviour and Biological Activities of the Abdominal Secretion in the Ant Crematogaster Scutellaris (Hymenoptera: Myrmicinae)" (PDF). Procesy chování. 67 (3): 427–40. doi:10.1016/j.beproc.2004.07.003. PMID 15518992. S2CID 21599793.
- ^ Urinary, temporal gland, and breath odors from Asian elephants of Mudumalai National Park. L. E. L. Rasmussen and V. Krishnamurthy, Gajah, the Journal of the Asian Elephant Specialist Group, January 2001, Number 20, pages 1-8 (článek )
- ^ Rasmussen, L. E. L.; Perrin, T. E. (1999). "Physiological Correlates of Musth". Fyziologie a chování. 67 (4): 539–49. doi:10.1016/S0031-9384(99)00114-6. PMID 10549891. S2CID 21368454.
- ^ "Musth in elephants". Deepa Ananth, Zoo's print journal, 15(5), pp. 259-262 (článek Archivováno 2018-06-04 at the Wayback Machine )
- ^ Adams, J .; Garcia, A .; Foote, C. S. (1978). "Some chemical constituents of the secretion from the temporal gland of the African elephant (Loxodonta africana)". Journal of Chemical Ecology. 4: 17–25. doi:10.1007/BF00988256. S2CID 45857570.
- ^ "Why study pig odor?".
- ^ Müller-Schwarze, D .; Houlihan, P. W. (1991). "Pheromonal activity of single castoreum constituents in beaver, Castor canadensis". Journal of Chemical Ecology. 17 (4): 715–34. doi:10.1007 / BF00994195. PMID 24258917. S2CID 29937875.
- ^ C.Michael Hogan (2008) Jedovatý dub západní: Toxicodendron diversilobum, GlobalTwitcher, vyd. Nicklas Stromberg „Archivovaná kopie“. Archivovány od originál dne 21. 7. 2009. Citováno 2009-07-21.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Biogeochemistry: An Analysis of Global Change. 2. vydání. William H. Schlesinger, Academic Press, 1997, 108, 135, 152–158, 180–183, 191–194
- ^ Plant Resins: Chemistry, evolution, ecology, and ethnobotany, by Jean Langenheim, Lis na dřevo, Portland, Oregon. 2003
- ^ Steinberg, P. D. (1984). "Algal Chemical Defense Against Herbivores: Allocation of Phenolic Compounds in the Kelp Alaria marginata". Věda. 223 (4634): 405–407. Bibcode:1984Sci...223..405S. doi:10.1126/science.223.4634.405. PMID 17829890. S2CID 36409146.
- ^ Steinberg, P. D. (1986). "Chemical defenses and the susceptibility of tropical marine brown algae to herbivores". Ekologie. 69 (4): 628–630. Bibcode:1986Oecol..69..628S. doi:10.1007/BF00410374. PMID 28311627. S2CID 19551247.
- ^ Targett, Nancy M.; Coen, Loren D.; Boettcher, Anne A.; Tanner, Christopher E. (1992). "Biogeographic Comparisons of Marine Algal Polyphenolics: Evidence against a Latitudinal Trend". Ekologie. 89 (4): 464–470. Bibcode:1992Oecol..89..464T. doi:10.1007/BF00317150. JSTOR 4219911. PMID 28311874. S2CID 5655010.
- ^ F. Favaron, M. Lucchetta, S. Odorizzi, A. T. Pais da Cunha and L. Sella (2009). "The role of grape polyphenols on trans-resveratrol activity against Botrytis cinerea and of fungal laccase on the solubility of putative grape PR proteins" (PDF). Journal of Plant Pathology. 91 (3): 579–588. doi:10.4454/jpp.v91i3.549 (neaktivní 10. 11. 2020). Citováno 2011-01-22.CS1 maint: více jmen: seznam autorů (odkaz) CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ Timperio, A. M.; d’Alessandro, A.; Fagioni, M.; Magro, P.; Zolla, L. (2012). "Production of the phytoalexins trans-resveratrol and delta-viniferin in two economy-relevant grape cultivars upon infection with Botrytis cinerea in field conditions". Fyziologie rostlin a biochemie. 50 (1): 65–71. doi:10.1016/j.plaphy.2011.07.008. PMID 21821423.
- ^ Hovelstad, H.; Leirset, I.; Oyaas, K.; Fiksdahl, A. (2006). "Screening Analyses of Pinosylvin Stilbenes, Resin Acids and Lignans in Norwegian Conifers". Molekuly. 11 (1): 103–114. doi:10.3390/11010103. PMC 6148674. PMID 17962750.
- ^ Lee, S.K .; Lee, H. J .; Min, H. Y .; Park, E. J .; Lee, K. M .; Ahn, Y. H.; Cho, Y. J .; Pyee, J. H. (2005). "Antibakteriální a antifungální aktivita pinosylvinu, složky borovice". Fitoterapia. 76 (2): 258–260. doi:10.1016 / j.fitote.2004.12.004. PMID 15752644.
- ^ "Sakuranetin". home.ncifcrf.gov. Archivovány od originál dne 03.12.2018. Citováno 2018-12-02.
- ^ Sakuranetin, a flavonone phytoalexin from ultraviolet-irradiated rice leaves, Kodama O., Miyakawa J., Akatsuka T. and Kiyosawa S., Fytochemie, 1992, volume 31, number 11, pp. 3807–3809, INIST:4682303
- ^ Shih, C. -H.; Chu, I. K.; Yip, W. K.; Lo, C. (2006). "Differential Expression of Two Flavonoid 3'-Hydroxylase cDNAs Involved in Biosynthesis of Anthocyanin Pigments and 3-Deoxyanthocyanidin Phytoalexins in Sorghum". Fyziologie rostlin a buněk. 47 (10): 1412–1419. doi:10.1093/pcp/pcl003. PMID 16943219.
- ^ "Biosynthesis and regulation of 3-deoxyanthocyanidin phytoalexins induced during Čirok-Colletotrichum interaction: Heterologous expression in maize". Chopra Surinder, Gaffoor Iffa, Ibraheem Farag, Poster at the American Society of Plant Biologists (abstraktní Archivováno 2011-07-25 na Wayback Machine )
- ^ Mercier, J.; Arul, J.; Ponnampalam, R.; Boulet, M. (1993). "Induction of 6-Methoxymellein and Resistance to Storage Pathogens in Carrot Slices by UV-C". Journal of Phytopathology. 137: 44–54. doi:10.1111/j.1439-0434.1993.tb01324.x.
- ^ Hoffman, R .; Heale, J. B. (1987). "Cell death, 6-methoxymellein accumulation, and induced resistance to Botrytis cinerea in carrot root slices". Fyziologická a molekulární patologie rostlin. 30: 67–75. doi:10.1016/0885-5765(87)90083-X.
- ^ Kurosaki, F.; Nishi, A. (1983). "Isolation and antimicrobial activity of the phytoalexin 6-methoxymellein from cultured carrot cells". Fytochemie. 22 (3): 669–672. doi:10.1016/S0031-9422(00)86959-9.
- ^ Danielone, a phytoalexin from papaya fruit. Echeverri F., Torres F., Quinones W., Cardona G., Archbold R., Roldan J., Brito I., Luis J. G., and Lahlou U. E.-H., Fytochemie1997, sv. 44, č. 2, pp. 255–256, INIST:2558881
- ^ Hart, John H.; Hillis, W. E. (1974). "Inhibition of wood-rotting fungi by stilbenes and other polyphenols in Eukalyptus sideroxylon". Fytopatologie. 64 (7): 939–48. doi:10.1094/Phyto-64-939.
- ^ Brencic, Anja; Winans, Stephen C. (March 2005). "Detection of and Response to Signals Involved in Host-Microbe Interactions by Plant-Associated Bacteria". Microbiol Mol Biol Rev. 69 (1): 155–194. doi:10.1128/mmbr.69.1.155-194.2005. PMC 1082791. PMID 15755957.
- ^ Blum, Udo; Shafer, Steven R.; Lehman, Mary E. (1999). "Evidence for Inhibitory Allelopathic Interactions Involving Phenolic Acids in Field Soils: Concepts vs. an Experimental Model". Kritické recenze v rostlinných vědách. 18 (5): 673–93. doi:10.1080/07352689991309441.
- ^ Morandi, D. (1996). "Occurrence of phytoalexins and phenolic compounds in endomycorrhizal interactions, and their potential role in biological control". Rostlina a půda. 185 (2): 241–305. doi:10.1007/BF02257529. S2CID 30091640.
- ^ "Involvement of acetosyringone in plant-pathogen recognition". Baker C. Jacyn, Mock Norton M., Whitaker Bruce D., Roberts Daniel P., Rice Clifford P., Deahl Kenneth L. and Aver'Yanov Andrey A., Sdělení o biochemickém a biofyzikálním výzkumu, 2005, volume 328, number 1, pp. 130–136, INIST:16656426
- ^ Schrammeijer, B.; Beijersbergen, A.; Idler, K. B.; Melchers, L. S.; Thompson, D. V.; Hooykaas, P. J. (2000). "Sequence analysis of the vir-region from Agrobacterium tumefaciens octopine Ti plasmid pTi15955". Journal of Experimental Botany. 51 (347): 1167–1169. doi:10.1093/jexbot/51.347.1167. PMID 10948245.
- ^ Sheikholeslam, S. N.; Weeks, D. P. (1987). "Acetosyringone promotes high efficiency transformation of Arabidopsis thaliana explants by Agrobacterium tumefaciens". Molekulární biologie rostlin. 8 (4): 291–298. doi:10.1007/BF00021308. PMID 24301191. S2CID 32005770.
- ^ Gutfinger, T. (1981). "Polyphenols in olive oils". Journal of the American Oil Chemists 'Society. 58 (11): 966–8. doi:10.1007 / BF02659771. S2CID 85367601.
- ^ Donovan, Jennifer L .; Meyer, Anne S .; Waterhouse, Andrew L. (1998). "Fenolové složení a antioxidační aktivita švestek a šťávy z prořezávání (Prunus domestica)". Journal of Agricultural and Food Chemistry. 46 (4): 1247–1252. doi:10.1021 / jf970831x.
- ^ Asami, Danny K. "Comparison of the Total Phenolic and Ascorbic Acid Content of Freeze-Dried and Air-Dried Marionberry, Strawberry, and Corn Grown Using Conventional, Organic, and Sustainable Agricultural Practices". Journal of Agricultural and Food Chemistry (American Chemical Society), 51 (5), 1237–1241, 2003. 10.1021/jf020635c S0021-8561(02)00635-0. Retrieved 10-Apr-2006.
- ^ Smith-Spangler, C.; Brandeau, M. L.; Hunter, G. E.; Bavinger, J. C.; Pearson, M .; Eschbach, P. J.; Sundaram, V.; Liu, H .; Schirmer, P.; Stave, C.; Olkin, I.; Bravata, D. M. (September 4, 2012). "Are organic foods safer or healthier than conventional alternatives?: a systematic review". Annals of Internal Medicine. 157 (5): 348–366. doi:10.7326/0003-4819-157-5-201209040-00007. PMID 22944875. S2CID 21463708.
- ^ Blair, Robert. (2012). Organic Production and Food Quality: A Down to Earth Analysis. Wiley-Blackwell, Oxford, UK. ISBN 978-0-8138-1217-5
- ^ "Cloning and substrate specificity of a human phenol UDP glucuronosyltransferase expressed in COS-7 cells". David Harding, Sylvie Fournel-Gigleux, Michael R. Jackson and Brian Burchell, Proc. Natl. Acad. Sci. USA, November 1988, Volume 85, pp. 8381–8385, (abstraktní )
- ^ Ritter J. K.; Chen F.; Sheen Y. Y.; Tran H. M.; Kimura S.; Yeatman M. T.; Owens I. S. (Mar 1992). „Nový komplexní lokus UGT1 kóduje lidský bilirubin, fenol a další izoenzymy UDP-glukuronosyltransferázy se stejnými karboxylovými konci“. J Biol Chem. 267 (5): 3257–61. PMID 1339448.
Knihy
- Biochemistry of phenolic compounds, by J. B. Harborne, 1964, Academic Press (Knihy Google )
- Plant phenolics, by Pascal Ribéreau-Gayon, 1972, Oliver and Boyd Editions (Knihy Google, ISBN 0050025120, ISBN 9780050025123)
- The Biochemistry of plant phenolics, by C. F. van Sumere and P. J. Lea, Phytochemical Society of Europe, 1985, Clarendon Press (Knihy Google, ISBN 9780198541707)
- Biochemistry of Phenolic Compounds, by Wilfred Vermerris and Ralph Nicholson, 2006, Springer (Kniha Google )
externí odkazy
Databáze
- Průzkumník fenolu (phenol-explorer.eu ), a database dedicated to phenolics found in food by Augustin Scalbert, INRA Clermont-Ferrand, Unité de Nutrition Humaine (Human food unit)
- Fenoly na ChEBI (Chemical Entities of Biological Interest)
- ChEMBLdb, a database of bioactive drug-like small molecules by the European Bioinformatics Institute
- Foodb, a database of compounds found in food