Aryldialkylfosfatáza - Aryldialkylphosphatase
| Fosfotriesteráza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.1.8.1 | ||||||||
| Číslo CAS | 117698-12-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Aryldialkylfosfatáza (ES 3.1.8.1 ) (běžněji známý jako fosfotriesteráza (PTE) a také organofosfát hydroláza, parathion hydroláza, paraoxon ase, a parathion aryl esteráza) je metaloenzym který hydrolyzuje triesterová vazba[1] nalezen v organofosfát insekticidy.
| Rodina fosfotriesterázy | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Struktura organofosforové hydrolázy | |||||||||||
| Identifikátory | |||||||||||
| Symbol | PTE | ||||||||||
| Pfam | PF02126 | ||||||||||
| InterPro | IPR001559 | ||||||||||
| STRÁNKA | PDOC01026 | ||||||||||
| SCOP2 | 1 dpm / Rozsah / SUPFAM | ||||||||||
| |||||||||||
- aryl dialkylfosfát + H2Ó dialkylfosfát + arylalkohol
Tedy dva substráty tohoto enzymu jsou aryldialkylfosfát a H2Ó, zatímco jeho dva produkty jsou dialkylfosfát a arylalkohol.
Gen (opd, pro organofosfát degradující), který kóduje enzym, se nachází ve velkém plazmid (pSC1, 51 kB) endogenní pro Pseudomonas diminuta,[2] ačkoli gen byl také nalezen v mnoha jiných bakteriálních druzích, jako je Flavobacterium sp. (ATCC27551), kde je také kódován v extrachromozomální prvek (pSM55, 43 kB).[2]
Organofosfát je obecný název pro estery z kyselina fosforečná a je jedním z organofosforové sloučeniny. Mohou být nalezeny jako součást insekticidy, herbicidy, a nervové plyny, mimo jiné. Některé méně toxické organofosfáty lze použít jako rozpouštědla, změkčovadla, a EP přísady. Používání organofosfátů představuje přibližně 38% veškerého globálního používání pesticidů.[3]
Gen
Ze vzorků půdy z různých částí světa byly identifikovány bakteriální izoláty schopné degradovat organofosfátové (OP) pesticidy.[3][4] První bakteriální druhy degradující organofosfáty byly izolovány z a vzorek půdy z Filipíny v roce 1973,[5] který identifikoval jako Flavobacterium sp. ATCC27551. Od té doby prokázaly jiné druhy schopnost degradovat OP, jako např Pseudomonas diminuta (izolováno ze vzorku půdy v USA), Agrobacterium radiobacter (izolováno z australského vzorku půdy), Alteromonas haloplanktis (izolovaný ze vzorku půdy v USA) a Pseudomonas sp. WBC-3 (izolovaný z čínského vzorku půdy).[3]
Schopnost hydrolyzovat organofosfáty není u bakterií jedinečná. Bylo zjištěno, že několik druhů hub a sinic také hydrolyzuje OP.[3] Navíc prostřednictvím sekvenčních homologických prohledávání celých genomů bylo identifikováno několik dalších bakteriálních druhů, které také obsahují sekvence ze stejné genové rodiny jako opd, včetně patogenních bakterií, jako jsou Escherichia coli (yhfV) a Mycobacterium tuberculosis.[3]
Genová sekvence kódující enzym (opd) v Flavobacterium sp. ATCC27551 a Pseudomonas diminuta je vysoce konzervativní (100% sekvenční homologie ),[4] ačkoli plazmidy, kde se nacházejí geny, mají velmi odlišné sekvence kromě 5,1 kB[4][6] konzervovaný region kde se gen nachází.[2]
Bližší pohled na organizaci opd gen z Flavobacterium naznačuje potenciál transposon - jako architektura, která odpovídá za rozsáhlou distribuci genu mezi další mikrobiální druhy, ke které mohlo dojít při bočním přenosu DNA. The opd Gen je ohraničen transpozičními inzerčními sekvencemi, charakteristickými pro Tn3 rodina transpozonů. Navíc, a transposáza -jako sekvence (homologní k TnpA) a a resolvase -jako sekvence (homologní k TnpR) byly také identifikovány v regionech proti proudu z opd gen,[4] což jsou vlastnosti třídy II transpozice jako je Tn3.
Kromě toho další otevřený čtecí rámec byl identifikován po proudu z opd a kóduje protein, který se dále degraduje p-nitrofenol, jeden z vedlejších produktů degradace OP. Předpokládá se, že tento protein funguje jako komplex s PTE, protože při přítomnosti PTE je pozorováno dramatické zvýšení aktivity.[4]
Proto je charakteristická architektonická organizace opd genová oblast naznačuje, že různé druhy gen získaly horizontální přenos prostřednictvím transpozice a přenosu plazmidu.
Protein
Struktura
Fosfotriesteráza (PTE) patří do rodiny metaloenzymů, které mají dva katalytické Zn2+ atomy kovů, přemostěny společným ligandem a koordinovány imidazol boční řetězy histidin zbytky, které jsou seskupeny kolem atomů kovů.[7] Protein tvoří homodimer.[8] Celková struktura se skládá z motivu α / β-barelu, který je také přítomen v dalších 20 katalytických proteinech. Aktivní místa těchto proteinů se nacházejí v C-koncové části β-barelu, kde se také nachází aktivní místo PTE.[7]

Katalýza
Ke katalýze organofosfátů dochází prostřednictvím nukleofilní substituce s obrácenou konfigurací (SN2 mechanismus) o středu fosforu v substrátu.[7] V aktivním místě pomáhají kationty kovů při katalýze další polarizací vazby P – O substrátu, díky čemuž je náchylnější k nukleofilnímu útoku. Kromě toho bazický zbytek abstrahuje proton z molekuly vody a produkovaný hydroxidový iont spojuje dva dvojmocné kationty a působí jako nukleofil. OH− pak zaútočí na střed fosforu substrátu, následovaný přenosem protonu. Vazba P – O je přerušena a produkty se uvolňují z aktivního místa.[9] Míra obratu (kkočka) fosfotriesterázy je téměř 104 s−1 pro hydrolýzu paraoxonu,[10] a výrobky jsou p-nitrofenol a kyselina diethylfosforečná.
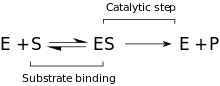
Kinetika
Navrhovaný kinetický model sestává z reverzibilního vazebného kroku, který probíhá mezi enzymem a substrátem, a z tvorby Michaelis komplex (ES). Následuje nevratný krok, kdy se štěpí vazba P – O a vytvoří se komplex přechodného enzymu + produktu (EP). Nakonec se produkty uvolní a regeneruje se volný enzym (E).[9]
Druh
Fosfotriesteráza je přítomna ve dvou druzích, Pseudomonas diminuta a Flavobacterium sp. ATCC27551. Jiné genové varianty, které také kódují enzymy degradující organofosfáty, jsou přítomny u jiných druhů. Seznam zahrnuje bakteriální druhy, jako jsou například radio rezistentní Deinococcus radioduranspatogeny Mycobacterium tuberculosis a Mycobacterium bovis, anaerobní bakterie Desulfatibacillum alkenivorans, termofilní bakterie Geobacil sp. a Thermoanaerobacter sp. X514, Escherichia coli (yhfV) a mnoho dalších skupin bakterií,[3] a také některé Archaea jako Sulfolobus acidocaldarius.[11]

Subcelulární lokalizace
Fosfotriesteráza je protein asociovaný s membránou, který je překládán cílovým peptidem dlouhým 29 aminokyselin (motiv Tat),[12][10][13] který se poté oddělí od zralého proteinu po vložení do plazmatické membrány.[1] Protein je ukotven k vnitřní membráně buňky směrem k periplazmě.[14]
Funkce
Enzym fosfotriesteráza hydrolyzuje organofosfátové sloučeniny štěpením triesterové vazby v substrátu.

Enzym má velmi širokou substrátovou specificitu,[12] a je velmi účinný při katalyzování reakce: PTE hydrolyzuje paraoxon rychlostí blížící se hranici difúze,[15] což naznačuje, že enzym je optimálně vyvinut pro použití tohoto substrátu.[13] Působí konkrétně na syntetické triestery organofosfátů a fosforofluoridáty.[3] Nezdá se, že by měl přirozeně se vyskytující substrát, a proto se může optimálně vyvinout pro využití paraoxon a další běžné zemědělské pesticidy.[15]
Produkty reakce jsou kyselina diethylfosforečná a p-nitrofenol.[4] Posledně uvedený produkt je dále degradován enzymem kódovaným 750 bp po proudu od opd Gen a kóduje domnělou hydrolázu 29 kDa, která se může podílet na degradaci aromatických sloučenin, a pracuje ve shodě s PTE.[4] Tento enzym je homologní s hydrolázami v Pseudomonas putida, Pseudomonas azelaica, Rhodococcus sp. a P. fluorescens.[4]
Organofosfáty nejsou toxické pro bakterie, ale působí jako inhibitory acetylcholinesterázy u zvířat.[16] Některé druhy bakterií jsou také schopné využívat organofosfáty jako zdroj živin a uhlíku.[14]
Význam pro životní prostředí
Fosfotriesterázy jsou považovány za silného kandidáta na biokatalyzátor pro bioremediační účely.[7] Jeho široká substrátová specificita a katalytická účinnost z něj činí atraktivní cíl pro potenciální použití mikrobů obsahujících gen opd v detoxikačních půdách, které jsou toxické kvůli nadměrnému používání pesticidů.[3] Organofosfáty navíc působí jako inhibitory acetylcholinesterázy (AChE). Neurotransmiter AChE je důležitou součástí centrálního nervového systému (CNS) u hmyzu u zvířat a inhibice správného obratu této neurochemické látky vede k nadměrné stimulaci CNS, což nakonec vede k úhynu hmyzu a savců.[3][17] Výsledkem je, že použití mikroorganismů degradujících organofosfáty je potenciálně efektivní, nízkonákladová a ekologická metoda odstraňování těchto toxických sloučenin z prostředí.[3]
Dějiny
Bakteriální druhy, které měly schopnost odbourávat organofosfátové pesticidy, byly izolovány ze vzorků půdy z různých částí světa. První identifikovaný bakteriální kmen schopný hydrolyzovat organofosfáty byl Flavobacterium sp. ATCC 27551, nalezený Sethunathanem a Yoshidou v roce 1973 ze vzorku půdy původně z Filipín.[5] Od té doby bylo zjištěno, že jiné druhy mají také enzymy degradující organofosfáty podobné těm, které se nacházejí v Flavobacterium[6].
Reference
- ^ A b Pinjari AB, Pandey JP, Kamireddy S, Siddavattam D (červenec 2013). „Exprese a subcelulární lokalizace organofosfáthydrolázy v kmeni Ind01 degradujícím acefát Pseudomonas sp. A jeho použití jako potenciálního biokatalyzátoru pro eliminaci organofosfátových insekticidů. Dopisy v aplikované mikrobiologii. 57 (1): 63–8. doi:10.1111 / lam.12080. PMID 23574004. S2CID 12006833.
- ^ A b C Harper LL, McDaniel CS, Miller CE, Wild JR (říjen 1988). „Podobné plazmidy izolované z Pseudomonas diminuta MG a Flavobacterium sp. (ATCC 27551) obsahují identické opd geny“. Aplikovaná a environmentální mikrobiologie. 54 (10): 2586–9. doi:10.1128 / AEM.54.10.2586-2589.1988. PMC 204325. PMID 3202637.
- ^ A b C d E F G h i j Singh BK (únor 2009). „Bakterie degradující organofosfor: ekologie a průmyslové aplikace“. Recenze přírody. Mikrobiologie. 7 (2): 156–64. doi:10.1038 / nrmicro2050. PMID 19098922. S2CID 205497513.
- ^ A b C d E F G h Siddavattam D, Khajamohiddin S, Manavathi B, Pakala SB, Merrick M (květen 2003). "Transposonová organizace seskupení genů degradace organofosfátů (OPD) přenášených plazmidem nalezená v Flavobacterium sp.". Aplikovaná a environmentální mikrobiologie. 69 (5): 2533–9. doi:10.1128 / AEM.69.5.2533-2539.2003. PMC 154515. PMID 12732518.
- ^ A b Sethunathan N, Yoshida T (červenec 1973). "Flavobacterium sp., Který degraduje diazinon a parathion". Canadian Journal of Microbiology. 19 (7): 873–5. doi:10,1139 / m73-138. PMID 4727806.
- ^ A b Mulbry WW, Karns JS, Kearney PC, Nelson JO, McDaniel CS, Wild JR (květen 1986). "Identifikace genu pro plazmidem nesený parathion hydrolázu z Flavobacterium sp. Jižní hybridizací s opd z Pseudomonas diminuta". Aplikovaná a environmentální mikrobiologie. 51 (5): 926–30. doi:10.1128 / AEM.51.5.926-930.1986. PMC 238989. PMID 3015022.
- ^ A b C d Benning MM, Kuo JM, Raushel FM, Holden HM (prosinec 1994). „Trojrozměrná struktura fosfotriesterázy: enzym schopný detoxikace organofosfátových nervových látek“. Biochemie. 33 (50): 15001–7. doi:10.1021 / bi00254a008. PMID 7999757.
- ^ Dong YJ, Bartlam M, Sun L, Zhou YF, Zhang ZP, Zhang CG, Rao Z, Zhang XE (říjen 2005). "Krystalová struktura methylparathionhydrolázy z Pseudomonas sp. WBC-3". Journal of Molecular Biology. 353 (3): 655–63. doi:10.1016 / j.jmb.2005.08.057. PMID 16181636.
- ^ A b Aubert SD, Li Y, Raushel FM (květen 2004). „Mechanismus hydrolýzy organofosfátů bakteriální fosfotriesterázou“. Biochemie. 43 (19): 5707–15. doi:10.1021 / bi0497805. PMID 15134445.
- ^ A b Mulbry WW, Karns JS (únor 1989). "Čištění a charakterizace tří parathionových hydroláz z gramnegativních bakteriálních kmenů". Aplikovaná a environmentální mikrobiologie. 55 (2): 289–93. doi:10.1128 / AEM.55.2.289-293.1989. PMC 184103. PMID 2541658.
- ^ Chen L, Brügger K, Skovgaard M, Redder P, She Q, Torarinsson E, Greve B, Awayez M, Zibat A, Klenk HP, Garrett RA (červenec 2005). „Genom Sulfolobus acidocaldarius, modelový organismus Crenarchaeota“. Journal of Bacteriology. 187 (14): 4992–9. doi:10.1128 / JB.187.14.4992-4999.2005. PMC 1169522. PMID 15995215.
- ^ A b Classen JJ, Engler CR, Kenerley CM, Whittaker AD (duben 2000). "Logistický model růstu podpovrchových hub s aplikací na bioremediaci". Journal of Environmental Science and Health, Part A. 35 (4): 465–488. doi:10.1080/10934520009376982. S2CID 98035446.
- ^ A b Caldwell SR, Newcomb JR, Schlecht KA, Raushel FM (červenec 1991). "Meze difúze při hydrolýze substrátů fosfotriesterázou z Pseudomonas diminuta". Biochemie. 30 (30): 7438–7444. doi:10.1021 / bi00244a010. ISSN 0006-2960. PMID 1649628.
- ^ A b Singh BK, Walker A (květen 2006). „Mikrobiální degradace organofosforových sloučenin“. Recenze mikrobiologie FEMS. 30 (3): 428–71. doi:10.1111 / j.1574-6976.2006.00018.x. PMID 16594965.
- ^ A b Dumas DP, Caldwell SR, Wild JR, Raushel FM (listopad 1989). "Čištění a vlastnosti fosfotriesterázy z Pseudomonas diminuta". The Journal of Biological Chemistry. 264 (33): 19659–65. PMID 2555328.
- ^ Lotti M (2002). „Propagace zpožděné polyneuropatie vyvolané organofosfáty některými inhibitory esterázy“. Toxikologie. 181–182: 245–248. doi:10.1016 / s0300-483x (02) 00291-3. PMID 12505319.
- ^ Ragnarsdottir KV (2000). "Osud v životním prostředí a toxikologie organofosfátových pesticidů". Časopis geologické společnosti. 157 (4): 859–876. Bibcode:2000JGSoc.157..859R. doi:10.1144 / jgs.157.4.859. S2CID 129950334.
Další čtení
- Aldridge WN (leden 1953). "Sérové esterázy. I. Dva typy esterázy (A a B) hydrolyzující p-nitrofenylacetát, propionát a butyrát a metoda jejich stanovení". The Biochemical Journal. 53 (1): 110–7. doi:10.1042 / bj0530110. PMC 1198110. PMID 13032041.
- Bosmann HB (červenec 1972). "Membránové markerové enzymy. Charakterizace arylesterázy mozkové kůry morčete s využitím p-nitrofenylacetátu jako substrátu". Biochimica et Biophysica Acta. 276 (1): 180–91. doi:10.1016/0005-2744(72)90019-8. PMID 5047702.
- Mackness MI, Thompson HM, Hardy AR, Walker CH (červenec 1987). „Rozlišení mezi„ A “-esterázami a arylesterázami. Důsledky pro klasifikaci esteráz“. The Biochemical Journal. 245 (1): 293–6. doi:10.1042 / bj2450293. PMC 1148115. PMID 2822017.
- Hlavní AR (1960). „Diferenciace esteráz typu A v ovčím séru“. Biochem. J. 75: 188–195. doi:10.1042 / bj0750188. PMC 1204348. PMID 14420012.

