Manganistan - Permanganate
 | |
 | |
| Jména | |
|---|---|
| Systematický název IUPAC Manganistan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| MnO− 4 | |
| Molární hmotnost | 118.934 g · mol−1 |
| Konjugovaná kyselina | Kyselina manganová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
A manganistan je obecný název pro a chemická sloučenina obsahující manganát (VII) ion, (MnO−
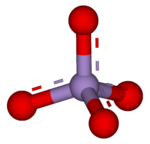
4). Protože mangan je v +7 oxidační stav je iont manganistanu (VII) silný oxidační činidlo. Ion má čtyřboká geometrie.[1] Roztoky manganistanu mají fialovou barvu a jsou stabilní neutrální nebo mírně zásaditý média. Přesná chemická reakce závisí na přítomných organických nečistotách a použitém oxidantu. Například trichlorethan (C2H3Cl3) se oxiduje manganistanovými ionty za vzniku oxidu uhličitého (CO2), oxid manganičitý (MnO2), vodíkové ionty (H+) a chloridové ionty (Cl−).[2]
- 8MnO−
4 + 3C
2H
3Cl
3 → 6CO
2 + 8MnO
2 + H+
+ 4H
2Ó + 9Cl−
V kyselé roztok manganistanu (VII) se redukuje na bledě růžový oxidační stav +2 mangan (II) (Mn2+) ion.
- 8 H+
+ MnO−
4 + 5 e− → Mn2+ + 4 H2Ó
Silně základní roztok manganistanu (VII) se redukuje na zelený oxidační stav +6 manganičitan ion, MnO2−
4.
- MnO−
4 + e− → MnO2−
4
V neutrálním médiu se však redukuje na hnědý oxidační stav +4 oxid manganičitý MnO2.
- 2 H2O + MnO−
4 + 3 e− → MnO2 + 4 OH−
Výroba
Permanganáty mohou být vyrobeny oxidací mangan sloučeniny jako chlorid manganatý nebo síran manganatý silnými oxidačními činidly, například chlornan sodný nebo oxid olovnatý:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl + 3 H2Ó
- 2 MnSO4 + 5 PbO2 + 3 H2TAK4 → 2 HMnO4 + 5 PbSO4 + 2 H2Ó
Může být také vyroben nepřiměřenost z manganatany, s oxid manganičitý jako vedlejší produkt:
- 3 Na2MnO4 + 2 H2O → 2 NaMnO4 + MnO2 + 4 NaOH
Vyrábí se komerčně elektrolýzou nebo oxidací vzduchu alkalickými roztoky solí manganičitanu (MnO2−
4).[3]

Vlastnosti

Permanganáty (VII) jsou soli z kyselina manganová. Mají tmavě fialovou barvu, kvůli přenos poplatků přechod. Permanganát (VII) je silný okysličovadlo a podobně chloristan. Proto se běžně používá při kvalitativní analýze, která zahrnuje redoxní reakce (manganometrie ). Podle teorie je manganistan dostatečně silný na to, aby oxidoval vodu, ale k tomu ve skutečnosti nedochází. Kromě toho je stabilní.
Je to užitečné činidlo, i když s organickými sloučeninami, není příliš selektivní. Manganistan draselný se používá jako dezinfekční prostředek a přísada pro úpravu vody v akvakultuře[4].
Manganatany (VII) nejsou tepelně příliš stabilní. Například, manganistan draselný rozkládá se při 230 ° C až manganistan draselný a oxid manganičitý uvolňující kyslík plyn:
- 2 KMnO4 → K.2MnO4 + MnO2 + O.2
Manganistan může oxidovat amin do a nitrosloučenina,[5][6] an alkohol do a keton,[7] an aldehyd do a karboxylová kyselina,[8][9] terminál alken do a karboxylová kyselina,[10] kyselina šťavelová na oxid uhličitý,[11] a alken do a diol.[12] Tento seznam není vyčerpávající.
Při oxidaci alkenů je jedním meziproduktem cyklický druh Mn (V)[Citace je zapotřebí ]:
Sloučeniny
- Manganistan amonný, NH4MnO4
- Manganistan vápenatý, Ca (MnO4)2
- Manganistan draselný, KMnO4
- Manganistan sodný, NaMnO4
- Manganistan stříbrný, AgMnO4
Viz také
- Chloristan, podobný iont s centrem chloru (VII)
- Chroman, který je izoelektronický s manganistanem
- Technecistan
Reference
- ^ Sukalyan Dash, Sabita Patel a Bijay K. Mishra (2009). „Oxidace manganistanem: syntetické a mechanické aspekty“. Čtyřstěn. 65 (4): 707–739. doi:10.1016 / j.tet.2008.10.038.
- ^ http://geocleanse.com/permanaganate.asp
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Carlos A. Murillo; Manfred Bochmann (1999). Pokročilá anorganická chemie (6. vydání). New York: John Wiley & Sons, Inc. str. 770. ISBN 978-0471199571.
- ^ Syndel. „Permanganan draselný, sodný dezinfekční prostředek“.
- ^ A. Calder, A. R. Forrester 1 a S. P. Hepburn (1972). „2-methyl-2-nitrosopropan a jeho dimer“. Organické syntézy. 6: 803.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 52, str. 77
- ^ Nathan Kornblum a Willard J. Jones (1963). „4-nitro-2,2,4-trimethylpentan“. Organické syntézy. 5: 845.; Kolektivní objem, 43, str. 87
- ^ J. W. Cornforth (1951). "Ethylpyruvát". Organické syntézy. 4: 467.; Kolektivní objem, 31, str. 59
- ^ R. L. Shriner a E. C. Kleiderer (1930). "Kyselina piperonylová". Organické syntézy. 2: 538.; Kolektivní objem, 10, str. 82
- ^ John R. Ruhoff (1936). "kyselina n-heptanová". Organické syntézy. 2: 315.; Kolektivní objem, 16, str. 39
- ^ Donald G. Lee, Shannon E. Lamb a Victor S. Chang (1981). "Karboxylové kyseliny z oxidace terminálních alkenů manganistanem: kyselina nonadekanová". Organické syntézy. 7: 397.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 60, str. 11
- ^ Kovacs KA, Grof P, Burai L, Riedel M (2004). "Revize mechanismu reakce manganistan / oxalát". J. Phys. Chem. A. 108 (50): 11026. Bibcode:2004JPCA..10811026K. doi:10.1021 / jp047061u.
- ^ E. J. Witzemann, Wm. Lloyd Evans, Henry Hass a E. F. Schroeder (1931). "dl-glyceraldehyd ethylacetal". Organické syntézy. 2: 307.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 11, str. 52

