Fenolftalein - Phenolphthalein
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC 3,3-Bis (4-hydroxyfenyl) -2-benzofuran-1 (3H)-jeden | |
| Ostatní jména 3,3-Bis (4-hydroxyfenyl) isobenzofuran-1 (3H)-jeden | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.000.914 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C20H14Ó4 | |
| Molární hmotnost | 318.328 g · mol−1 |
| Vzhled | bílý prášek |
| Hustota | 1,277 g / cm3 (32 ° C (90 ° F)) |
| Bod tání | 258–263 ° C (496–505 ° F; 531–536 K) [1] |
| 400 mg / l | |
| Rozpustnost v jiných rozpouštědlech | Nerozpustný v benzenu a hexanu; velmi dobře rozpustný v ethanolu a etheru; málo rozpustný v DMSO |
| UV-vis (λmax) | 552 nm (první) 374 nm (2.)[1] |
| Farmakologie | |
| A06AB04 (SZO) | |
| Nebezpečí | |
| Piktogramy GHS |  [1] [1] |
| Signální slovo GHS | Nebezpečí |
| H341, H350, H361[1] | |
| P201, P281, P308 + 313[1] | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fenolftalein je chemická sloučenina s vzorec C20H14Ó4 a je často psáno jako „HIn„nebo“phph"ve zkratkové notaci. Fenolftalein je často používán jako indikátor v acidobazické titrace. U této aplikace se změní na bezbarvý kyselé řešení a růžová v základní řešení. Patří do třídy barviv známých jako ftalinová barviva.
Fenolftalein je mírně rozpustný v voda a obvykle se rozpustí v alkoholy pro použití v experimenty. Je to slabá kyselina, která může ztratit H+ ionty v roztoku. Neionizovaná molekula fenolftaleinu je bezbarvá, protonovaný fenolftaleinový ion je oranžový a deprotonovaný fenolftaleinový ion je fuchsie. Když se k roztoku obsahujícímu fenolftalein přidá báze, rovnováha mezi neionizovaným a deprotonovaným stavem se posune ve prospěch deprotonovaného stavu jako H+ ionty jsou odstraněny z roztoku.
Použití
indikátor pH
Fenolftalein se běžně používá jako indikátor při acidobazických titracích. Slouží také jako součást univerzální indikátor, dohromady s methylová červeň, bromtymolová modrá, a thymolová modrá.[2]
Fenolftalein přijímá ve vodném roztoku nejméně čtyři různé stavy v důsledku změn pH.[3] Za silně kyselých podmínek existuje v protonované formě (HIn+), poskytující oranžové zbarvení. Mezi silně kyselými a mírně zásaditými podmínkami je laktonová forma (HIn) bezbarvá. Dvojnásobně deprotonovaný (In2-) fenolátová forma ( anion forma fenolu) dává známou růžovou barvu. V silně bazických roztocích se fenolftalein převádí na svůj In (OH)3− forma a její růžová barva prochází poměrně pomalou blednoucí reakcí[Citace je zapotřebí ] a nad 13,0 pH se stává zcela bezbarvý.
| Druh | H3v+ | H2v | v2− | V (OH)3− |
|---|---|---|---|---|
| Struktura | 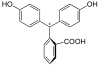 |  |  |  |
| Modelka |  |  |  |  |
| pH | <-1[3] | 0−8.2 | 8.2−10.0[4] | >10.0 |
| Podmínky | silně kyselá | kyselé nebo téměř neutrální | základní | silně základní |
| Barva | oranžový | bezbarvý | růžová až fuchsie | bezbarvý |
| obraz |  |  |
 |
| Animace reakčního mechanismu závislého na pH: H3v+ → H2V → V2− → In (OH)3− |
Karbonatace betonu
Citlivost fenolftaleinu na pH se využívá v jiných aplikacích: beton má přirozeně vysoké pH kvůli hydroxid vápenatý vytvořen, když portlandský cement reaguje s vodou. Jak beton reaguje s oxidem uhličitým v atmosféře, pH klesá na 8,5-9. Když se na normální beton aplikuje 1% roztok fenolftaleinu, zbarví se jasně do růžova. Pokud však zůstane bezbarvý, ukazuje to, že beton prošel karbonatací. V podobné aplikaci některé spackling slouží k opravě otvorů v sádrokartonu obsahuje fenolftalein. Při aplikaci si základní spackovací materiál zachovává růžovou barvu; když se spacking vytvrdí reakcí s atmosférickým oxidem uhličitým, růžová barva vybledne.[5]
Vzdělávání
Ve vysoce bazickém roztoku dochází k pomalé změně fenolftaleinu z růžové na bezbarvou při jeho přeměně na In (OH)3− forma se používá na hodinách chemie pro studium kinetiky reakcí.
Zábava
Fenolftalein se používá v hračkách, například jako součást mizejících inkoustů nebo mizejícího barviva na hollywoodských vlasech Barbie vlasy. V inkoustu je smíchán s hydroxid sodný, který reaguje s oxidem uhličitým ve vzduchu. Tato reakce vede k tomu, že pH klesne pod prahovou hodnotu změny barvy, protože se reakcí uvolňují vodíkové ionty:
K vývoji vlasů a „magických“ grafických vzorů je inkoust nastříkán roztokem hydroxidu, což vede ke vzhledu skryté grafiky stejným mechanismem, jak je popsáno výše pro změnu barvy v alkalickém roztoku. Vzorec nakonec zase zmizí kvůli reakci s oxid uhličitý. Thymolphthalein se používá pro stejný účel a stejným způsobem, když je požadována modrá barva.[6]
Lékařské použití
Fenolftalein se používá již více než století jako projímadlo, ale nyní je odstraněn z volně prodejné projímadla[7] kvůli obavám karcinogenita.[8][9] Laxativní přípravky, které dříve obsahovaly fenolfalein, byly často přeformulovány tak, aby obsahovaly alternativní účinné látky: Feen-a-Mint[10] přepnul na bisacodyl a Ex-Lax[11] byl přepnut na extrakt ze senny.
Thymolphthalein je příbuzné projímadlo vyrobené z thymol.
Navzdory obavám ohledně jeho karcinogenita je nepravděpodobné, že by užívání fenolftaleinu jako projímadla způsobilo rakovina vaječníků.[12] Bylo zjištěno, že fenolftalein inhibuje příliv lidského buněčného vápníku vstupem vápníku provozovaného v obchodě (SOCE, viz Kanál aktivovaný uvolňováním vápníku § Struktura ). To je ovlivněno jeho inhibicí trombin a thapsigargin, dva aktivátory SOCE, které zvyšují intracelulární volný vápník.[13]
Fenolftalein byl přidán do Evropská agentura pro chemické látky seznam kandidátů na Látky vzbuzující mimořádné obavy (SVHC).[14]
Snížená forma fenolftaleinu, fenolftaalin, který je bezbarvý, se používá v testu k identifikaci látek, o nichž se předpokládá, že obsahují krev, běžně známých jako Kastle – Meyerův test. Suchý vzorek se odebere tamponem nebo filtračním papírem. Několik kapek alkoholu, pak několik kapek fenolftafinu a nakonec několik kapek peroxid vodíku kapají na vzorek. Pokud vzorek obsahuje hemoglobin, zčervená okamžitě po přidání peroxidu z důvodu tvorby fenolftaleinu. Pozitivní test naznačuje, že vzorek obsahuje hemoglobin, a proto je pravděpodobné, že bude v krvi. Falešně pozitivní výsledek může být výsledkem přítomnosti látek s katalytickou aktivitou podobnou hemoglobinu. Tato zkouška není pro vzorek ničivá; lze jej uchovat a použít v dalších testech. Tento test má stejnou reakci s krví jakéhokoli zvířete, jehož krev obsahuje hemoglobin, včetně téměř všech obratlovců; k určení, zda pochází od člověka, by bylo zapotřebí dalšího testování.
Syntéza
Fenolftalein lze syntetizovat kondenzací anhydrid kyseliny ftalové se dvěma ekvivalenty fenol za kyselých podmínek (odtud název). To bylo objeveno v roce 1871 Adolf von Baeyer.[15][16][17]

Reakci lze také katalyzovat směsí chlorid zinečnatý a thionylchlorid.[19]
Viz také
Reference
- ^ A b C d E "Fenolftalein". Citováno 7. října 2014.
- ^ „Univerzální indikátor“. ISCID Encyclopedia of Science and Philosophy. Archivovány od originál dne 25. září 2006.
- ^ A b Wittke, Georg (1. března 1983). "Reakce fenolftaleinu při různých hodnotách pH". Journal of Chemical Education. 60 (3): 239. doi:10.1021 / ed060p239. ISSN 0021-9584.
- ^ Rathod, Balraj B .; Murthy, Sahana; Bandyopadhyay, Subhajit (20. února 2019). „Je toto řešení dost růžové? Učitel chytrých telefonů k vyřešení věčné otázky při titraci na základě fenolftaleinu“. Journal of Chemical Education. 96 (3): 486–494. doi:10.1021 / acs.jchemed.8b00708.
- ^ USA 6531528 „Ronald D. Kurp,„ Připravený k použití, opravný přípravek obsahující indikátor suchosti “, přidělen společnosti Dap Products Inc.
- ^ Hračkářství
- ^ Spiller, H. A .; Winter, M.L .; Weber, J. A .; Krenzelok, E. P .; Anderson, D. L .; Ryan, M. L. (květen 2003). „Rozpad kůže a puchýře z laxativ obsahujících Senna u malých dětí“. The Annals of Pharmacotherapy. 37 (5): 636–639. doi:10,1345 / aph. 1C439. PMID 12708936. S2CID 31837142.
- ^ Dunnick, J. K .; Hailey, J. R. (1996). „Expozice fenolftaleinu způsobuje více karcinogenních účinků v experimentálních modelových systémech“ (PDF). Výzkum rakoviny. 56 (21): 4922–4926. PMID 8895745.
- ^ Tice, R. R .; Furedi-Machacek, M .; Satterfield, D .; Udumudi, A .; Vasquez, M .; Dunnick, J. K. (1998). "Měření mikronukleovaných erytrocytů a poškození DNA během chronického požití fenolftaleinu v transgenních myších samičích heterozygotech pro gen p53". Environmentální a molekulární mutageneze. 31 (2): 113–124. doi:10.1002 / (SICI) 1098-2280 (1998) 31: 2 <113 :: AID-EM3> 3.0.CO; 2-N. PMID 9544189.
- ^ https://www.drugbank.ca/drugs/DB04824
- ^ Stolberg, Sheryl Gay (30. srpna 1997). „3 verze Ex-Lax jsou odvolány poté, co F.D.A. navrhuje zákaz přísad“.
- ^ Cooper, G. S .; Longnecker, M. P .; Peters, R. K. (2004). "Riziko rakoviny vaječníků a užívání laxativ obsahujících fenolftalein". Farmakoepidemiologie a bezpečnost léčiv. 13 (1): 35–39. doi:10,1002 / pds.824. PMID 14971121.
- ^ Dobrydneva, Y .; Wilson, E .; Abelt, C. J .; Blackmore, P. F. (2009). „Fenolftalein jako prototypové léčivo pro skupinu strukturně příbuzných blokátorů kalciových kanálů v lidských krevních destičkách“. Journal of Cardiovascular Pharmacology. 53 (3): 231–240. doi:10.1097 / FJC.0b013e31819b5494. PMID 19247192. S2CID 21833487.
- ^ "Fenolftalein - informace o látce - ECHA". echa.europa.eu. Citováno 2017-11-06.
- ^ Baeyer, A. (1871). „Ueber eine neue Klasse von Farbstoffen“. Berichte der Deutschen Chemischen Gesellschaft. 4 (2): 555–558. doi:10,1002 / cber.18710040209.
- ^ Baeyer, A. (1871). „Ueber die Phenolfarbstoffe“. Berichte der Deutschen Chemischen Gesellschaft. 4 (2): 658–665. doi:10,1002 / cber.18710040247.
- ^ Baeyer, A. (1871). „Ueber die Phenolfarbstoffe“. Polytechnisches Journal. 201 (89): 358–362.
- ^ Max Hubacher, US patent 2192485 (1940 Ex Lax Inc)
- ^ US patent 2522 939

