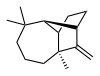
Longifolen - Longifolene
 | |
| Jména | |
|---|---|
| Název IUPAC (1R,2S,7S,9S) - 3,3,7-trimethyl-8-methylenetricyklo- [5.4.0.02,9] undecane | |
| Identifikátory | |
| |
3D model (JSmol ) |
|
| 5731712 2044263 4663756 | |
| ChEBI |
|
| ChemSpider | |
| Informační karta ECHA | 100.006.812 |
| Číslo ES |
|
PubChem CID | |
| UNII |
|
Řídicí panel CompTox (EPA) |
|
| |
| |
| Vlastnosti | |
| C15H24 | |
| Molární hmotnost | 204,36 g / mol |
| Hustota | 0,928 g / cm3 |
| Bod varu | 254 ° C (489 ° F; 527 K) (706 mm Hg) |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H304, H317, H400, H410 | |
| P261, P272, P273, P280, P301 + 310, P302 + 352, P321, P331, P333 + 313, P363, P391, P405, P501 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Longifolen je běžný (nebo triviální) chemický název přirozeně se vyskytující olejové kapaliny uhlovodík nachází se především ve vysokovroucí frakci určité borovice pryskyřice. Název je odvozen od názvu a borovice druhy, ze kterých byla sloučenina izolována,[1] Pinus longifolia (zastaralý název pro Pinus roxburghii Sarg.)[2]
Chemicky je longifolen tricyklický seskviterpen. Tato molekula je chirální a enantiomer běžně se vyskytující u borovic a jiných vyšších rostlin vykazuje pozitivní účinek optická rotace + 42,73 °. Druhý enantiomer (optická rotace -42,73 °) se nachází v určitých množstvích houby a játrovky.
Longifolen se používá v organické syntéze k přípravě dilongifolylboranu,[3] chirál hydroborující činidlo.
Longifolen je také jedním ze dvou nejhojnějších aroma složky lapsang souchong čaj, protože čaj se kouří přes ohně z borového dřeva.[4]
Celková syntéza
Kvůli kompaktní tricyklické struktuře a nedostatku funkční skupiny „Longifolene je atraktivním cílem pro výzkumné skupiny, které zdůrazňují nové syntetické metodiky. Pozoruhodné syntézy jsou podle Corey,[5][6] McMurry,[7] Johnson,[8] Oppolzer,[9] a Schultz.[10] Fallis publikoval stereoselektivní syntézu (+) - longifolenu pomocí intramolekul Diels-Alder strategie.[11]
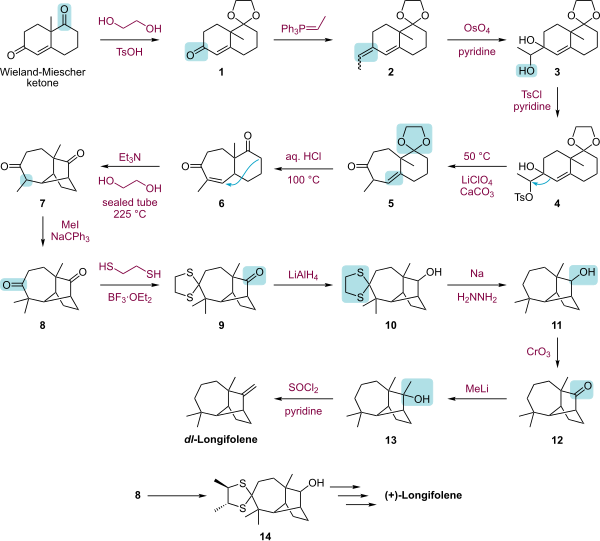 |
| Celková syntéza longifolenu od Corey.svg |
|---|
Johnsonova biosyntéza byla od té doby ověřena jako proveditelná pomocí moderních kvantově mechanických výpočetních metod. Ukázalo se, že následný kationtový kaskádový mechanismus prochází a neklasický kation středně pokročilí.[12]
Biosyntéza
Biosyntéza longifolenu začíná farnesyl difosfát (1) (také zvaný farnesylpyrofosfát ) pomocí kationtové polycyklizační kaskády. Ztráta pyrofosfátové skupiny a cyklizace distální alken dává meziprodukt 3, který prostřednictvím a 1,3-hydridový posun dává meziprodukt 4. Po dvou dalších cyklizacích, střední 6 produkuje longifolen a Migrace 1,2-alkylu.

Použití
Boranový derivát dilongifolylboran se používá v organická syntéza jako chirál hydroborující činidlo.[13]
Reference
- ^ Naffa, P .; Ourisson, G. Bulletin de la Société chimique de France, 1954, 1410.
- ^ Simonsen, J. L. J. Chem. Soc. 1920, 117, 570.
- ^ Jadhav, P. K .; Brown, H. C. J. Org. Chem. 1981, 46, 2988.
- ^ Shan-Shan Yao ; Wen-Fei Guo ; YI Lu ; Yuan-Xun Jiang, „Charakteristické vlastnosti příchutí Lapsang Souchong a uzeného Lapsang Souchong, což je speciální čínský černý čaj s kouřením borovice“, Journal of Agricultural and Food Chemistry, Sv. 53, č. 22, (2005)[trvalý mrtvý odkaz ]
- ^ Corey, E. J .; Ohno, Masaji .; Mitra, Rajat B .; Vatakencherry, Paul A. (únor 1964). "Celková syntéza longifolenu". Journal of the American Chemical Society. 86 (3): 478–485. doi:10.1021 / ja01057a039.
- ^ Corey, E. J .; Ohno, Masaji; Vatakencherry, Paul A .; Mitra, Rajat B. (březen 1961). "CELKOVÁ SYNTÉZA d, l-LONGIFOLENU". Journal of the American Chemical Society. 83 (5): 1251–1253. doi:10.1021 / ja01466a056.
- ^ McMurry, John E .; Vydavatel, Stephen J. (říjen 1972). "Celková syntéza longifolenu". Journal of the American Chemical Society. 94 (20): 7132–7137. doi:10.1021 / ja00775a044.
- ^ Volkmann, Robert A .; Andrews, Glenn C .; Johnson, William S. (srpen 1975). "Nová syntéza longifolenu". Journal of the American Chemical Society. 97 (16): 4777–4779. doi:10.1021 / ja00849a062.
- ^ Oppolzer, Wolfgang; Godel, Thierry (duben 1978). "Nová a účinná celková syntéza (. + -.) - longifolenu". Journal of the American Chemical Society. 100 (8): 2583–2584. doi:10.1021 / ja00476a071.
- ^ Schultz, Arthur G .; Puig, Salvador (březen 1985). "Ekvivalence cykloadice intramolekulárního dienu a karbenu a enantioselektivní Birchova redukce-alkylace chirálním pomocným přístupem. Celková syntéza (. + -.) - a (-) - longifolenu." The Journal of Organic Chemistry. 50 (6): 915–916. doi:10.1021 / jo00206a049.
- ^ Bo, Lei; Fallis, Alex G. (květen 1990). "Přímá celková syntéza (+) - longifolenu prostřednictvím intramolekulární Diels-Alderovy strategie". Journal of the American Chemical Society. 112 (11): 4609–4610. doi:10.1021 / ja00167a105.
- ^ Ho, Gregory J. Org. Chem. 2005, 70, 5139 -5143.
- ^ Dev, Sukh (1981). „Aspekty chemie longifolenu. Příklad jiného aspektu chemie přírodních produktů“. Účty chemického výzkumu. 14 (3): 82–88. doi:10.1021 / ar00063a004.
