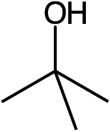
Terc-butylalkohol - Tert-Butyl alcohol
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 2-methylpropan-2-ol | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 906698 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.000.809 | ||
| Číslo ES |
| ||
| 1833 | |||
| Pletivo | terc-butyl + alkohol | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1120 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H10Ó | |||
| Molární hmotnost | 74.123 g · mol−1 | ||
| Vzhled | Bezbarvá pevná látka | ||
| Zápach | Kafr | ||
| Hustota | 0,775 g / ml | ||
| Bod tání | 25 až 26 ° C; 77 až 79 ° F; 298 až 299 K. | ||
| Bod varu | 82 až 83 ° C; 179 až 181 ° F; 355 až 356 K. | ||
| mísitelný[2] | |||
| log P | 0.584 | ||
| Tlak páry | 4,1 kPa (při 20 ° C) | ||
| Kyselost (strK.A) | 16.54 [3] | ||
| 5.742×10−5 cm3/ mol | |||
Index lomu (nD) | 1.387 | ||
| 1,31 D. | |||
| Termochemie | |||
Tepelná kapacita (C) | 215,37 J K.−1 mol−1 | ||
Std molární entropie (S | 189,5 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | −360,04 až −358,36 kJ mol−1 | ||
Std entalpie of spalování (ΔCH⦵298) | −2,64479 až −2,64321 MJ mol−1 | ||
| Nebezpečí | |||
| Bezpečnostní list | inchem.org | ||
| Piktogramy GHS |   | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H319, H332, H335 | |||
| P210, P261, P305 + 351 + 338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 11 ° C (52 ° F; 284 K) | ||
| 480 ° C (896 ° F; 753 K) | |||
| Výbušné limity | 2.4–8.0% | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 3559 mg / kg (králík, orální) 3500 mg / kg (potkan, orální)[4] | ||
| NIOSH (Limity expozice USA zdraví): | |||
PEL (Dovolený) | PEL 100 ppm (300 mg / m3)[1] | ||
REL (Doporučeno) | PEL 100 ppm (300 mg / m3) ST 150 ppm (450 mg / m.)3)[1] | ||
IDLH (Okamžité nebezpečí) | 1600 ppm[1] | ||
| Související sloučeniny | |||
Příbuzný butanoly | 2-butanol | ||
Související sloučeniny | 2-methyl-2-butanol Trimethylsilanol | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
tert-Butylalkohol (TBA), také zvaný tert-butanol nebo t-butanol, je nejjednodušší terciární alkohol, s vzorec z (CH3)3COH (někdy zastoupeny tak jako t-BuOH). Je to jeden ze čtyř izomery z butanol.[A] tert-Butylalkohol je bezbarvá pevná látka, která taje při pokojové teplotě a má kafr - jako zápach. Je to mísitelné s voda, ethanol a diethylether.
Přirozený výskyt
tert-Butylalkohol byl identifikován v pivo a cizrna.[5] To je také nalezené v maniok,[6] který se v určitých případech používá jako fermentační přísada alkoholické nápoje.
Příprava
tert-Butylalkohol je komerčně odvozen od isobutan jako koprodukt propylenoxid Výroba. Může být také vyroben katalyticky hydratace z isobutylen, nebo Grignardova reakce mezi aceton a methylmagnesiumchlorid.
Čištění nelze provést jednoduchou destilací kvůli tvorbě azeotrop s vodou, ačkoli počáteční sušení rozpouštědla obsahujícího velké množství vody se provádí přidáním benzenu za vzniku terciárního azeotropu a oddestilováním vody. Menší množství vody se odstraní sušením oxid vápenatý (CaO), Uhličitan draselný (K.2CO3), síran vápenatý (CaSO4), nebo Síran hořečnatý (MgSO4), následovanou frakční destilací. Bezvodý tert-butylalkohol se získává dalším refluxováním a destilací z hořčíku aktivovaného jodem nebo alkalických kovů, jako je sodík nebo draslík. Mezi další metody patří použití 4A molekulární síta, hliník tert-butylát, hydrid vápenatý (CaH2) nebo frakční krystalizace v inertní atmosféře.[7]
Aplikace
tert-Butylalkohol se používá jako rozpouštědlo, ethanol denaturant, odstraňovač barvy přísada a benzín oktan posilovač a okysličovat. Jedná se o chemický meziprodukt používaný k výrobě methyl tert-butylether (MTBE) a ethyl tert-butylether (ETBE) reakcí s methanolu a ethanol, respektive, a tert-butylhydroperoxid (TBHP) reakcí s peroxid vodíku.
Reakce
Jako terciární alkohol tert-butylalkohol je odolnější vůči oxidaci než jiné izomery butanolu.
tert-Butylalkohol je deprotonován silným základna dát alkoxid. Obzvláště časté je draslík tert-butoxid, který se připravuje zpracováním tert-butanol s draslík kov.[8]
- K + t-BuOH → t-BuO−K.+ + 1/2 H2
The tert-butoxid je silný, ne-nukleofilní základ v organické chemii. Snadno abstrahuje kyselé protony ze substrátů, ale jeho sterický objem inhibuje účast skupiny nukleofilní substituce, například v a Williamsonova etherová syntéza nebo SN2 reakce.
tert-Butylalkohol reaguje s chlorovodík tvořit tert-butylchlorid.
O-Chlorace terc-butylalkoholu s kyselinou chlornou za vzniku terc-butylchlornan:[9]
- (CH3)3COH + HOCl → (CH3)3COCl + H2Ó
Farmakologie a toxikologie
K dispozici jsou omezené údaje o farmakologii a toxikologii terc-butanolu u lidí a jiných zvířat.[10] Může dojít k expozici člověka v důsledku metabolismu kyslíkatého paliva. Terc-butanol se špatně vstřebává kůží, ale rychle se vstřebává při vdechování nebo požití. Terc-butanol dráždí pokožku nebo oči. Toxicita jednotlivých dávek je obvykle nízká, ale vysoké dávky mohou mít sedativní nebo anestetický účinek.
Poznámky
- ^ Ostatní izomery tert-Butylalkohol, (CH3)3COH, jsou Isobutanol, (CH3)2CHCH2ACH, 2-butanol, CH3CH2CH (OH) CH3, a n-Butanol, CH3CH2CH2CH2ACH. Všechny tyto sloučeniny mají stejný celkový chemický vzorec C4H10O, a jako takové jsou považovány za izomery.
Reference
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0078". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „ICSC 0114 - tert-Butanol ". Inchem.org. Citováno 29. března 2018.
- ^ Reeve, W .; Erikson, C. M .; Aluotto, P. F. (1979). „terc-butylalkohol“. Umět. J. Chem. 57: 2747. doi:10.1139 / v79-444.
- ^ „terc-butylalkohol“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ "t-Butylalkohol ". Databáze HSDB National Library of Medicine. Národní institut pro zdraví. Citováno 29. března 2018.
- ^ „Archivovaná kopie“ (PDF). Archivovány od originál (PDF) dne 04.03.2016. Citováno 2013-03-05.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Perrin, D. D .; Armarego, W. L. F. (1988). Čištění laboratorních chemikálií (3. vyd.). Pergamon Press.
- ^ Johnson, W. S .; Schneider, W. P. (1950). „kyselina β-karbetoxy-γ, γ-difenylvinyloctová“. Organické syntézy. 30: 18. doi:10.15227 / orgsyn.030.0018.
- ^ Mintz, H. M .; Walling, C. (1969). „t-butylchlornan“. Org. Synth. 49: 9. doi:10.15227 / orgsyn.049.0009.
- ^ Douglas McGregor (2010). „Terciární butanol: toxikologický přehled“. Kritické recenze v toxikologii. 40 (8): 697–727. doi:10.3109/10408444.2010.494249. PMID 20722584. S2CID 26041562.
externí odkazy
- Mezinárodní karta chemické bezpečnosti 0114
- NIOSH Kapesní průvodce chemickými nebezpečími. "#0078". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- IPCS Kritéria pro ochranu životního prostředí 65: Butanoly: čtyři izomery
- IPCS Průvodce bezpečností a ochranou zdraví 7: tert-Butanol