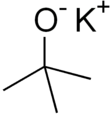Terc-butoxid draselný - Potassium tert-butoxide
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 2-methylpropan-2-olát draselný | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.011.583 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H9KO | |||
| Molární hmotnost | 112,21 g mol−1 | ||
| Vzhled | pevný | ||
| Bod tání | 256 ° C (493 ° F; 529 K) | ||
| Rozpustnost v diethylether | 4,34 g / 100 g (25-26 ° C)[1] | ||
| Rozpustnost v Hexan | 0,27 g / 100 g (25-26 ° C)[1] | ||
| Rozpustnost v Toluen | 2,27 g / 100 g (25-26 ° C)[1] | ||
| Rozpustnost v THF | 25,00 g / 100 g (25-26 ° C)[1] | ||
| Nebezpečí | |||
| Bezpečnostní list | Oxford MSDS | ||
Klasifikace EU (DSD) (zastaralý) | Zdraví škodlivý (Xn), Žíravý (C) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
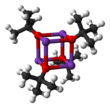
Draslík tert-butoxid je chemická sloučenina s vzorec K.+(CH3)3CO−. Tato bezbarvá pevná látka je silná základna (pKa konjugované kyseliny kolem 17), což je užitečné při organická syntéza. Existuje jako tetramerní shluk kubánského typu. To je často viděno psáno v chemické literatuře jako draslík t-butoxid. Sloučenina je často zobrazována jako sůl a často se chová jako taková, ale není ionizovaná v roztoku.
Příprava
Draslík t-butoxid je komerčně dostupný jako roztok a jako pevná látka, ale často se vytváří in situ pro laboratorní použití, protože vzorky jsou tak citlivé a starší vzorky jsou často nekvalitní. Připravuje se reakcí za sucha tert-butylalkohol s draslík kov.[2] Pevná látka se získá odpařením těchto roztoků a následným zahřátím pevné látky. Pevná látka může být purifikována sublimací při 220 ° C a 1 mmHg. Sublimace může také probíhat při 140 ° C a 0,01 hPa. Doporučuje se surovinu přikrýt skleněnou vatou, protože terc-butanolát draselný má tendenci „odskakovat“, takže při sublimaci mohou být části vymrštěny. Obzvláště výhodné je odstranění bezvodého pomocí inertního sublimačního zařízení.
Struktura
Draslík tert-butoxid krystalizuje z tetrahydrofuran /pentan při -20 ° C jako [tBuOK · tBuOH]∞, který se skládá z nekonečných jednorozměrných řetězců spojených pomocí vodíkové vazby. Sublimace [tBuOK · tBuOH]∞ poskytuje tetramer [tBuOK]4, který přijímá kubánskou strukturu. Mírný Lewis základní rozpouštědla, jako je THF a diethylether nerozbírejte tetramerickou strukturu, která přetrvává v pevné látce, v roztoku a dokonce i v plynné fázi.[3]
Aplikace
The tert-butoxidový druh je sám o sobě užitečný jako silná, nenukleofilní báze v organické chemii.[4] Není tak silný jako amidové báze, např. lithium diisopropylamid, ale silnější než hydroxid draselný. Jeho sterický objem inhibuje účast skupiny na nukleofilní adici, jako například v a Williamsonova etherová syntéza nebo SN2 reakce. Substráty, které jsou deprotonovány draslíkem t-butoxid zahrnují terminální acetyleny a aktivní methylenové sloučeniny. Je to užitečné v dehydrohalogenace reakce.
Draslík tert-butoxid katalyzuje reakci hydrosilany a heterocyklické sloučeniny za vzniku silylových derivátů s uvolňováním H2.[5]
Modifikace
Bylo popsáno mnoho modifikací, které ovlivňují reaktivitu tohoto činidla. Sloučenina přijímá složitou strukturu klastru (sousední obrázek je zjednodušená karikatura) a přísady, které modifikují klastr, ovlivňují reaktivitu činidla. Například, DMF, DMSO, hexamethylfosforamid (HMPA) a 18-koruny-6 interagují s centrem draslíku a zvyšují zásaditost butoxidu. Schlosserova základna, směs alkoxidu a alkyl lithiové sloučeniny, je příbuzná, ale silnější báze.[4]
Reakce
Draslík tert-butoxid reaguje s chloroformem za vzniku dichlorkarbenu,[6] reakce může mít za následek vznícení.[7] Draslík tert-butoxid by se nikdy neměl přidávat do dichlormethanu.[8]
Jako báze může terc-butoxid draselný extrahovat beta-proton a tvořit produkt Hofmann prostřednictvím eliminační reakce. Tato reakce má vysokou syntetickou hodnotu, protože může nastavit další reakce výslednice alken, zejména regiochemické reakce.
Související sloučeniny
Reference
- ^ A b C d Caine D. (2006). "Butoxid draselný". Terc-Butoxid draselný. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002 / 047084289X.rp198.pub2. ISBN 0471936235.
- ^ William S. Johnson a William P. Schneider (1963). „Kyselina β-karbetoxy-γ, γ-difenylvinyloctová“. Organické syntézy.; Kolektivní objem, 4, str. 132
- ^ Chisholm, Malcolm H .; Drake, Simon R .; Naiini, Ahmad A .; Streib, William E. (1991). „Syntéza a rentgenové krystalové struktury jednorozměrných páskových řetězců [MOBut· ButACH]∞ a kubánský druh [MOBut]4 (M = K a Rb) ". Mnohostěn. 10 (3): 337–345. doi:10.1016 / S0277-5387 (00) 80154-0.
- ^ A b Drury Caine „t-Butoxid draselný“ v Encyklopedii činidel pro organickou syntézu John Wiley & Sons, New York, 2006. doi: 10.1002 / 047084289X.rp198.pub2. Článek Datum zveřejnění článku: 15. září 2006
- ^ Anton A. Toutov, Wen-Bo Liu, Kerry N. Betz, Alexey Fedorov, Brian Stoltz, Robert H. Grubbs (2015). „Silylace C – H vazeb v aromatických heterocyklech kovovým katalyzátorem bohatým na Zemi“ (PDF). Příroda. 518 (7537): 80–84. doi:10.1038 / příroda14126. PMID 25652999. S2CID 3117834.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Brown, William; Foote, Christopher; Iverson, Brent; Anslyn, Eric (01.01.2008). Organická chemie. Cengage Learning. ISBN 978-0495388579.
- ^ Margaret-Ann Armor (2016-04-19). Příručka pro zneškodňování nebezpečných laboratorních chemikálií, třetí vydání. CRC Press. ISBN 9781420032383.
- ^ Foden, Charles R .; Weddell, Jack L. (1991-12-29). Nebezpečné materiály: Údaje o mimořádných událostech. CRC Press. ISBN 9780873715980.