GABAA receptor - GABAA receptor

The GABAA receptor (GABAAR) je ionotropní receptor a iontový kanál řízený ligandem. Své endogenní ligand je kyselina y-aminomáselná (GABA), hlavní inhibiční látka neurotransmiter v centrální nervový systém. Po otevření GABAA receptor je selektivně propustný pro chloridové ionty (Cl−) a v menší míře hydrogenuhličitanové ionty (HCO3−).[4][5] Záleží na membránový potenciál a rozdíl iontové koncentrace, může to vést k iontovým tokům přes póry. Například za fyziologických podmínek Cl− bude proudit uvnitř buňky, pokud je potenciál membrány vyšší než rovnovážný potenciál (také známý jako reverzní potenciál) pro chloridové ionty, pokud je aktivován receptor.[6] To způsobí inhibiční účinek na neurotransmise snížením šance na úspěch akční potenciál vyskytující se v postsynaptické buňce. Reverzní potenciál GABAA-zprostředkovaný inhibiční postsynaptický potenciál (IPSP) v normálním řešení je -70 mV, což kontrastuje s GABAB IPSP (-100 mV).
The Aktivní stránky GABAA receptor je vazebným místem pro GABA a několik léků, jako je muscimol, gaboxadol, a bicuculline.[7] Protein také obsahuje řadu různých alosterická vazebná místa které nepřímo modulují aktivitu receptoru. Tyto alosterické stránky jsou terčem různých jiných léků, včetně benzodiazepiny, nonbenzodiazepiny, neuroaktivní steroidy, barbituráty, alkohol (ethanol),[8] inhalační anestetika, kavalaktony, a pikrotoxin, mezi ostatními.[9]
GABAA receptory se vyskytují ve všech organismech, které mají nervový systém. V omezené míře se receptory nacházejí v jiných než neuronálních tkáních. Díky své široké distribuci v nervovém systému savců hrají roli prakticky ve všech mozkových funkcích.
Cíl pro benzodiazepiny
The ionotropní GABAA komplex receptor-protein je také molekulárním cílem benzodiazepin třída sedativ. Benzodiazepiny se neváží na stejný receptor stránky na proteinovém komplexu jako endogenním ligandu GABA (jehož vazebné místo je umístěno mezi α- a β-podjednotkami), ale váží se na odlišná benzodiazepinová vazebná místa umístěná na rozhraní mezi a- a γ-podjednotkami α- a γ-podjednotky obsahující GABAA receptory.[10][11] Zatímco většina GABAA receptory (ty, které obsahují α1-, α2-, α3- nebo α5-jednotky) jsou citlivé na benzodiazepiny, existuje menšina GABAA receptory (α4- nebo α6obsahující podjednotku), které jsou necitlivé na klasické 1,4-benzodiazepiny,[12] ale místo toho jsou citliví na jiné třídy GABAergních léků, jako jsou neurosteroidy a alkohol. Kromě toho periferní benzodiazepinové receptory existují, které nejsou spojeny s GABAA receptory. V důsledku toho IUPHAR doporučil, aby podmínky „BZ receptor", "GABA / BZ receptor" a "receptor omega„již se nepoužívá a že výraz“benzodiazepinový receptor„být nahrazen“místo benzodiazepinů".[13]
Aby GABAA receptory, aby byly citlivé na působení benzodiazepinů, musí obsahovat podjednotku α a γ, mezi nimiž se benzodiazepiny váží. Jakmile je vázán, benzodiazepin blokuje GABAA receptoru do konformace, kde neurotransmiter GABA má mnohem vyšší afinitu k GABAA receptor, což zvyšuje frekvenci otevírání přidruženého chloridového iontového kanálu a hyperpolarizaci membrány. To zesiluje inhibiční účinek dostupné GABA, což vede k sedativním a anxiolytickým účinkům.[Citace je zapotřebí ]
Různé benzodiazepiny mají různé afinity k GABAA receptory vytvořené z různých souborů podjednotek, a to znamená, že jejich farmakologický profil se mění s podtypovou selektivitou. Například ligandy benzodiazepinových receptorů s vysokou aktivitou na a1 a / nebo α5 mají tendenci být více spojeni s sedace, ataxie a amnézie, zatímco ti s vyšší aktivitou na GABAA receptory obsahující α2 a / nebo α3 podjednotky mají obecně větší anxiolytikum aktivita.[14] Antikonvulzivum účinky mohou vyvolat agonisté působící na kterékoli z GABAA subtypy, ale současný výzkum v této oblasti je zaměřen hlavně na produkci α2- selektivní agonisté jako antikonvulziva, která postrádají vedlejší účinky starších léků, jako je sedace a amnézie.
Vazebné místo pro benzodiazepiny je odlišné od vazebného místa pro barbituráty a GABA na GABAA receptor, a také produkuje různé účinky na vazbu,[15] přičemž benzodiazepiny zvyšují frekvenci otevírání chloridového kanálu, zatímco barbituráty prodlužují dobu otevírání chloridového kanálu, když je navázán GABA.[16] Jelikož se jedná o samostatné modulační účinky, mohou probíhat současně, a proto je kombinace benzodiazepinů s barbituráty silně synergická a může být nebezpečná, pokud není přísně kontrolována dávka.
Všimněte si také, že některé GABAA agonisté jako např muscimol a gaboxadol vázat se na stejné místo na GABAA receptorový komplex jako samotný GABA, a následně produkují účinky, které jsou podobné, ale ne identické s účinky pozitivních alosterických modulátorů, jako jsou benzodiazepiny.[Citace je zapotřebí ]
Struktura a funkce

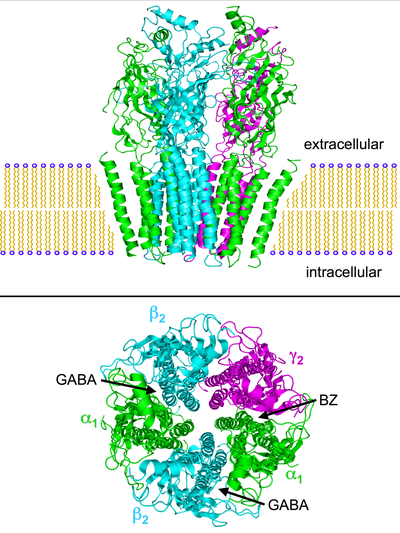
Strukturální porozumění GABAA Receptor byl zpočátku založen na homologických modelech získaných za použití krystalových struktur homologních proteinů, jako je protein vázající acetylcholin (AChBP) a receptory nikotinového acetylcholinu (nACh) jako šablony.[17][18] Velmi vyhledávaná struktura GABAA receptor byl nakonec vyřešen, s odhalením krystalové struktury humánního p3 homopentamerního GABAA receptor.[19]I když se jednalo o zásadní vývoj, většina GABAA receptory jsou heteromerní a struktura neposkytla žádné podrobnosti o vazebném místě benzodiazepinu. To bylo konečně objasněno v roce 2018 zveřejněním kryo-EM struktury krysího α1β1γ2S receptoru s vysokým rozlišením[20] a lidský receptor α1β2γ2 navázaný na GABA a neutrální benzodiazepin flumazenil.[21]
GABAA receptory jsou pentamerický transmembránové receptory které se skládají z pěti podjednotek uspořádaných kolem centrální pór. Každá podjednotka obsahuje čtyři transmembránové domény s N-a C-koncem umístěným extracelulárně. Receptor sedí v membrána jeho neuron, obvykle lokalizovány na a synapse, postsynapticky. Některé izoformy však lze nalézt extrasynapticky.[22] Když vezikuly GABA se uvolňují presynapticky a aktivují receptory GABA na synapse, což se označuje jako fázická inhibice. Avšak GABA unikající ze synaptické štěrbiny může kromě stálých nízkých koncentrací GABA v extracelulárním prostoru aktivovat receptory na presynaptických terminálech nebo na sousedních synapsích na stejných nebo sousedních neuronech (jev nazývaný „přelévání“). GABAA receptory známé jako tonická inhibice.[23]
The ligand GABA je endogenní sloučenina, která způsobí otevření tohoto receptoru; jednou vázán na GABA, protein receptor mění konformaci uvnitř membrány a otevírá póry, aby to umožnil chlorid anionty (Cl−) a v menší míře hydrogenuhličitanové ionty (HCO−) předat své elektrochemický gradient. Protože reverzní potenciál protože chlorid ve většině zralých neuronech je blízký nebo negativnější než ostatní membránový potenciál, aktivace GABAA receptory mají tendenci stabilizovat nebo hyperpolarizovat klidový potenciál a mohou ztěžovat excitaci neurotransmitery na depolarizovat neuron a vygenerovat akční potenciál. Čistý účinek proto typicky inhibiční, snižuje aktivitu neuronu, ačkoli byly pozorovány depolarizační proudy v reakci na GABA u nezralých neuronů v raném vývoji v důsledku modifikovaného Cl− gradient, ve kterém anionty opouštějí buňky prostřednictvím GABAA receptory, protože jejich intracelulární koncentrace je vyšší než extracelulární.[24] To je pravděpodobně způsobeno aktivitou transportů chloridů, jako je např NKCC1, transport chloridů do buňky, které jsou přítomny v rané fázi vývoje, zatímco například KCC2 transportuje chlorid z buňky a je dominantním faktorem při stanovení chloridového gradientu později ve vývoji. Tyto depolarizační události se ukázaly jako klíčové pro vývoj neuronů.[25] Ve zralém neuronu, GABAA kanál se otevírá rychle a přispívá tak k rané fázi inhibiční postsynaptický potenciál (IPSP).[26][27]Endogenní ligand, který se váže na benzodiazepinové místo, je inosin.[28][Citace je zapotřebí ]
Podjednotky
GABAA receptory jsou členy velkého pentamerního ligandu řízeného iontového kanálu (dříve označovaného jako „Cys-loop "receptory) superrodina evolučně příbuzných a strukturně podobných ligandem řízené iontové kanály to také zahrnuje nikotinové acetylcholinové receptory, glycinové receptory a 5HT3 receptor. Existuje mnoho podjednotek izoformy pro GABAA receptor, který určuje afinitu agonisty receptoru, šanci na otevření, vodivost a další vlastnosti.[29]
U lidí jsou tyto jednotky následující:[30]
- šest typů podjednotek α (GABRA1, GABRA2, GABRA3, GABRA4, GABRA5, GABRA6 )
- tři βs (GABRB1, GABRB2, GABRB3 )
- tři γs (GABRG1, GABRG2, GABRG3 )
- stejně jako δ (GABRD ), an ε (GABRE ), a π (GABRP ) a θ (GABRQ )
Existují tři jednotky ρ (GABRR1, GABRR2, GABRR3 ); tyto se však nespojují s klasickou GABAA jednotky uvedené výše,[31] ale spíše homooligomerize tvořit GABAA-ρ receptory (dříve klasifikováno jako GABAC receptory, ale teď tohle nomenklatura byla ukončena podpora[32]).
Rozdělení
GABAA receptory jsou zodpovědné za většinu fyziologických aktivit GABA v centrálním nervovém systému a podtypy receptorů se významně liší. Složení podjednotky se může mezi regiony velmi lišit a podtypy mohou být spojeny se specifickými funkcemi. Minimálním požadavkem na produkci iontového kanálu s bránou GABA je zahrnutí podjednotky a a p.[33] Nejběžnější GABAA Receptor je pentamer obsahující dva α, dva p a y (α2β2γ).[30] U samotných neuronů typ GABAA receptorové podjednotky a jejich hustoty se mohou mezi nimi lišit buněčná těla a dendrity.[34] GABAA receptory lze nalézt také v jiných tkáních, včetně Leydigovy buňky, placenta, imunitní buňky, játra, kostní růstové ploténky a několik dalších endokrinní tkáně. Exprese podjednotky se liší mezi „normální“ tkání a malignity jako GABAA receptory mohou ovlivnit proliferace buněk.[35]
| Isoform | Synaptické / extrasynaptické | Anatomické umístění |
|---|---|---|
| α1β3γ2S | Oba | Rozšířené |
| α2β3γ2S | Oba | Rozšířené |
| α3β3γ2S | Oba | Retikulární thalamové jádro |
| α4β3γ2S | Oba | Thalamické reléové buňky |
| α5β3γ2S | Oba | Hipokampální pyramidové buňky |
| α6β3γ2S | Oba | Cerebelární granulární buňky |
| α1β2γ2S | Oba | Rozšířené, nejhojnější |
| a4p3δ | Extrasynaptický | Thalamické reléové buňky |
| a6p3δ | Extrasynaptický | Cerebelární granulární buňky |
| α1β2 | Extrasynaptický | Rozšířené |
| α1β3 | Extrasynaptický | Thalamus, hypotalamus |
| α1β2δ | Extrasynaptický | Hippocampus |
| a4β2δ | Extrasynaptický | Hippocampus |
| α3β3θ | Extrasynaptický | Hypotalamus |
| α3β3ε | Extrasynaptický | Hypotalamus |
Ligandy

Počet ligandy Bylo zjištěno, že se váží na různá místa na GABAA receptorový komplex a moduluje jej kromě samotné GABA.[který? ] Ligand může mít jednu nebo více vlastností následujících typů. Literatura bohužel často tyto typy správně nerozlišuje.
Typy
- Ortosterické agonisty a antagonisté: váže se na hlavní receptorové místo (místo, na které se normálně váže GABA, označované také jako „aktivní“ nebo „ortosterické“ místo). Agonisté aktivují receptor, což vede ke zvýšení Cl− vodivost. Antagonisté, i když sami o sobě nemají žádný účinek, soutěží s GABA o vazbu, a tím inhibují jeho působení, což vede ke snížení Cl− vodivost.
- Alosterické modulátory prvního řádu: váže se na alosterická místa na receptorovém komplexu a ovlivňuje je buď pozitivním (PAM), negativním (NAM) nebo neutrálním / tichým (SAM) způsobem, což způsobuje zvýšenou nebo sníženou účinnost hlavního místa, a proto nepřímé zvýšení nebo snížení Cl− vodivost. SAM neovlivňují vodivost, ale zabírají vazebné místo.
- Modulátory druhého řádu: váže se na alosterické místo na receptorovém komplexu a moduluje účinek modulátorů prvního řádu.
- Otevřete blokátory kanálů: prodloužit obsazenost ligandových receptorů, kinetiku aktivace a tok iontů Cl způsobem závislým na konfiguraci podjednotky a způsobem závislým na stavu senzibilizace.[37]
- Nekonkurenční blokátory kanálů: váže se na centrální póry komplexu receptorů nebo v jejich blízkosti a přímo blokuje Cl− vodivost iontovým kanálem.
Příklady
- Ortosterické agonisty: GABA, gaboxadol, isoguvacinu, muscimol, progabid, beta-alanin,[38][39] taurin,[39][38] kyselina piperidin-4-sulfonová (částečný agonista).
- Ortosterické antagonisty: bicuculline, gabazin.
- Pozitivní alosterické modulátory: barbituráty, benzodiazepiny jisté karbamáty (např. karisoprodol, meprobamát, lorbamát ), thienodiazepiny, alkohol (ethanol ), etomidát, glutethimid, kavalaktony,[40] meprobamát, chinazolinony (např. metachalon, etaqualone, diproqualone ), neuroaktivní steroidy,[41] niacin /niacinamid,[42] nonbenzodiazepiny (např. zolpidem, eszopiklon ), propofol, stiripentol,[43] theanin,[Citace je zapotřebí ] kyselina valerenová, těkavý / vdechovaný anestetika, lanthan,[44] a riluzol.[45]
- Negativní alosterické modulátory: flumazenil, Ro15-4513, sarmazenil, amentoflavon, a zinek.[46]
- Inverzní alosteričtí agonisté: beta-karboliny (např. Harmine, Harmalin, Tetrahydroharmin ).
- Modulátory druhého řádu: (-) - epigalokatechin-3-gallát.[47]
- Nekonkurenční blokátory kanálů: cicutoxin, oenanthotoxin, pentylenetetrazol, pikrotoxin[Citace je zapotřebí ], thujon, a lindan.
Účinky
Ligandy, které přispívají k aktivaci receptoru, obvykle mají anxiolytikum, antikonvulzivum, amnesický, sedativní, hypnotický, euforický, a svalová relaxancie vlastnosti. Někteří jako muscimol a z-léky může také být halucinogenní.[Citace je zapotřebí ] Ligandy, které snižují aktivaci receptoru, mají obvykle opačné účinky, včetně anxiogeneze a křeč.[Citace je zapotřebí ] Některé ze subtypově selektivních negativních alosterických modulátorů, jako je α5IA jsou vyšetřováni pro jejich nootropní účinky, stejně jako léčba nežádoucích vedlejších účinků jiných GABAergních léků.[48]
Nové léky
Užitečnou vlastností mnoha alosterických modulátorů benzodiazepinových míst je to, že mohou vykazovat selektivní vazbu na konkrétní podskupiny receptorů obsahujících specifické podjednotky. To umožňuje určit, která GABAA kombinace podjednotek receptorů převládají v konkrétních oblastech mozku a poskytují vodítko, které kombinace podjednotek mohou být odpovědné za behaviorální účinky léků působících na GABAA receptory. Tyto selektivní ligandy mohou mít farmakologické výhody v tom, že umožňují disociaci požadovaných terapeutických účinků od nežádoucích vedlejších účinků.[49] Několik podtypů selektivních ligandů se dosud dostalo do klinického použití, s výjimkou zolpidem což je přiměřeně selektivní pro α1, ale ve vývoji je několik selektivnějších sloučenin, jako je a3-selektivní droga adipiplon. Existuje mnoho příkladů sloučenin selektivních k podtypům, které se široce používají ve vědeckém výzkumu, včetně:
- CL-218 872 (vysoce α1- selektivní agonista)
- bretazenil (subtyp-selektivní částečný agonista)
- imidazenil a L-838 417 (oba parciální agonisté u některých podtypů, u jiných slabí antagonisté)
- QH-ii-066 (plný agonista vysoce selektivní pro α5 podtyp)
- α5IA (selektivní inverzní agonista pro α5 podtyp)
- SL-651,498 (plný agonista v α2 a α3 podtypy a jako částečný agonista v α1 a α5
- 3-acyl-4-chinolony: selektivní pro α1 nad α3[50]
Paradoxní reakce
Existuje několik náznaků, že paradoxní reakce například - benzodiazepiny, barbituráty, inhalační anestetika, propofol, neurosteroidy, a alkohol jsou spojeny se strukturálními odchylkami GABAA receptory. Kombinace pěti podjednotek receptoru (viz obrázky výše) může být změněna takovým způsobem, že například reakce receptoru na GABA zůstane nezměněna, ale odpověď na jednu z jmenovaných látek se dramaticky liší od normální.
Existují odhady, že asi 2–3% běžné populace mohou trpět vážnými emočními poruchami kvůli takovým odchylkám receptorů, až 20% trpí mírnými poruchami tohoto druhu. Obecně se předpokládá, že změny receptoru jsou alespoň částečně způsobeny genetický a také epigenetický odchylky. Existují náznaky, že toto může být vyvoláno mimo jiné, sociální stres nebo profesní vyhoření.[51][52][53][54]
Viz také
Reference
- ^ A b Richter L, de Graaf C, Sieghart W, Varagic Z, Mörzinger M, de Esch IJ, Ecker GF, Ernst M (březen 2012). „Modely receptoru GABAA vázané na diazepam identifikují nové ligandy vazebného místa benzodiazepinu“. Přírodní chemická biologie. 8 (5): 455–464. doi:10.1038 / nchembio.917. PMC 3368153. PMID 22446838.
- ^ Campagna-Slater V, Weaver DF (leden 2007). "Molekulární modelování proteinu iontového kanálu GABAA". Journal of Molecular Graphics & Modeling. 25 (5): 721–730. doi:10.1016 / j.jmgm.2006.06.001. PMID 16877018.
- ^ Sancar F, Ericksen SS, Kucken AM, Teissére JA, Czajkowski C (leden 2007). "Strukturní determinanty pro vysokoafinitní vazbu zolpidemu na receptory GABA-A". Molekulární farmakologie. 71 (1): 38–46. doi:10,1124 / mol 106,029595. PMC 2583146. PMID 17012619.
- ^ Oxfordská příručka stresu, zdraví a zvládání. Folkman, Susan. Oxford: Oxford University Press. 2011. ISBN 978-0-19-537534-3. OCLC 540015689.CS1 maint: ostatní (odkaz)
- ^ Kaila, K .; Voipio, J. (18. listopadu 1987). „Postsynaptický pokles intracelulárního pH vyvolaný GABA-aktivovanou hydrogenuhličitanovou vodivostí“. Příroda. 330 (6144): 163–165. Bibcode:1987 Natur.330..163K. doi:10.1038 / 330163a0. ISSN 0028-0836. PMID 3670401. S2CID 4330077.
- ^ Principy neurální vědy. Kandel, Eric R. ,, Schwartz, James H. (James Harris), 1932-2006 ,, Jessell, Thomas M. ,, Siegelbaum, Steven ,, Hudspeth, A. James ,, Mack, Sarah (5. vydání). New York. ISBN 978-1-283-65624-5. OCLC 919404585.CS1 maint: ostatní (odkaz)
- ^ Chua HC, Chebib M (2017). „GABA a receptory a rozmanitost v jejich struktuře a farmakologii“. Receptory GABAA a rozmanitost v jejich struktuře a farmakologii. Pokroky ve farmakologii. 79. s. 1–34. doi:10.1016 / bs.apha.2017.03.003. ISBN 978-0-12-810413-2. PMID 28528665.
- ^ Santhakumar V, Wallner M, Otis TS (květen 2007). „Ethanol působí přímo na extrasynaptické podtypy receptorů GABAA a zvyšuje tonickou inhibici“. Alkohol. 41 (3): 211–221. doi:10.1016 / j.alkohol.2007.04.011. PMC 2040048. PMID 17591544.
- ^ Johnston GA (1996). "Farmakologie receptoru GABAA". Farmakologie a terapeutika. 69 (3): 173–198. doi:10.1016/0163-7258(95)02043-8. PMID 8783370.
- ^ Sigel E (srpen 2002). "Mapování místa rozpoznávání benzodiazepinů na receptory GABA (A)". Aktuální témata v medicinální chemii. 2 (8): 833–839. doi:10.2174/1568026023393444. PMID 12171574.
- ^ Akabas MH (2004). Studie struktury a funkce receptoru GABAA: reexaminace ve světle nových struktur receptorů acetylcholinu. Mezinárodní přehled neurobiologie. 62. s. 1–43. doi:10.1016 / S0074-7742 (04) 62001-0. ISBN 978-0-12-366862-2. PMID 15530567.
- ^ Derry JM, Dunn SM, Davies M (březen 2004). „Identifikace zbytku v alfa podjednotce receptoru gama-aminomáselné kyseliny typu A, který odlišně ovlivňuje vazbu na diazepam citlivou a necitlivou vazbu na benzodiazepinové místo“. Journal of Neurochemistry. 88 (6): 1431–1438. doi:10.1046 / j.1471-4159.2003.02264.x. PMID 15009644.
- ^ Barnard EA, Skolnick P, Olsen RW, Mohler H, Sieghart W, Biggio G, Braestrup C, Bateson AN, Langer SZ (červen 1998). „International Union of Pharmacology. XV. Subtypes of gamma-aminobutyric acid A receptors: classification on the Subunit structure and receptor function“. Farmakologické recenze. 50 (2): 291–313. PMID 9647870.
- ^ Atack JR (srpen 2003). "Anxioselektivní sloučeniny působící na vazebném místě benzodiazepinových receptorů GABA (A)". Aktuální drogové cíle. CNS a neurologické poruchy. 2 (4): 213–232. doi:10.2174/1568007033482841. PMID 12871032.
- ^ Hanson SM, Czajkowski C (březen 2008). "Strukturální mechanismy, které jsou základem benzodiazepinové modulace receptoru GABA (A)". The Journal of Neuroscience. 28 (13): 3490–3499. doi:10.1523 / JNEUROSCI.5727-07.2008. PMC 2410040. PMID 18367615.
- ^ Twyman RE, Rogers CJ, Macdonald RL (březen 1989). „Diferenciální regulace kanálů receptorů gama-aminomáselné kyseliny diazepamem a fenobarbitalem“. Annals of Neurology. 25 (3): 213–220. doi:10,1002 / ana 410250302. hdl:2027.42/50330. PMID 2471436. S2CID 72023197.
- ^ Ernst M, Bruckner S, Boresch S, Sieghart W (listopad 2005). „Srovnávací modely extracelulárních a transmembránových domén receptoru GABAA: důležité poznatky o farmakologii a funkci“ (PDF). Molekulární farmakologie. 68 (5): 1291–1300. doi:10,1124 / mol. 105,015982. PMID 16103045. S2CID 15678338.
- ^ Vijayan RS, Trivedi N, Roy SN, Bera I, Manoharan P, Payghan PV, Bhattacharyya D, Ghoshal N (listopad 2012). "Modelování konformací uzavřeného a otevřeného stavu iontového kanálu GABA (A) - věrohodné strukturální poznatky pro hradlování kanálů". Journal of Chemical Information and Modeling. 52 (11): 2958–2969. doi:10.1021 / ci300189a. PMID 23116339.
- ^ Miller PS, Aricescu AR (srpen 2014). "Krystalová struktura lidského receptoru GABAA". Příroda. 512 (7514): 270–275. Bibcode:2014 Natur.512..270M. doi:10.1038 / příroda13293. PMC 4167603. PMID 24909990.
- ^ Phulera, svastika; Zhu, Hongtao; Yu, Jie; Claxton, Derek P; Yoder, Nate; Yoshioka, Craig; Gouaux, Eric (2018-07-25). "Kryo-EM struktura benzodiazepinově citlivého α1β1γ2S tri-heteromerního receptoru GABAA v komplexu s GABA". eLife. 7: e39383. doi:10,7554 / eLife.39383. ISSN 2050-084X. PMC 6086659. PMID 30044221.
- ^ Zhu S, Noviello CM, Teng J, Walsh RM, Kim JJ, Hibbs RE (červenec 2018). "Struktura lidské synaptické GABAA receptor ". Příroda. 559 (7712): 67–72. Bibcode:2018Natur.559 ... 67Z. doi:10.1038 / s41586-018-0255-3. PMC 6220708. PMID 29950725.
- ^ Wei W, Zhang N, Peng Z, Houser CR, Mody I (listopad 2003). „Perisynaptická lokalizace receptorů GABA (A) obsahujících delta podjednotku a jejich aktivace přeléváním GABA v myším zubatém gyrusu“. The Journal of Neuroscience. 23 (33): 10650–10661. doi:10.1523 / JNEUROSCI.23-33-10650.2003. PMC 6740905. PMID 14627650.
- ^ Farrant, Mark; Nusser, Zoltan (březen 2005). „Variace na inhibiční téma: fázická a tonická aktivace receptorů GABA (A)“. Recenze přírody. Neurovědy. 6 (3): 215–229. doi:10.1038 / nrn1625. ISSN 1471-003X. PMID 15738957.
- ^ Ben-Ari Y, Cherubini E, Corradetti R, Gaiarsa JL (září 1989). „Obrovské synaptické potenciály v nezralých hipokampálních neuronech CA3 krys“. The Journal of Physiology. 416: 303–325. doi:10.1113 / jphysiol.1989.sp017762. PMC 1189216. PMID 2575165.
- ^ Spitzer NC (březen 2010). „Jak GABA generuje depolarizaci“. The Journal of Physiology. 588 (Pt 5): 757–758. doi:10.1113 / jphysiol.2009.183574. PMC 2834934. PMID 20194137.
- ^ Olsen RW, DeLorey TM (1999). „Kapitola 16: GABA a glycin“. In Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD (eds.). Základní neurochemie: molekulární, buněčné a lékařské aspekty (Šesté vydání). Philadelphia: Lippincott-Raven. ISBN 978-0-397-51820-3.
- ^ Chen K, Li HZ, Ye N, Zhang J, Wang JJ (říjen 2005). „Úloha receptorů GABAB v GABA a baklofenem indukovaná inhibice neuronů cerebelárních interpositů jádra dospělých krys in vitro“. Bulletin výzkumu mozku. 67 (4): 310–318. doi:10.1016 / j.brainresbull.2005.07.004. PMID 16182939. S2CID 6433030.
- ^ Yarom M, Tang XW, Wu E, Carlson RG, Vander Velde D, Lee X, Wu J (2016-08-01). "Identifikace inosinu jako endogenního modulátoru pro vazebné místo benzodiazepinů receptorů GABAA". Journal of Biomedical Science. 5 (4): 274–280. doi:10.1007 / bf02255859. PMID 9691220.
- ^ Cossart R, Bernard C, Ben-Ari Y (únor 2005). „Více aspektů GABAergních neuronů a synapsí: více osudů signalizace GABA u epilepsií“. Trendy v neurovědách. 28 (2): 108–115. doi:10.1016 / j.tins.2004.11.011. PMID 15667934. S2CID 1424286.
- ^ A b Martin IL a Dunn SMJ. GABA receptory Přehled GABA a receptorů, na které se váže. Tocris Cookson LTD.
- ^ Enz R, Cutting GR (květen 1998). "Molekulární složení GABAC receptorů". Vision Vision. 38 (10): 1431–1441. doi:10.1016 / S0042-6989 (97) 00277-0. PMID 9667009. S2CID 14457042.
- ^ Olsen RW, Sieghart W (leden 2009). „GABA A receptory: podtypy poskytují rozmanitost funkcí a farmakologie“. Neurofarmakologie. 56 (1): 141–148. doi:10.1016 / j.neuropharm.2008.07.045. PMC 3525320. PMID 18760291.
- ^ Connolly CN, Krishek BJ, McDonald BJ, Smart TG, Moss SJ (leden 1996). "Sestava a exprese na povrchu buněk heteromerních a homomerních receptorů kyseliny gama-aminomáselné typu A". The Journal of Biological Chemistry. 271 (1): 89–96. doi:10.1074 / jbc.271.1.89. PMID 8550630.
- ^ Lorenzo LE, Russier M, Barbe A, Fritschy JM, Bras H (září 2007). „Diferenciální organizace gama-aminomáselné kyseliny typu A a glycinových receptorů v somatických a dendritických oddílech motoneuronů krysích únosů“. The Journal of Comparative Neurology. 504 (2): 112–126. doi:10.1002 / cne.21442. PMID 17626281.
- ^ ten Hoeve AL (2012). GABA receptory a imunitní systém. Teze, Utrecht University
- ^ Mortensen M, Patel B, Smart TG (leden 2011). „Potence GABA na receptorech GABA (A) nalezených v synaptických a extrasynaptických zónách“. Hranice v buněčné neurovědě. 6: 1. doi:10.3389 / fncel.2012.00001. PMC 3262152. PMID 22319471.
- ^ Haseneder R, Rammes G, Zieglgänsberger W, Kochs E, Hapfelmeier G (září 2002). „Aktivace receptoru GABA (A) a blokování otevřeného kanálu těkavými anestetiky: nový princip modulace receptoru?“. European Journal of Pharmacology. 451 (1): 43–50. doi:10.1016 / S0014-2999 (02) 02194-5. PMID 12223227.
- ^ A b Mori, Masahiro; Gähwiler, Beat H; Gerber, Urs (2002-02-15). „β-alanin a taurin jako endogenní agonisté na glycinových receptorech v hipokampu potkanů in vitro“. The Journal of Physiology. 539 (Pt 1): 191–200. doi:10.1113 / jphysiol.2001.013147. ISSN 0022-3751. PMC 2290126. PMID 11850512.
- ^ A b Horikoshi, T .; Asanuma, A .; Yanagisawa, K .; Anzai, K .; Goto, S. (září 1988). „Taurin a beta-alanin působí na receptory GABA i glycinu v oocytu Xenopus injikované myší mozkovou messenger RNA“. Výzkum mozku. 464 (2): 97–105. doi:10.1016 / 0169-328x (88) 90002-2. ISSN 0006-8993. PMID 2464409.
- ^ Hunter, A (2006). "Kava (Piper methysticum) zpět v oběhu". Australské centrum pro doplňkovou medicínu. 25 (7): 529.
- ^ (A) Herd MB, Belelli D, Lambert JJ (říjen 2007). „Neurosteroidová modulace synaptických a extrasynaptických receptorů GABA (A)“. Farmakologie a terapeutika. 116 (1): 20–34. arXiv:1607.02870. doi:10.1016 / j.pharmthera.2007.03.007. PMID 17531325.; b) Hosie AM, Wilkins ME, da Silva HM, Smart TG (listopad 2006). „Endogenní neurosteroidy regulují receptory GABAA prostřednictvím dvou diskrétních transmembránových míst“. Příroda. 444 (7118): 486–489. Bibcode:2006 Natur.444..486H. doi:10.1038 / nature05324. PMID 17108970. S2CID 4382394.; (C)Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A (září 2006). „Charakterizace mozkových neuronů, které exprimují enzymy zprostředkující biosyntézu neurosteroidů“. Sborník Národní akademie věd Spojených států amerických. 103 (39): 14602–14607. Bibcode:2006PNAS..10314602A. doi:10.1073 / pnas.0606544103. PMC 1600006. PMID 16984997.; d) Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S (prosinec 2005). „Neurosteroidní přístup k receptoru GABAA“. The Journal of Neuroscience. 25 (50): 11605–11613. doi:10.1523 / JNEUROSCI.4173-05.2005. PMC 6726021. PMID 16354918.; (E) Belelli D, Lambert JJ (červenec 2005). „Neurosteroidy: endogenní regulátory receptoru GABA (A)“. Recenze přírody. Neurovědy. 6 (7): 565–575. doi:10.1038 / nrn1703. PMID 15959466. S2CID 12596378.; (F) Pinna G, Costa E, Guidotti A (červen 2006). „Fluoxetin a norfluoxetin stereospecificky a selektivně zvyšují obsah neurosteroidů v mozku v dávkách, které jsou neaktivní při zpětném vychytávání 5-HT“. Psychofarmakologie. 186 (3): 362–372. doi:10.1007 / s00213-005-0213-2. PMID 16432684. S2CID 7799814.; (G) Dubrovsky BO (únor 2005). "Steroidy, neuroaktivní steroidy a neurosteroidy v psychopatologii". Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 29 (2): 169–192. doi:10.1016 / j.pnpbp.2004.11.001. PMID 15694225. S2CID 36197603.; (h) Mellon SH, Griffin LD (2002). „Neurosteroidy: biochemie a klinický význam“. Trendy v endokrinologii a metabolismu. 13 (1): 35–43. doi:10.1016 / S1043-2760 (01) 00503-3. PMID 11750861. S2CID 11605131.; (i) Puia G, Santi MR, Vicini S, Pritchett DB, Purdy RH, Paul SM, Seeburg PH, Costa E (květen 1990). "Neurosteroidy působí na rekombinantní lidské receptory GABAA". Neuron. 4 (5): 759–765. doi:10.1016 / 0896-6273 (90) 90202-Q. PMID 2160838. S2CID 12626366.; (j) Majewska MD, Harrison NL, Schwartz RD, Barker JL, Paul SM (květen 1986). „Metabolity steroidních hormonů jsou barbiturátové modulátory receptoru GABA“. Věda. 232 (4753): 1004–1007. Bibcode:1986Sci ... 232.1004D. doi:10.1126 / science.2422758. PMID 2422758.; (k) Reddy DS, Rogawski MA (2012). „Neurosteroidy - endogenní regulátory citlivosti na záchvaty a role v léčbě epilepsie“. In Noebels JL, Avoli M, Rogawski MA a kol. (eds.). Jasperovy základní mechanismy epilepsií [internet]. 4. vydání. Bethesda (MD): Národní centrum pro biotechnologické informace (USA). Národní centrum pro biotechnologické informace (USA).
- ^ Toraskar, Mrunmayee; Pratima R.P. Singh; Shashank Neve (2010). „STUDIE GABAERGICKÝCH AGONISTŮ“ (PDF). Deccan Journal of Pharmacology. 1 (2): 56–69. Archivovány od originál (PDF) dne 16. 10. 2013. Citováno 2013-02-12.
- ^ Fisher JL (leden 2009). „Antikonvulzivní stiripentol působí přímo na receptor GABA (A) jako pozitivní alosterický modulátor“. Neurofarmakologie. 56 (1): 190–197. doi:10.1016 / j.neuropharm.2008.06.004. PMC 2665930. PMID 18585399.
- ^ Boldyreva AA (říjen 2005). „Lanthan potencuje proudy aktivované GABA v potkaních pyramidových neuronech hipokampálního pole CA1“. Bulletin experimentální biologie a medicíny. 140 (4): 403–405. doi:10.1007 / s10517-005-0503-z. PMID 16671565. S2CID 13179025.
- ^ He Y, Benz A, Fu T, Wang M, Covey DF, Zorumski CF, Mennerick S (únor 2002). „Neuroprotektivní látka riluzol potencuje postsynaptickou funkci receptoru GABA (A)“. Neurofarmakologie. 42 (2): 199–209. doi:10.1016 / s0028-3908 (01) 00175-7. PMID 11804616. S2CID 24194421.
- ^ Hosie AM, Dunne EL, Harvey RJ, Smart TG (duben 2003). „Zinkem zprostředkovaná inhibice receptorů GABA (A): diskrétní vazebná místa jsou základem specificity podtypu“. Přírodní neurovědy. 6 (4): 362–369. doi:10.1038 / nn1030. PMID 12640458. S2CID 24096465.
- ^ Campbell, Erica L .; Chebib, Mary; Johnston, Graham A. R. (2004-10-15). „Dietní flavonoidy apigenin a (-) - epigalokatechin gallát zvyšují pozitivní modulaci diazepamu aktivace rekombinantních receptorů GABAA pomocí diazepamu“. Biochemická farmakologie. Šest desetiletí GABA. 68 (8): 1631–1638. doi:10.1016 / j.bcp.2004.07.022. ISSN 0006-2952.
- ^ Dawson GR, Maubach KA, Collinson N, Cobain M, Everitt BJ, MacLeod AM, Choudhury HI, McDonald LM, Pillai G, Rycroft W, Smith AJ, Sternfeld F, Tattersall FD, Wafford KA, Reynolds DS, Seabrook GR, Atack JR (Březen 2006). „Inverzní agonista selektivní pro receptory GABAA obsahující podjednotku alfa5 zvyšuje poznání“ (PDF). The Journal of Pharmacology and Experimental Therapeutics. 316 (3): 1335–1345. doi:10.1124 / jpet.105.092320. PMID 16326923. S2CID 6410599.
- ^ Da Settimo F, Taliani S, Trincavelli ML, Montali M, Martini C (2007). "Subtypy receptorů GABA A / Bz jako cíle pro selektivní léky". Současná léčivá chemie. 14 (25): 2680–2701. doi:10.2174/092986707782023190. PMID 17979718.
- ^ Lager E, Nilsson J, Østergaard Nielsen E, Nielsen M, Liljefors T, Sterner O (červenec 2008). "Afinita 3-acylem substituovaných 4-chinolonů v benzodiazepinovém místě receptorů GABA (A)". Bioorganická a léčivá chemie. 16 (14): 6936–6948. doi:10.1016 / j.bmc.2008.05.049. PMID 18541432.
- ^ Robin C, Trieger N (2002). „Paradoxní reakce na benzodiazepiny při intravenózní sedaci: zpráva o 2 případech a přehled literatury“. Anesth Prog. 49 (4): 128–132. PMC 2007411. PMID 12779114.
- ^ Paton, Carol (2002). „Benzodiazepiny a dezinhibice: recenze“. Psychiatrický bulletin. Royal College of Psychiatrists. 26 (12): 460–462. doi:10.1192 / pb.26.12.460. ISSN 0955-6036. PDF.
- ^ Bäckström, T .; Bixo, M .; Johansson, M .; Nyberg, S .; Ossewaarde, L .; Ragagnin, G .; Savic, I .; Strömberg, J .; Timby, E .; van Broekhoven, F .; van Wingen, G. (únor 2014). "Allopregnanolon a poruchy nálady". Pokrok v neurobiologii. 113: 88–94. doi:10.1016 / j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084.
- ^ Brown, Emery N .; Lydic, Ralph; Schiff, Nicholas D. (2010-12-30). Schwartz, Robert S. (ed.). „Celková anestézie, spánek a kóma“. New England Journal of Medicine. 363 (27): 2638–2650. doi:10.1056 / NEJMra0808281. ISSN 0028-4793. PMC 3162622. PMID 21190458.
Další čtení
- Olsen RW, DeLorey TM (1999). „Kapitola 16: GABA a glycin“. In Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD (eds.). Základní neurochemie: molekulární, buněčné a lékařské aspekty (Šesté vydání). Philadelphia: Lippincott-Raven. ISBN 978-0-397-51820-3.
- Olsen RW, Betz H (2005). „Kapitola 16: GABA a glycin“. In Siegel GJ, Albers RW, Brady S, Price DD (eds.). Základní neurochemie: Molekulární, buněčné a lékařské aspekty (Sedmé vydání). Boston: Academic Press. str. 291–302. ISBN 978-0-12-088397-4.
- Uusi-Oukari M, Korpi ER (březen 2010). „Regulace exprese podjednotky receptoru GABA (A) farmakologickými látkami“ (PDF). Farmakologické recenze. 62 (1): 97–135. doi:10.1124 / pr.109,002063. PMID 20123953. S2CID 12202117.
- Rudolph U (2015). Rozmanitost a funkce receptorů GABA: Pocta Hannsovi Möhlerovi (První vydání). Academic Press, Elsevier. ISBN 978-0-12-802660-1.
externí odkazy
- Receptory, + GABA-A v americké národní lékařské knihovně Lékařské předměty (Pletivo)
