Neurosteroid - Neurosteroid - Wikipedia
Neurosteroidy, také známý jako neuroaktivní steroidy, jsou endogenní nebo exogenní steroidy které se rychle mění neuronální vzrušivost interakcí s ligandem řízené iontové kanály a další buněčné povrchové receptory.[1][2] Termín neurosteroid byl vytvořen Francouzi fyziolog Étienne-Émile Baulieu a týká se steroidů syntetizovaných v mozku.[3][4] Termín, neuroaktivní steroid Termín "steroidy" označuje steroidy, které mohou být syntetizovány v mozku nebo syntetizovány pomocí endokrinní žláza, které se potom dostávají do mozku krví a mají vliv na funkci mozku.[5] Termín neuroaktivní steroidy poprvé vytvořili v roce 1992 Steven Paul a Robert Purdy. Kromě svých účinků na receptory neuronální membrány mohou některé z těchto steroidů také působit na genová exprese přes jadernou energii receptory steroidních hormonů. Neurosteroidy mají širokou škálu potenciálních klinických aplikací od sedace k léčbě epilepsie[6] a traumatické zranění mozku.[7][8] Ganaxolon, syntetický analog endogenního neurosteroidu alopregnanolon, je vyšetřován pro léčbu epilepsie.[9]
Klasifikace
Na základě rozdílů v aktivita a struktura, neurosteroidy lze obecně rozdělit do několika různých hlavních skupin.[3]
Inhibiční neurosteroidy
Tyto neurosteroidy působí inhibiční akce na neurotransmise. Chovají se jako pozitivní alosterické modulátory z GABAA receptor (zvláště δ podjednotka -obsahující izoformy ) a vlastnit, v žádném konkrétním pořadí, antidepresivum, anxiolytikum, snížení stresu, obohacující,[10] prosociální,[11] antiagresivní,[12] prosexuální,[11] sedativní, pro-spánek,[13] poznávací a narušení paměti,[Citace je zapotřebí ] analgetikum,[14] anestetikum, antikonvulzivum, neuroprotektivní, a neurogenní účinky.[3]
Mezi hlavní příklady patří tetrahydrodeoxykortikosteron (THDOC) androstan 3α-androstandiol, cholestan cholesterol a těhotenství pregnanolon (eltanolon), alopregnanolon (3α, 5α-THP).[15][16]
Vzrušující neurosteroidy
Tyto neurosteroidy mají vzrušující účinky na neurotransmisi. Chovají se mocně negativní alosterické modulátory GABAA receptor, slabé pozitivní alosterické modulátory NMDA receptor a / nebo agonisté z σ1 receptor, a většinou mají antidepresivum, anxiogenní, poznávací a vylepšení paměti, křečovitý, neuroprotektivní, a neurogenní účinky.[3]
Mezi hlavní příklady patří těhotné ženy pregnenolon sulfát (PS), epipregnanolon, a isopregnanolon (sepranolon), androstany dehydroepiandrosteron (DHEA; prasteron ), a dehydroepiandrosteron sulfát (DHEA-S; prasteron sulfát ) a cholestan 24(S) -hydroxycholesterol (Selektivní pro NMDA receptory; velmi účinný).[17]
Feromony
Feromony jsou neurosteroidy, které ovlivňují zejména mozkovou činnost hypotalamus funkce prostřednictvím aktivace vomeronazální receptor buňky.[18][19][20]
Zahrnují androstany androstadienol, androstadienon, androstenol, a androstenon a estrane estratetraenol.
Jiné neurosteroidy
Některé další endogenní steroidy, jako je pregnenolon,[21] progesteron,[22][23] estradiol,[5] a kortikosteron jsou také neurosteroidy. Na rozdíl od výše uvedených však tyto neurosteroidy nemodulují GABAA nebo NMDA receptory, a místo toho ovlivňují různé další receptory buněčného povrchu a negenomické cíle. Také mnoho endogenních steroidů, včetně pregnenolonu, progesteronu, kortikosteronu, deoxykortikosteron, DHEA a testosteron, jsou metabolizován do (jiných) neurosteroidů, účinně fungujících jako tzv proneurosteroidy.
Biosyntéza
Neurosteroidy jsou syntetizovány z cholesterol, který se přeměňuje na pregnenolon a poté na všechny ostatní endogenní steroidy. Neurosteroidy se produkují v mozku po lokální syntéze nebo přeměnou periferně derivovaných adrenálních steroidů nebo gonadálních steroidů. Hromadí se zejména v myelinizujících gliových buňkách, z cholesterolu nebo steroidních prekurzorů dovážených z periferních zdrojů.[24][25] 5α-reduktáza typu I a 3α-hydroxysteroid dehydrogenáza se podílejí na biosyntéze inhibičních neurosteroidů, zatímco 3β-hydroxysteroid dehydrogenáza a hydroxysteroid sulfotransferázy podílejí se na produkci excitačních neurosteroidů.[3]
Funkce
Některé hlavní známé biologické funkce neurosteroidů zahrnuje modulaci nervová plasticita,[26] učení se a Paměť procesy,[27] chování,[28][29] a náchylnost k záchvatům,[30] stejně jako reakce na stres, úzkost, a Deprese.[11][31] Zdá se, že neurosteroidy také hrají důležitou roli v různých sexuálně dimorfní chování a emoční reakce.[29]
Akutní stres zvyšuje hladiny inhibičních neurosteroidů, jako je alopregnanolon, a je známo, že tyto neurosteroidy působí proti mnoha účinkům stresu.[32] Je to podobné jako v případě endorfiny, které se uvolňují v reakci na stres a fyzickou bolest a působí proti negativním subjektivním účinkům těchto stavů. Jako takové bylo navrženo, že jedna z jejich biologických funkcí neuromodulátory může pomoci udržet emocionální homeostáza.[28][33] Chronický stres byla spojena se sníženou hladinou alopregnanolonu a změnou citlivosti alopregnanolonu na stres, psychiatrické poruchy, a osa hypotalamus-hypofýza-nadledviny dysregulace.[31][32]
Předpokládá se, že kolísání hladin inhibičních neurosteroidů v průběhu menstruační cyklus a těhotenství hrají důležitou roli v různých Ženy podmínky, počítaje v to předmenstruační syndrom (PMS), premenstruační dysforická porucha (PMDD), poporodní deprese (PPD), poporodní psychóza, a katameniální epilepsie.[34][35][36] Kromě toho se předpokládá, že změny hladin neurosteroidů mohou být součástí změn nálady, úzkosti a sexuální touhy, ke kterým dochází během puberta u obou pohlaví a během menopauza u žen.[3][37][38]
Zvýšené hladiny inhibičních neurosteroidů, konkrétně alopregnanolonu, mohou mít paradoxní účinky, jako například negativní nálada, úzkost, podrážděnost, a agrese.[39][40][41][42] Je to zřejmě proto, že tyto neurosteroidy, stejně jako jiné pozitivní alosterické modulátory GABAA receptor jako je benzodiazepiny, barbituráty, a ethanol,[34][42] mají dvoufázové účinky ve tvaru písmene U - střední hladiny (v rozmezí 1,5–2 nM / l celkového aloprogesteronu, které jsou přibližně ekvivalentní luteální fáze hladiny) inhibují aktivitu GABAA receptor, zatímco nižší a vyšší koncentrace usnadňují aktivitu receptoru.[40][41]
Biologická aktivita
Receptor sigma-1
| Sloučenina | K.i (nM) | Akce | Druh | Čj |
|---|---|---|---|---|
| Progesteron | 268 | Antagonista | morče | [44][45] |
| Deoxykortikosteron | 938 | Neznámý | morče | [44][45] |
| Testosteron | 1,014 | Neznámý | morče | [44][45] |
| Pregnenolon | ND | Agonista | ND | ND |
| Pregnenolon sulfát | 3,198 | Agonista | morče | [44][45] |
| DHEA | 3,700 | Agonista | ? | [45] |
| DHEA-S | ND | Agonista | ND | ND |
| Kortikosteron | 4,074 | Neznámý | morče | [44] |
Terapeutické aplikace
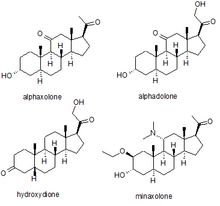
Anestézie
Několik syntetických neurosteroidů bylo použito jako sedativa za účelem celková anestézie pro provádění chirurgických zákroků. Nejznámější z nich jsou alfaxolon, alphadolone, hydroxydion, a minaxolon. Prvním z nich, který byl zaveden, byl hydroxydion, což je esterifikovaný 21-hydroxy derivát 5β-pregnandionu. Hydroxydion se ukázal jako užitečné anestetické léčivo s dobrým bezpečnostním profilem, ale bylo bolestivé a dráždivé, když byl injikován pravděpodobně kvůli špatné rozpustnosti ve vodě. To vedlo k vývoji novějších neuroaktivních steroidů. Dalším lékem z této rodiny, který měl být uveden na trh, byla směs alfaxolonu a alfadolonu, známá jako Althesin. Toto bylo staženo z humánního použití kvůli vzácným, ale závažným toxickým reakcím, ale stále se používá v veterinární medicína. Dalším neurosteroidním anestetikem zavedeným do humánní medicíny byl novější lék minaxolon, který je přibližně třikrát účinnější než althesin a zachovává si příznivý bezpečnostní profil bez problémů s toxicitou pozorovaných u althesinu. Avšak tento lék byl také nakonec stažen, ne kvůli problémům při klinickém použití, ale proto, že studie na zvířatech naznačovaly potenciální kancerogenitu a protože byla k dispozici alternativní činidla, mělo se za to, že možné riziko převažuje nad přínosem udržení léku na trhu.
Ganaxolon

Neurosteroid ganaxolon, analog metabolitu progesteronu alopregnanolonu, byl rozsáhle zkoumán na zvířecích modelech a je v současné době v klinických studiích léčby epilepsie. Neurosteroidy, včetně ganaxolonu, mají na zvířecích modelech široké spektrum aktivity.[46] Mohou mít výhody oproti jiným GABAA modulátory receptoru, zejména benzodiazepiny, u kterých se při dlouhodobém používání nezdá, že by došlo k toleranci.[47][48]
Randomizovaná, placebem kontrolovaná 10týdenní klinická studie fáze 2 s perorálně podávaným ganaxolonem u dospělých s parciálním záchvatem prokázala, že léčba je bezpečná, dobře tolerovaná a účinná.[9] Lék nadále prokazoval účinnost ve 104týdenní otevřené prodloužené době. Údaje z neklinických studií naznačují, že ganaxolon může mít nízké riziko pro použití v těhotenství. Kromě použití při léčbě epilepsie má lék potenciál při léčbě široké škály neurologických a psychiatrických stavů. V současné době probíhají studie konceptu posttraumatické stresové poruchy a syndromu křehkého X.
Katameniální epilepsie
Vědci navrhli jako způsob léčby použití takzvané „substituční léčby neurosteroidy“ katameniální epilepsie s neuroaktivními steroidy, jako je ganaxolon, během období menstruační cyklus když záchvat frekvence se zvyšuje.[6] Mikronizovaný progesteron, který se chová spolehlivě jako a proléčivo k alopregnanolonu, byla navržena jako léčba katameniální epilepsie stejným způsobem.[49]
Allopregnanolon
Allopregnanolon (SAGE-547) je ve vývoji jako intravenózní terapie pro léčbu superodolný status epilepticus, poporodní deprese, a zásadní třes.[50][51]
Další aplikace
4,16-Androstadien-3β-ol (PH94B, aloradin) je syntetický feromon, nebo pherine, neurosteroid, který je předmětem vyšetřování za účelem léčby úzkostné poruchy u žen.[19][20][52]
3β-methoxypregnenolon (MAP-4343), nebo pregnenolon 3β-methylether, je syntetický neuroaktivní steroid a pregnenolonový derivát, který interaguje s protein spojený s mikrotubuly 2 (MAP2) podobným způsobem jako pregnenolon a je vyvíjen pro potenciální klinické použití pro indikace, jako je léčba mozek a poranění míchy a depresivní poruchy.[53][54][55][56]
Role v antidepresivním působení
Určitý antidepresivum léky jako např fluoxetin a fluvoxamin, o kterých se obecně předpokládá, že ovlivňují depresi působením jako selektivní inhibitory zpětného vychytávání serotoninu Bylo také zjištěno, že (SSRI) normalizují hladiny určitých neurosteroidů (u depresivních pacientů často nedostatečných) v dávkách, které neaktivně ovlivňují zpětné vychytávání z serotonin. To naznačuje, že v účinnosti těchto léků proti depresi mohou být také zahrnuty další akce zahrnující neurosteroidy.[57][58]
Účinky benzodiazepinů na neurosteroidy
Benzodiazepiny mohou ovlivňovat metabolismus neurosteroidů na základě jejich působení na translokátorový protein (TSPO; „periferní benzodiazepinový receptor“).[59] The farmakologické působení benzodiazepinů na GABAA receptory jsou podobné těm z neurosteroidy. Faktory, které ovlivňují schopnost jednotlivých benzodiazepinů měnit hladiny neurosteroidů, mohou záviset na tom, zda jednotlivé benzodiazepinové léky interagují s TSPO. Některé benzodiazepiny mohou také inhibovat neurosteroidogenní enzymy snižující syntézu neurosteroidů.[60]
Viz také
Reference
- ^ Paul SM, Purdy RH (březen 1992). "Neuroaktivní steroidy". FASEB Journal. 6 (6): 2311–22. doi:10.1096 / fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Lan NC, Gee KW (prosinec 1994). "Neuroaktivní působení steroidů na receptoru GABAA". Hormony a chování. 28 (4): 537–44. doi:10.1006 / hbeh.1994.1052. PMID 7729823. S2CID 40697424.
- ^ A b C d E F Reddy DS (2010). „Neurosteroidy: endogenní role v lidském mozku a terapeutické potenciály“. Pokrok ve výzkumu mozku. 186: 113–37. doi:10.1016 / B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ Reddy DS, Rogawski MA (2012). „Neurosteroidy - endogenní regulátory citlivosti na záchvaty a role v léčbě epilepsie“. In Noebels JL, Avoli M, Rogawski MA a kol. (eds.). Jasperovy základní mechanismy epilepsií [internet]. 4. vydání. Bethesda (MD): Národní centrum pro biotechnologické informace (USA).
- ^ A b Srivastava DP, Waters EM, Mermelstein PG, Kramár EA, Shors TJ, Liu F (listopad 2011). „Rychlá estrogenová signalizace v mozku: důsledky pro jemné doladění neuronových obvodů“. The Journal of Neuroscience. 31 (45): 16056–63. doi:10.1523 / JNEUROSCI.4097-11.2011. PMC 3245715. PMID 22072656.
- ^ A b Reddy DS, Rogawski MA (duben 2009). „Neurosteroidová substituční léčba katameniální epilepsie“. Neuroterapeutika. 6 (2): 392–401. doi:10.1016 / j.nurt.2009.01.006. PMC 2682439. PMID 19332335.
- ^ Morrow AL (říjen 2007). „Nedávný vývoj významu a terapeutické relevance neuroaktivních steroidů - úvod do zvláštního čísla“. Farmakologie a terapeutika. 116 (1): 1–6. doi:10.1016 / j.pharmthera.2007.04.003. PMC 2047816. PMID 17531324.
- ^ Dubrovsky BO (únor 2005). "Steroidy, neuroaktivní steroidy a neurosteroidy v psychopatologii". Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 29 (2): 169–92. doi:10.1016 / j.pnpbp.2004.11.001. PMID 15694225. S2CID 36197603.
- ^ A b Bialer M, Johannessen SI, Levy RH, Perucca E, Tomson T, White HS (leden 2013). „Zpráva o pokroku v oblasti nových antiepileptik: shrnutí jedenácté konference v Eilatu (EILAT XI)“. Výzkum epilepsie. 103 (1): 2–30. doi:10.1016 / j.eplepsyres.2012.10.001. PMID 23219031.
- ^ Rougé-Pont F, Mayo W, Marinelli M, Gingras M, Le Moal M, Piazza PV (červenec 2002). „Neurosteroid alopregnanolon zvyšuje uvolňování dopaminu a dopaminergní reakci na morfin v nucleus accumbens krysy“. Evropský žurnál neurovědy. 16 (1): 169–73. doi:10.1046 / j.1460-9568.2002.02084.x. PMID 12153544. S2CID 9953445.
- ^ A b C Frye CA (prosinec 2009). „Účinky a mechanismy neurosteroidů pro sociální, kognitivní, emoční a fyzické funkce“. Psychoneuroendokrinologie. 34 Suppl 1: S143-61. doi:10.1016 / j.psyneuen.2009.07.005. PMC 2898141. PMID 19656632.
- ^ Pinna G, Costa E, Guidotti A (únor 2005). „Změny v biosyntéze testosteronu a alopregnanolonu v mozku vyvolávají agresivní chování“. Sborník Národní akademie věd Spojených států amerických. 102 (6): 2135–40. Bibcode:2005PNAS..102.2135P. doi:10.1073 / pnas.0409643102. PMC 548579. PMID 15677716.
- ^ Terán-Pérez G, Arana-Lechuga Y, Esqueda-León E, Santana-Miranda R, Rojas-Zamorano JÁ, Velázquez Moctezuma J (říjen 2012). "Steroidní hormony a regulace spánku". Mini recenze v medicinální chemii. 12 (11): 1040–8. doi:10.2174/138955712802762167. PMID 23092405.
- ^ Patte-Mensah C, Meyer L, Taleb O, Mensah-Nyagan AG (únor 2014). „Potenciální role alopregnanolonu pro bezpečnou a účinnou terapii neuropatické bolesti“. Pokrok v neurobiologii. 113: 70–8. doi:10.1016 / j.pneurobio.2013.07.004. PMID 23948490. S2CID 207407077.
- ^ Hénin J, Salari R, Murlidaran S, Brannigan G (2014). „Predikované vazebné místo pro cholesterol na receptoru GABAA“. Biophys. J. 106 (9): 1938–49. Bibcode:2014BpJ ... 106.1938H. doi:10.1016 / j.bpj.2014.03.024. PMC 4017285. PMID 24806926.
- ^ Levitan, Irena; Singh, Dev K .; Rosenhouse-Dantsker, Avia (2014). "Vazba cholesterolu na iontové kanály". Hranice ve fyziologii. 5: 65. doi:10.3389 / fphys.2014.00065. ISSN 1664-042X. PMC 3935357. PMID 24616704.
- ^ Paul, S. M .; Doherty, J. J .; Robichaud, A. J .; Belfort, G. M .; Chow, B. Y .; Hammond, R. S .; Crawford, D. C .; Linsenbardt, A. J .; Shu, H.-J .; Izumi, Y .; Mennerick, S. J .; Zorumski, C. F. (2013). „Hlavní metabolit cholesterolu v mozku 24 (S) -hydroxycholesterol je silným alosterickým modulátorem N-methyl-D-aspartátových receptorů“. Journal of Neuroscience. 33 (44): 17290–17300. doi:10.1523 / JNEUROSCI.2619-13.2013. ISSN 0270-6474. PMC 3812502. PMID 24174662.
- ^ Christopher H. Hawkes; Richard L. Doty (12. února 2009). Neurologie čichu. Cambridge University Press. str. 37–. ISBN 978-0-521-68216-9.
- ^ A b Monti-Bloch L, Jennings-White C, Dolberg DS, Berliner DL (1994). "Lidský vomeronasální systém". Psychoneuroendokrinologie. 19 (5–7): 673–86. doi:10.1016/0306-4530(94)90049-3. PMID 7938363. S2CID 36129626.
- ^ A b Liebowitz MR, Salman E, Nicolini H, Rosenthal N, Hanover R, Monti L (červen 2014). „Účinek akutní intranazální aerosolové dávky PH94B na sociální a výkonnostní úzkost u žen se sociální úzkostnou poruchou“. American Journal of Psychiatry. 171 (6): 675–82. doi:10.1176 / appi.ajp.2014.12101342. PMID 24700254.
- ^ Marx CE, Bradford DW, Hamer RM, Naylor JC, Allen TB, Lieberman JA, Strauss JL, Kilts JD (září 2011). „Pregnenolon jako nový terapeutický kandidát na schizofrenii: objevující se preklinické a klinické důkazy“. Neurovědy. 191: 78–90. doi:10.1016 / j.neuroscience.2011.06.076. PMID 21756978. S2CID 26396652.
- ^ Baulieu E, Schumacher M (2000). „Progesteron jako neuroaktivní neurosteroid, se zvláštním zřetelem na účinek progesteronu na myelinaci“. Steroidy. 65 (10–11): 605–12. doi:10.1016 / s0039-128x (00) 00173-2. PMID 11108866. S2CID 14952168.
- ^ Thomas P, Pang Y (2012). „Membránové receptory progesteronu: důkazy neuroprotektivních, neurosteroidových signalizací a neuroendokrinních funkcí v neuronálních buňkách“. Neuroendokrinologie. 96 (2): 162–71. doi:10.1159/000339822. PMC 3489003. PMID 22687885.
- ^ Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A (září 2006). „Charakterizace mozkových neuronů, které exprimují enzymy zprostředkující biosyntézu neurosteroidů“. Sborník Národní akademie věd Spojených států amerických. 103 (39): 14602–7. Bibcode:2006PNAS..10314602A. doi:10.1073 / pnas.0606544103. PMC 1600006. PMID 16984997.
- ^ Mellon SH, Griffin LD (2002). „Neurosteroidy: biochemie a klinický význam“. Trendy v endokrinologii a metabolismu. 13 (1): 35–43. doi:10.1016 / S1043-2760 (01) 00503-3. PMID 11750861. S2CID 11605131.
- ^ Benarroch EE (březen 2007). „Neurosteroidy: endogenní modulátory neuronální excitability a plasticity“. Neurologie. 68 (12): 945–7. doi:10.1212 / 01.wnl.0000257836.09570.e1. PMID 17372131. S2CID 219216099.
- ^ Vallée M, Mayo W, Koob GF, Le Moal M (2001). "Neurosteroidy v procesech učení a paměti". Mezinárodní přehled neurobiologie. 46: 273–320. doi:10.1016 / s0074-7742 (01) 46066-1. ISBN 9780123668462. PMID 11599303.
- ^ A b Engel SR, Grant KA (2001). "Neurosteroidy a chování". Mezinárodní přehled neurobiologie. 46: 321–48. doi:10.1016 / S0074-7742 (01) 46067-3. ISBN 9780123668462. PMID 11599304.
- ^ A b Král SR (2008). "Vznikající role neurosteroidů v sexuálním chování a funkci". Journal of Andrology. 29 (5): 524–33. doi:10.2164 / jandrol.108.005660. PMID 18567641.
- ^ Joshi S, Rajasekaran K, Kapur J (červen 2013). „GABAergický přenos u epilepsie spánkového laloku: role neurosteroidů“. Experimentální neurologie. 244: 36–42. doi:10.1016 / j.expneurol.2011.10.028. PMC 3319002. PMID 22101060.
- ^ A b Girdler SS, Klatzkin R (říjen 2007). „Neurosteroidy v kontextu stresu: důsledky pro depresivní poruchy“. Farmakologie a terapeutika. 116 (1): 125–39. doi:10.1016 / j.pharmthera.2007.05.006. PMC 2650267. PMID 17597217.
- ^ A b Bali A, Jaggi AS (leden 2014). "Multifunkční aspekty alopregnanolonu ve stresu a souvisejících poruchách". Pokrok v neuro-psychofarmakologii a biologické psychiatrii. 48: 64–78. doi:10.1016 / j.pnpbp.2013.09.005. PMID 24044974. S2CID 21399549.
- ^ Gunn BG, Cunningham L, Mitchell SG, Swinny JD, Lambert JJ, Belelli D (leden 2015). „Neurosteroidy působící na receptory GABAA: role ve vývoji a regulaci stresové reakce“. Frontiers in Neuroendocrinology. 36: 28–48. doi:10.1016 / j.yfrne.2014.06.001. PMC 4349499. PMID 24929099.
- ^ A b Bäckström T, Andersson A, Andreé L, Birzniece V, Bixo M, Björn I, Haage D, Isaksson M, Johansson IM, Lindblad C, Lundgren P, Nyberg S, Odmark IS, Strömberg J, Sundström-Poromaa I, Turkmen S, Wahlström G, Wang M, Wihlbäck AC, Zhu D, Zingmark E (prosinec 2003). „Patogeneze u poruch CNS souvisejících s menstruačním cyklem“. Annals of the New York Academy of Sciences. 1007 (1): 42–53. Bibcode:2003NYASA1007 ... 42B. doi:10.1196 / annals.1286.005. PMID 14993039. S2CID 20995334.
- ^ Guille C, Spencer S, Cavus I, Epperson CN (červenec 2008). „Role pohlavních steroidů při katameniální epilepsii a premenstruační dysforické poruše: důsledky pro diagnostiku a léčbu“. Epilepsie a chování. 13 (1): 12–24. doi:10.1016 / j.yebeh.2008.02.004. PMC 4112568. PMID 18346939.
- ^ Finocchi C, Ferrari M (květen 2011). "Ženské reprodukční steroidy a neuronální dráždivost". Neurologické vědy. 32 Suppl 1: S31-5. doi:10.1007 / s10072-011-0532-5. PMID 21533709. S2CID 8885335.
- ^ Genazzani AR, Bernardi F, Monteleone P, Luisi S, Luisi M (2000). „Neuropeptidy, neurotransmitery, neurosteroidy a nástup puberty“. Annals of the New York Academy of Sciences. 900 (1): 1–9. Bibcode:2000NYASA.900 ... 1G. doi:10.1111 / j.1749-6632.2000.tb06210.x. PMID 10818386. S2CID 19302118.
- ^ Melcangi RC, Panzica G, Garcia-Segura LM (září 2011). "Neuroaktivní steroidy: zaměření na lidský mozek". Neurovědy. 191: 1–5. doi:10.1016 / j.neuroscience.2011.06.024. hdl:10261/61590. PMID 21704130. S2CID 55704799.
- ^ Andréen L, Sundström-Poromaa I, Bixo M, Nyberg S, Bäckström T (srpen 2006). „Allopregnanolon koncentrace a nálada - bimodální asociace u postmenopauzálních žen léčených perorálním progesteronem“. Psychofarmakologie. 187 (2): 209–21. doi:10.1007 / s00213-006-0417-0. PMID 16724185. S2CID 1933116.
- ^ A b Bäckström T, Haage D, Löfgren M, Johansson IM, Strömberg J, Nyberg S, Andréen L, Ossewaarde L, van Wingen GA, Turkmen S, Bengtsson SK (září 2011). „Paradoxní účinky modulátorů GABA-A mohou u některých osob vysvětlovat negativní příznaky nálady vyvolané pohlavními steroidy“. Neurovědy. 191: 46–54. doi:10.1016 / j.neuroscience.2011.03.061. PMID 21600269. S2CID 38928854.
- ^ A b Andréen L, Nyberg S, Turkmen S, van Wingen G, Fernández G, Bäckström T (září 2009). „Negativní náladu vyvolanou pohlavními steroidy lze vysvětlit paradoxním účinkem zprostředkovaným modulátory GABAA“. Psychoneuroendokrinologie. 34 (8): 1121–32. doi:10.1016 / j.psyneuen.2009.02.003. PMID 19272715. S2CID 22259026.
- ^ A b Bäckström T, Bixo M, Johansson M, Nyberg S, Ossewaarde L, Ragagnin G, Savic I, Strömberg J, Timby E, van Broekhoven F, van Wingen G (únor 2014). "Allopregnanolon a poruchy nálady". Pokrok v neurobiologii. 113: 88–94. doi:10.1016 / j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084.
- ^ Maurice T, Urani A, Phan VL, Romieu P (2001). „Interakce mezi neuroaktivními steroidy a funkcí receptoru sigma1: důsledky chování a terapeutické příležitosti“. Brain Res. Brain Res. Rev. 37 (1–3): 116–32. doi:10.1016 / s0165-0173 (01) 00112-6. PMID 11744080. S2CID 44931783.
- ^ A b C d E Su TP, London ED, Jaffe JH (1988). „Vazba steroidů na sigma receptory naznačuje souvislost mezi endokrinním, nervovým a imunitním systémem“. Věda. 240 (4849): 219–21. Bibcode:1988Sci ... 240..219S. doi:10.1126 / science.2832949. PMID 2832949.
- ^ A b C d E Takebayashi M, Hayashi T, Su TP (2004). „Pohled na nový mechanismus antidepresiv: neuritogeneze přes receptory sigma-1“. Farmakopsychiatrie. 37 Suppl 3: S208–13. doi:10.1055 / s-2004-832679. PMID 15547787.
- ^ Rogawski MA, Reddy DS, 2004. Neurosteroidy: endogenní modulátory náchylnosti k záchvatům. In: Rho, J.M., Sankar, R., Cavazos, J. (Eds.), Epilepsy: Scientific Foundations of Clinical Practice. Marcel Dekker, New York, 2004; 319-355.
- ^ Kokate TG, Yamaguchi S, Pannell LK, Rajamani U, Carroll DM, Grossman AB, Rogawski MA (listopad 1998). "Nedostatek antikonvulzivní tolerance k neuroaktivnímu steroidu pregnanolonu u myší". The Journal of Pharmacology and Experimental Therapeutics. 287 (2): 553–8. PMID 9808680.
- ^ Reddy DS, Rogawski MA (prosinec 2000). „Chronická léčba neuroaktivním steroidem ganaxolonem u potkanů vyvolává antikonvulzivní toleranci k diazepamu, ale nikoli k němu samotnému“. The Journal of Pharmacology and Experimental Therapeutics. 295 (3): 1241–8. PMID 11082461.
- ^ Orrin Devinsky; Steven Schachter; Steven Pacia (1. ledna 2005). Doplňkové a alternativní terapie pro epilepsii. Demos Medical Publishing. 378–. ISBN 978-1-934559-08-6.
- ^ http://adisinsight.springer.com/drugs/800039944
- ^ http://www.sagerx.com/programs.php#547
- ^ Griebel G, Holmes A (září 2013). „50 let překážek a naděje v objevování anxiolytik“ (PDF). Recenze přírody. Objev drog. 12 (9): 667–87. doi:10.1038 / nrd4075. PMC 4176700. PMID 23989795.
- ^ http://adisinsight.springer.com/drugs/800034216
- ^ Duchossoy Y, David S, Baulieu EE, Robel P (2011). "Léčba experimentálního poranění míchy 3β-methoxypregnenolonem". Brain Res. 1403: 57–66. doi:10.1016 / j.brainres.2011.05.065. PMID 21704982. S2CID 42657539.
- ^ Bianchi M, Baulieu EE (2012). „3β-Methoxy-pregnenolon (MAP4343) jako inovativní terapeutický přístup pro depresivní poruchy“. Proc. Natl. Acad. Sci. USA. 109 (5): 1713–8. Bibcode:2012PNAS..109.1713B. doi:10.1073 / pnas.1121485109. PMC 3277154. PMID 22307636.
- ^ Baulieu ÉÉ (2015). „Od steroidních hormonů po depresivní stavy a senilní demence: nové mechanistické, terapeutické a prediktivní přístupy“. Zahrnuje biologie Rendus. 338 (8–9): 613–6. doi:10.1016 / j.crvi.2015.06.003. PMID 26251072.
- ^ Uzunova V, Sheline Y, Davis JM, Rasmusson A, Uzunov DP, Costa E, Guidotti A (březen 1998). „Zvýšení obsahu mozkomíšního moku v neurosteroidech u pacientů s unipolární těžkou depresí, kteří dostávají fluoxetin nebo fluvoxamin“. Sborník Národní akademie věd Spojených států amerických. 95 (6): 3239–44. Bibcode:1998PNAS ... 95.3239U. doi:10.1073 / pnas.95.6.3239. PMC 19726. PMID 9501247.
- ^ Pinna G, Costa E, Guidotti A (červen 2006). „Fluoxetin a norfluoxetin stereospecificky a selektivně zvyšují obsah neurosteroidů v mozku v dávkách, které jsou neaktivní při zpětném vychytávání 5-HT“. Psychofarmakologie. 186 (3): 362–72. doi:10.1007 / s00213-005-0213-2. PMID 16432684. S2CID 7799814.
- ^ Dhir A, Rogawski MA (duben 2012). „Role neurosteroidů v antikonvulzivní aktivitě midazolamu“. British Journal of Pharmacology. 165 (8): 2684–91. doi:10.1111 / j.1476-5381.2011.01733.x. PMC 3423249. PMID 22014182.
- ^ Usami N, Yamamoto T, Shintani S, Ishikura S, Higaki Y, Katagiri Y, Hara A (duben 2002). „Substrátová specificita lidské 3 (20) alfa-hydroxysteroiddehydrogenázy pro neurosteroidy a její inhibice benzodiazepiny“ (pdf). Biologický a farmaceutický bulletin. 25 (4): 441–5. doi:10,1248 / bpb.25,441. PMID 11995921.
Další čtení
- Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S (prosinec 2005). „Neurosteroidní přístup k receptoru GABAA“. The Journal of Neuroscience. 25 (50): 11605–13. doi:10.1523 / JNEUROSCI.4173-05.2005. PMC 6726021. PMID 16354918.
- Wang JM, Johnston PB, Ball BG, Brinton RD (květen 2005). „Neurosteroid alopregnanolon podporuje proliferaci buněk hlodavců a lidských nervových progenitorů a reguluje expresi genů a proteinů v buněčném cyklu“. The Journal of Neuroscience. 25 (19): 4706–18. doi:10.1523 / JNEUROSCI.4520-04.2005. PMC 6724768. PMID 15888646.
- Dong E, Matsumoto K, Uzunova V, Sugaya I, Takahata H, Nomura H, Watanabe H, Costa E, Guidotti A (únor 2001). „Mozková syntéza 5alfa-dihydroprogesteronu a alopregnanolonu v myším modelu vleklé sociální izolace“. Sborník Národní akademie věd Spojených států amerických. 98 (5): 2849–54. Bibcode:2001PNAS ... 98.2849D. doi:10.1073 / pnas.051628598. PMC 30228. PMID 11226329.
- Melcangi RC, Celotti F, Martini L (březen 1994). „Redukce progesteron 5-alfa v neuronech a v různých typech kultur gliových buněk: astrocyty a oligodendrocyty typu 1 a 2“. Výzkum mozku. 639 (2): 202–6. doi:10.1016/0006-8993(94)91731-0. PMID 8205473. S2CID 37105244.
- Corpéchot C, Robel P, Axelson M, Sjövall J, Baulieu EE (srpen 1981). "Charakterizace a měření dehydroepiandrosteron sulfátu v mozku krysy". Sborník Národní akademie věd Spojených států amerických. 78 (8): 4704–7. Bibcode:1981PNAS ... 78.4704C. doi:10.1073 / pnas.78.8.4704. PMC 320231. PMID 6458035.
- Reddy D, Rogawski MA (2012). „Neurosteroidy - endogenní regulátory citlivosti na záchvaty a role v léčbě epilepsie“. In Noebels JL, Avoli M, Rogawski MA a kol. (eds.). Jasperovy základní mechanismy epilepsií (4. vydání). Bethesda (MD): Národní centrum pro biotechnologické informace. PMID 22787590.
